響應面分析法優化雨生紅球藻產蝦青素培養基
徐建春,孫 翰,張睿欽,管 斌 *,孔 青,耿兆艷,李 霞
(1.青島瑯琊臺集團股份有限公司,山東青島,266400;2.中國海洋大學食品科學與工程學院,山東青島,266003)
蝦青素(astaxanthin,AX)是一種酮式類胡蘿卜素[1],化學名稱為3,3’-二羥基-4,4’-二酮基-β,β’-胡蘿卜素,分子式為C40H52O4。蝦青素具有極強的抗氧化活性,極易與自由基反應而清除自由基[2-5],其抗氧化性是β-胡蘿卜素的10倍,維生素E的500倍[6],被譽為超級維生素。其在食品、水產養殖及醫藥方面有著廣泛的應用前景[7-9]。
雨生紅球藻(Haematococcus pluvialis)是蝦青素的良好來源[10],而且雨生紅球藻所含蝦青素是3S-3’S異構體,與水生動物所含蝦青素極為相似,易被生物體吸收[11],雨生紅球藻被認為是自然界積累天然蝦青素能力最強的生物。這是通過化學合成以及利用紅發夫酵母發酵的蝦青素所不具備的優勢[12]。
培養基質是雨生紅球藻生長和蝦青素積累的重要因子,是影響雨生紅球藻培養及蝦青素擴大工業化生產的要素[13-14]。本研究采用響應面分析法,對雨生紅球藻混合培養過程中的轉化培養基的碳源、氮源和磷源進行優化,以獲得更大的生物濃度和蝦青素產量。
1 材料與方法
1.1 材料與試劑
1.1.1 藻種
雨生紅球藻(Haematococcus pluvialis)誘變菌株:中國海洋大學生物工藝學研究室保存。
1.1.2 培養基
微藻培養基為改良的MCM培養基:葡萄糖3 g/L,KNO30.5 g/L,KH2PO40.02 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.08 g/L,Fe-EDTA 100 μL/L,微量元素100 μL/L,pH值調至8.0。
Fe-ED TA 溶 液:EDTA·2Na 3.72 g/L,FeSO4·7H2O 4.17g/L。
微量元素母液:H3PO412.37 mg/L,ZnSO471.89 mg/L,MnSO4·H2O 84.51 mg/L,CuSO4·5H2O62.42mg/L,Na2MoO4·2H2O 7.26 mg/L,CoCl2·2H2O4.76 mg/L。
微藻的生長培養基中加入1.6 g/L NaAc或者葡萄糖3 g/L,其余成分與藻種培養基相同,pH調至8.0。
轉化培養基:乙酸鈉1.5.g/L,KNO30.5 g/L,KH2PO40.02 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.08 g/L,Fe-EDTA 100 μL/L,微量元素100 μL/L,pH值調至8.0。
試驗所用的化學試劑均為國產分析純。
1.2 儀器與設備
QHX-250BS-Ⅲ人工氣候箱:上海新苗醫療器械制造有限公司;SPS202F電子天平:梅特勒-托利多(常州)設備有限公司;PHS-2F數字pH計:上海精密試驗設備有限公司;722N可見分光光度計:上海精科儀器有限公司;JY92-Ⅱ型超聲波細胞破碎器:寧波新芝生物科技股份有限公司;UV-2802PC紫外分光光度計:尤尼柯儀器有限公司。
1.3 試驗方法
1.3.1 培養基主要成分對蝦青素積累的影響
(1)碳源對蝦青素積累的影響
本研究為培養及轉化基質提供了乙酸鈉和葡萄糖兩種碳源,并對比選擇最優轉化碳源。固定氮源為0.01 g/L KNO3,磷源為0.01 g/L KH2PO4,設置乙酸鈉質量濃度分別為0.2 g/L、0.5 g/L、0.8 g/L、1.0 g/L、1.5 g/L、2.0 g/L,葡萄糖質量濃度分別設置為2.0 g/L、3.0 g/L、4.0 g/L,培養7 d后,然后將微藻液分別裝入50 mL離心管,5 000 r/min離心10 min,除去上清液,將微藻細胞分別轉接入裝有不同乙酸鈉和葡萄糖的培養基(每份50 mL)中進行藻細胞的轉化,將在原培養基中轉化的組別作為對照組,測定不同碳源對蝦青素含量的影響。
(2)KNO3的含量對蝦青素積累的影響
在轉化培養基中固定碳源為0.5 g/L 乙酸鈉,磷源為0.01 g/L KH2PO4,設置KNO3質量濃度分別為0、0.005 g/L、0.01 g/L、0.04 g/L、0.07 g/L、0.10 g/L。培養基其余成分及其他試驗條件不變。雨生紅球藻在生長條件下,培養7 d后,然后將培養藻液分別在5 000 r/min條件下離心10 min,除去上清液,將藻細胞分別轉接入轉化培養基中進行藻細胞的轉化,測定蝦青素含量。
(3)KH2PO4含量對蝦青素積累的影響
在轉化培養基中固定碳源為0.5 g/L 乙酸鈉,氮源為0.01g/LKNO3,設置KH2PO4質量濃度分別為0、0.01g/L、0.1g/L、0.2 g/L、0.3 g/L。培養基其余成分含量不變。其他試驗條件不變。雨生紅球藻在生長條件下,培養7 d后,然后將培養藻液分別在5 000 r/min條件下離心10 min,除去上清液,將藻細胞分別轉接入轉化培養基中進行藻細胞的轉化,測定蝦青素含量。
1.3.2 中心組合試驗設計(CCD)優化轉化培養基
雨生紅球藻在生長條件下,培養7 d后,然后將培養藻液分別在5 000 r/min條件下離心10 min,除去上清液,將藻細胞分別轉接入轉化培養基中進行藻細胞的轉化,測定蝦青素含量。在單因素試驗的基礎上,設計二因素三水平的中心組合試驗設計(central composite design,CCD)優化培養基成分。選取乙酸鈉、KNO3添加量兩個因素三個水平進行中心組合試驗,因素與水平見表1。

表1 雨生紅球藻轉化培養基優化CCD試試驗的因素與水平Table 1 Factor and levels of central composite design for transformation medium optimization
1.3.3 微藻細胞培養、轉化方法及指標測定
培養方法:以10%的接種量將藻種接入100 mL培養液中,22 ℃,光照1 000~1 500 lx,光周期12∶12(光照培養時間12 h∶暗培養時間12 h),培養7 d。轉化方法:30 ℃,光照強度5 000~5 500 lx,全天光照,轉化5 d。
細胞密度的測定:利用722N可見分光光度計測定680 nm波長處的吸光度值。
細胞形態的觀察:顯微鏡放大160倍進行觀察。
蝦青素含量的測定:參考文獻[15]的方法,并進行適當修改。移取5 mL孢子態的藻體,4 000 r/mim離心10 min,除上清,收集藻體,加入2 mL甲醇/KOH溶液(30%甲醇和5%KOH等體積混合液)振蕩,使藻體均勻分散后置于65 ℃恒溫水浴中加熱15 min,4 000 r/min離心15 min,去除上清液,沉淀加蒸餾水洗滌2次,去除殘留堿液。上述藻體加入5 mL二甲基亞砜,200 W超聲波破碎10 min,離心收集上清液,沉淀加入二甲基亞砜重復提取,直至藻體沉淀變白,40 ℃振蕩提取20 min,紅色上清液于波長490 nm條件下測定吸光度值。
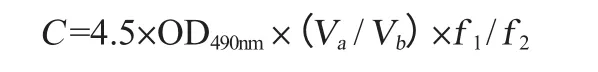
式中:C為蝦青素含量,mg/L;OD490為波長490 nm條件下的吸光度值;Va為提取液體積,mL;Vb為藻液體積,mL;f1為測吸光度值時的稀釋倍數;f2為轉化過程中水蒸發帶來的濃縮倍數。
2 結果與分析
2.1 碳源對蝦青素積累的影響
(1)乙酸鈉含量對蝦青素積累的影響
雨生紅球藻細胞在一定培養以及轉化條件下,不同乙酸鈉濃度對蝦青素積累的影響,結果如圖1所示。
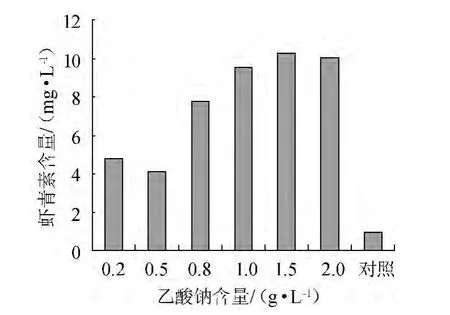
圖1 乙酸鈉含量對蝦青素生成量的影響Fig.1 Effect of sodium acetate content on astaxanthin production
由圖1可值,當乙酸鈉含量<1.5 g/L范圍內,蝦青素含量隨乙酸鈉含量增加而增加;當乙酸鈉含量為1.5 g/L時,蝦青素含量達到最高(10.25 mg/L),是對照的10.48倍;當乙酸鈉含量>1.5 g/L,蝦青素含量隨乙酸鈉含量增加而減少。利用乙酸鈉進行異養培養可顯著促進蝦青素生物轉化。
(2)葡萄糖含量對蝦青素積累的影響
雨生紅球藻細胞在一定培養以及轉化條件下,不同葡萄糖含量對蝦青素積累的影響,結果如圖2所示。
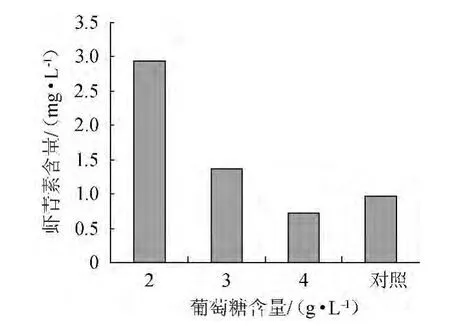
圖2 葡萄糖含量對蝦青素生成量的影響Fig.2 Effect of glucose content on astaxanthin production
由圖2可看知,隨著葡萄糖含量增加,蝦青素含量減少;當葡萄糖含量為2.0 g/L時,蝦青素含量達到較高水平(2.94 mg/L)。與對照相比,蝦青素含量增加較多(是對照的3.01倍)。利用葡萄糖進行異養培養可促進蝦青素生物轉化。
由圖1與圖2對比分析可看出,轉化培養基中以乙酸鈉作碳源,比以葡萄糖作碳源時蝦青素含量高(以乙酸鈉作碳源時進行轉化時蝦青素含量為10.25 mg/L;以葡萄糖作碳源時進行轉化時蝦青素含量為2.94 mg/L)。利用乙酸鈉作為碳源與葡萄糖相比,異養培養過程對蝦青素生物轉化作用更加顯著。
2.2 KNO3含量對蝦青素積累的影響
雨生紅球藻細胞在一定培養以及轉化條件下,不同KNO3含量對蝦青素積累的影響,結果如圖3所示。
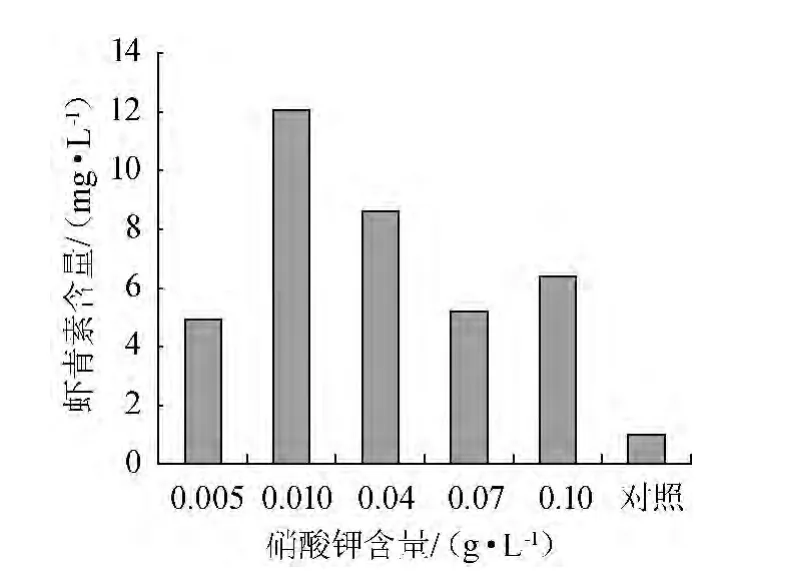
圖3 硝酸鉀含量對蝦青素生成量的影響Fig.3 Effect of potassium nitrate content on astaxanthin production
由圖3可知,當KNO3含量<0.01 g/L范圍內,蝦青素含量增加;當轉化培養基中硝酸鉀含量為0.01 g/L時,蝦青素含量最高(12.09 mg/L),是對照中的蝦青素含量的12.37倍,后隨硝酸鉀含量的增加蝦青素含量快速下降。這個結果與BOROWITZKA M A等[16]的結論一致,在轉化培養基質中氮源相對缺乏時可促進蝦青素生物轉化。
2.3 KH2PO4含量對蝦青素積累的影響
雨生紅球藻細胞在一定培養以及轉化條件下,不同KH2PO4含量對蝦青素積累的影響,結果如圖4所示。
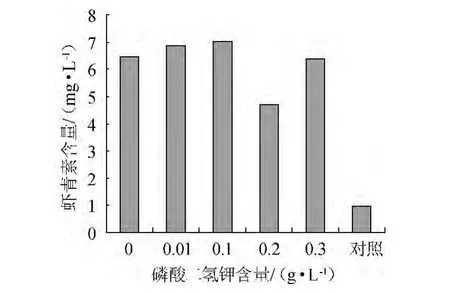
圖4 磷酸二氫鉀含量對蝦青素量生成的影響Fig.4 Effect of potassium dihydrogen phosphate content on astaxanthin production
由圖4可知,當KH2PO4含量在0~0.3 g/L范圍內,磷含量對蝦青素影響并不大,且磷酸二氫鉀含量>0.1 g/L時培養基中開始出現白色渾濁(磷酸根與其他金屬離子相結合產生白色渾濁),所以在后面響應面試驗的設計中只考慮硝酸鉀和乙酸鈉含量,而磷含量保持不變,即0.01 g/L。
2.4 響應面試試驗
在單因素試驗基礎上,應用響應面分析法確定轉化培養基中NaAc含量(X1)和KNO3含量(X2),以蝦青素含量的平均值為響應值Y。中心組合試試驗結果、方差分析分別如表2、表3所示。
對表2的試驗結果進行回歸分析獲得如下的回歸方程:
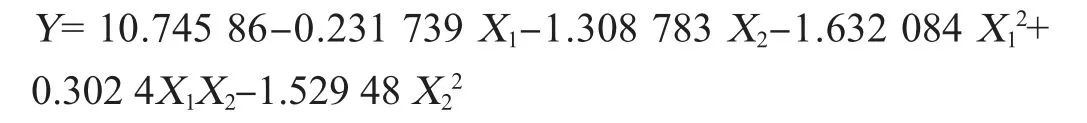
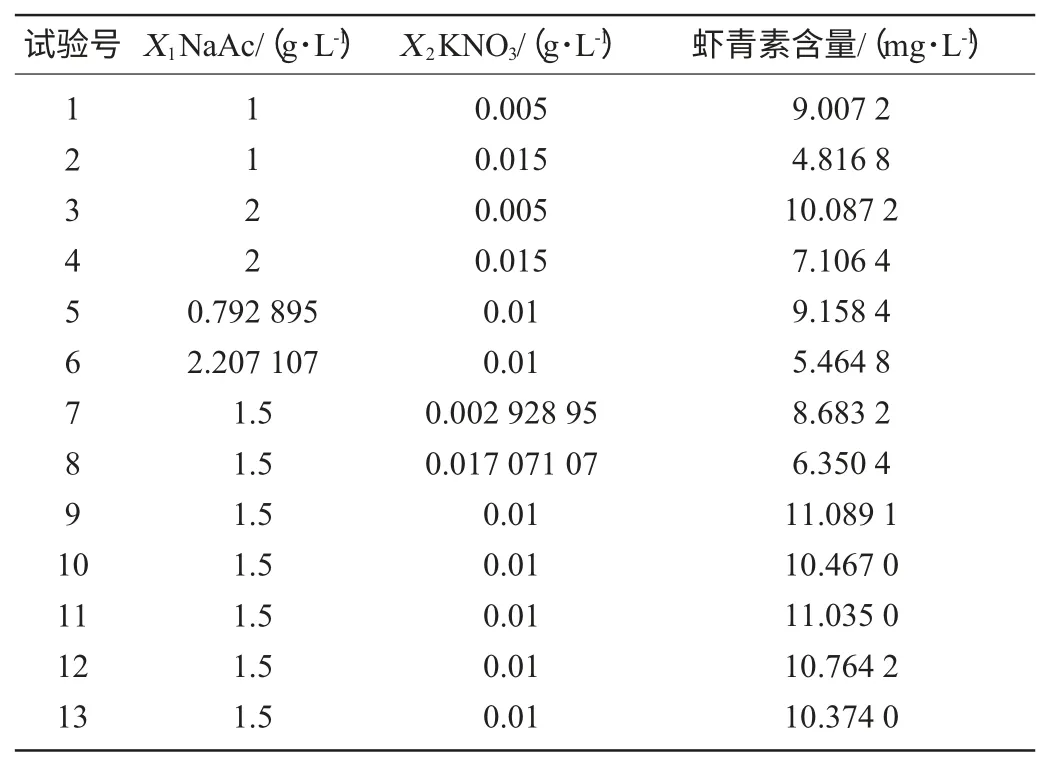
表2 雨生紅球藻轉化培養基優化CCD試驗結果Table 2 Results of CCD experiment for transformation medium optimization
為考察影響雨生血球藻轉化程度及試驗結果的可靠性,對試驗結果進行了方差分析,如表3所示。由表3可知,該方程對蝦青素含量的決定系數(R2)為0.794 0,這表明總變量中有79.4%的變量符合該模型。在考察的兩個因素中,乙酸鈉含量和KNO3含量對雨生血球藻轉化生成蝦青素具有顯著影響。
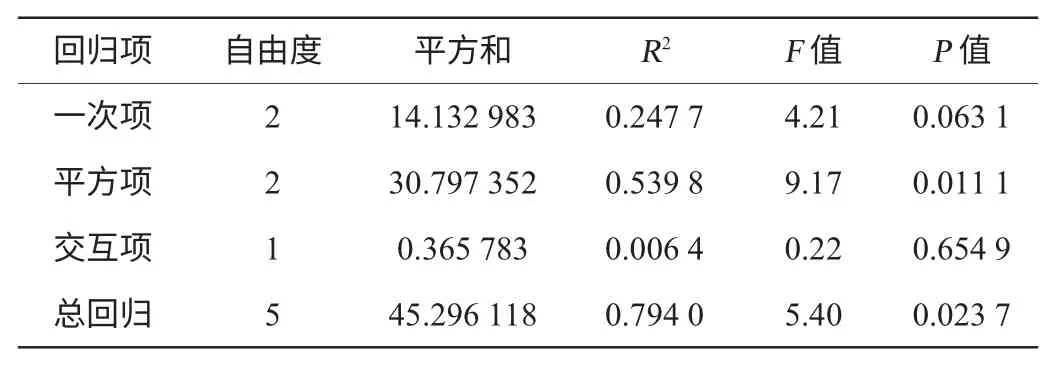
表3 雨生紅球藻轉化培養基優化CCD試驗結果方差分析Table 3 Variance analysis of CCD experiment for transformation medium optimization
為了進一步說明乙酸鈉和硝酸鉀含量的交互作用和決定兩個因素的水平對蝦青素產量的影響,根據統計結果利用Statistica 7.1獲得了三維響應面曲線,如圖5所示。
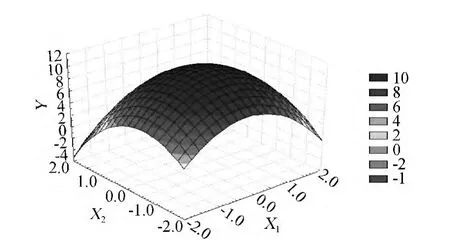
圖5 乙酸鈉和硝酸鉀含量對蝦青素生成量影響的響應面Fig.5 Response surface plots of effects of interaction between sodium acetate content and nitrate content on astaxanthin production
由圖5可看出,在乙酸鈉含量在1.460 5 g/L,硝酸鉀含量在0.008 4 g/L時,蝦青素含量達到了最高值11.046 0 mg/L。
2.5 驗證試驗
為了檢驗模型預測的準確性,在中心組合試驗得出的最優點進行重復試驗,所得蝦青素含量為10.908 mg/L,與預測值擬合較好,說明模型能較好地預測蝦青素含量。
3 結論
通過本研究發現,對雨生紅球藻轉化產蝦青素影響較大的是硝酸鉀含量、乙酸鈉含量,而磷酸二氫鉀的含量對蝦青素產量影響不大。通過中心組合試驗進行優化,優化后的轉化培養基中乙酸鈉含量為1.460 5 g/L,硝酸鉀含量為0.008 4 g/L,磷酸二氫鉀0.01 g/L,通過對預測模型的反復驗證試驗,蝦青素產量為10.908 mg/L,與模型預測值基本一致,使得蝦青素產量比對照培養基提高了9.16倍。
[1]MIKI W.Biological functions and activities of animal carotenoids[J].Pure Appl Chem,1991,63(1):141-146.
[2]SCHROEDER W A,JOHNSON E A.Antioxidant role of carotenoids inPhaffia rhodzyma[J].J Gen Microbil,1993,139(5):907-912.
[3]殷明焱,劉建國,張京浦,等.雨生紅球藻和蝦青素述評[J].海洋湖沼通報,1998(2):53-62.
[4]NAGUIB Y M A.Antioxidants activities of astaxanthin and related carotenoid[J].J Agr Food Chem,2000,48(16):1150-1154.
[5]王菊芳,吳振強.蝦青素的生理功能及其應用[J].食品與發酵工業,1999,26(2):66-69.
[6]劉子貽,沈奇桂.蝦青素的生物活性及開發[J].中國海洋藥物,1997(3):46-49.
[7]REZA R,RYOTA I,HIRONORI S,et al.High efficiency production of astaxanthin by autotrophic cultivation ofHaematococcus pluvialisin a bubble column photobioreactor[J].Biochem Eng J,2008,39:575-580.
[8]HARKER M,TSAVALOS A J,YONG A J.Autotrophic growth and carotenoid production of in 30L air-lift photobioreactor[J].J Ferment Bioeng,1996,82(2):113-118.
[9]游 泳,管 斌,孔 青,等.混合培養對雨生紅球藻蝦青素產量的影響[J].中國釀造,2011,30(6):38-41.
[10]朱勁華,張成武,李朝軍.利用雨生紅球藻生產天然蝦菁素的研究進展[J].天然產物研究與開發,2003,15(3):268-272.
[11]張睿欽,管 斌,孔 青,等.雨生紅球藻異養轉化產蝦青素的條件研究[J].浙江大學學報,2011,37(6):624-630.
[12]張京浦,劉建國.溫度對雨生紅球藻光合作用的影響[J].植物生物學學報,1994,4(1):6-10.
[13]莊惠如,陳必鏈,王明茲,等.雨生紅球藻混合營養與異養培養研究[J].微生物學通報,2000,27(3):198-201.
[14]董慶霖,趙學明,邢向英.乙酸鈉誘導雨生紅球藻合成蝦青素的機理[J].微生物學通報,2007,34(2):256-260.
[15]董慶霖.利用雨生紅球藻和紅發夫酵母代謝過程中的協同效應提高蝦青素產量[D].天津:天津大學博士論文,2004.
[16]BOROWITZKA M A,HUISMAN J M,OSBORN A.Culture of the astaxanthin-producing green algaHaematococcus pluvialis[J].J Appl Phycol,1991,3:295-304.

