探討小鼠肌肉組織中老化淀粉樣變纖維的傳播性
霍 佳,錢俊喬,李陳莉,樋口京一,郭淺妤,錢金澤
淀粉樣變性是一組由蛋白錯誤折疊引起的,以淀粉樣蛋白纖維沉積于各種組織間質為特征的,引發多系統損傷的全身性疾病。目前,已發現28種不同的前體蛋白可在活體中形成淀粉樣蛋白,并伴隨正常組織結構和功能的破壞,導致相應器官功能障礙而引起的一系列病理改變,如朊病毒病(prion diseases)、阿爾茨海默病(Alzheimer’s disease)、II型糖尿病、家族性淀粉樣多神經病(familial amyloid polyneuropathy, FAP)等[1]。
載脂蛋白A-II(apoA-II)主要存在于人類、小鼠、大鼠和魚的血漿中[2-3]。而對于小鼠來說,apoA-II是其血清高密度脂蛋白的第二大組成成分,并通過成核現象(nucleation)和纖維延伸(extension)過程形成淀粉樣載脂蛋白A-II(amyloid apoA-II, AApoAII)纖維沉積于各器官中而引起小鼠老化淀粉樣變(mouse senile amyloidosis)[4]。研究已知,AApoAII纖維也可以通過糞、乳汁、唾液等途徑誘發系統性淀粉樣變的發生[5-6],并且這種老化相關的AApoAII纖維可沉積于腦實質和骨髓以外幾乎所有的器官和組織中,如肝臟、脾臟、胃、腸、心臟、腎臟、肺、舌、皮膚和唾液腺等。目前研究發現,朊病毒可通過多種感染途徑(如消化道,血液等途徑)感染各種組織器官,而朊病毒感染的人、鹿及羊的骨骼肌中均檢測出scrapie樣異常朊病毒(PrPSc),并且該類疾病亦可通過骨骼肌進行種屬間和/或種屬內傳播[7-8]。AApoAII淀粉樣纖維作為已知的一種淀粉樣變前體蛋白,具有與朊病毒相似的傳播性及傳播途徑,但AApoAII淀粉樣纖維是否可以通過肌肉進行種內傳播未見相關報道。
本實驗應用R1.P1-Apoa2c小鼠誘發系統性淀粉樣變,并使用Pras’的方法從骨骼肌中提取AApoAII淀粉樣纖維,成功地進行了系統性淀粉樣變的二次傳播實驗。本研究首次驗證了小鼠老化淀粉樣變的骨骼肌傳播途徑,為淀粉樣變疾病的發生機制及防治方法提供了新的有力的理論依據。
1 材料與方法
1.1動物分組 R1.P1-Apoa2c雌性小鼠,60日齡,共計17只,由日本信州大學加齡生物學研究室提供。將實驗小鼠進行分組:實驗1組6只、實驗2組5只、實驗3組6只。
1.2模型制備 參照Pras’的方法,從淀粉樣變誘導后20個月的R1.P1-Apoa2c小鼠肝臟中提取AApoAII淀粉樣纖維種子[9],并用蒸餾水稀釋濃度至1.0 mg/mL。將稀釋液用超聲打碎后,采用尾靜脈注射法進行淀粉樣變模型制備,R1.P1-Apoa2c小鼠注射量為100 μg/只。誘導實驗進行2個月后,根據Amyloid Index評估心、肝、脾、胃、腸、舌、皮膚各組織淀粉樣變沉積程度,分為0~4級:0級,無淀粉樣沉積物;1級,約<10%的組織中可見淀粉樣沉積物;2級,約10%~30%的組織中可見淀粉樣沉積物;3級,30%~50%的組織中可見淀粉樣沉積物;4級,>50%的組織中可見淀粉樣沉積物。淀粉樣變沉積程度為0級以上即為造模成功[5]。
1.3組織標本的取材 待淀粉樣變誘導實驗進行2個月后即取材。對手術器械、手術操作臺及小鼠進行消毒,用乙醚對實驗小鼠進行麻醉,將采集的肝臟、心臟、脾臟、皮膚、舌、腸、胃分別置于福爾馬林及2.5%的戊二醛中,以便進行淀粉樣變程度的判斷及部位的判定。
1.4剛果紅染色 將福爾馬林固定好的組織樣品進行剛果紅染色,并通過偏光顯微鏡觀察淀粉樣沉積程度及位置。
1.5免疫組織化學染色 將福爾馬林固定好的組織樣品進行免疫組織化學染色,使用鼠apoA-II抗體,稀釋濃度為1∶3 000,以特異性判定淀粉樣變沉積的程度及部位。
1.6電鏡觀察 將經2.5%的戊二醛固定好的組織樣品用0.1 mol/L磷酸緩沖液漂洗3次,并用1%鋨酸固定液固定。經乙醇、丙酮脫水后進行包埋、固化。制備超薄切片,厚度為100 nm,隨后用3%醋酸鈾-枸櫞酸鉛雙染色,進行電鏡觀察,以判定淀粉樣變沉積部位。
1.7骨骼肌中apoA-II mRNA檢測。
1.7.1cDNA合成 使用RNeasy Mini Kit (Qiagen, Germany)從骨骼肌中提取總RNA。利用First strand cDNA Synthesis Kit(Amersham Pharmacia Biotech, USA)合成cDNA, 并通過使用Taq DNA polymerase(Promega, USA)進行PCR擴增。反應產物經3%瓊脂糖凝膠(含溴化乙錠)電泳分離,紫外透射儀上觀察結果。
1.7.2Real-time PCR 使用SYBR Premix Ex Taq II (Takara, Japan)及7500 Real-Time PCR System進行實時定量PCR。上游引物序列為5′-AAGAGACAGGCGGACGGACA-3′,下游引物序列為5′-GAGGTCTTGGCCTTCTCCAC-3′。
1.8骨骼肌中ApoAI蛋白檢測 參照Pras’的方法,從各部骨骼肌中(肱三頭肌、股四頭肌、胸大肌和背最長肌)提取AApoAII纖維蛋白,采用SDS-PAGE進行電泳分離。轉膜后用1∶3 000稀釋度的apoA-II抗體檢測蛋白表達情況。
1.9二次傳播實驗 參照Pras’的方法,從骨骼肌中提取AApoAII纖維蛋白,作為“種子”,采用尾靜脈注射法進行淀粉樣變二次傳播實驗的誘發,“種子”注射量為100 μg/只。誘導實驗進行2個月后,根據上述Amyloid Index方法判斷淀粉樣沉積情況。同時,將骨骼肌中提取的AApoAII纖維“種子”進行6 mmol/L鹽酸胍室溫慢速攪拌24 h變性處理,對照實行二次傳播實驗。R1.P1-Apoa2c雌性小鼠,60日齡,共計12只,將實驗小鼠進行分組:陰性對照組3只、誘導實驗組3只、鹽酸胍變性處理組6只。
1.10統計學分析 使用StatView software package (Abacus Concepts, Berkeley, CA, USA)進行數據分析。所有數據使用Mann Whitney U test進行兩組比較。
2 結 果
2.1apoA-II mRNA在肌肉組織中的表達 瓊脂糖凝膠電泳圖像顯示淀粉樣變誘導實驗進行后,R1.P1-Apoa2c小鼠模型各部分肱三頭肌、股四頭肌、胸大肌和背最長肌骨骼肌中均有apoA-II mRNA的表達, 但4個部位骨骼肌的mRNA表達程度不盡相同,分別為胸大肌>豎脊肌>肱三頭肌>股四頭肌,此外,Real-Time PCR結果顯示肌肉組織中apoA-II mRNA的表達程度低于肝臟中apoA-II mRNA的表達程度。
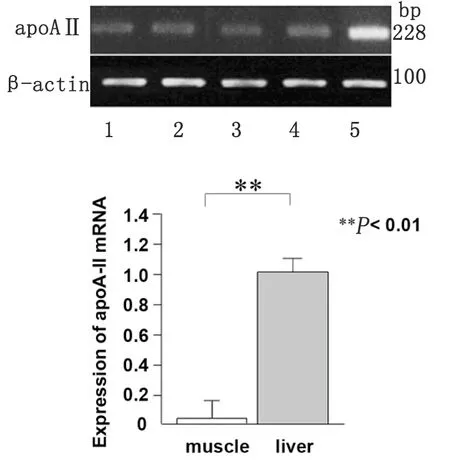
圖1 apoA-II mRNA 在肌肉組織中的表達
2.2ApoA-II蛋白在肌肉組織中的表達 Western blot結果顯示各部分骨骼肌中均有ApoA-II蛋白的表達,且胸大肌中的表達程度最顯著。
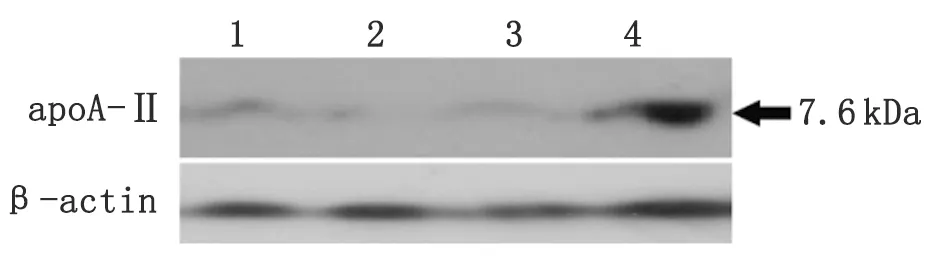
圖2 ApoA-II蛋白在肌肉組織中的表達
2.3形態學觀察淀粉樣纖維在肌肉組織中沉積部位 剛果紅及免疫組化染色結果顯示AApoAII淀粉樣纖維主要沉積在血管壁(A和C)上及肌纖維之間的間質(B和D)(圖3)。(A和B為剛果紅染色,C和D為免疫組化染色。放大倍數×400)
2.4電鏡觀察淀粉樣纖維在肌肉組織中沉積情況 電鏡結果與免疫組織化學染色和剛果紅染色一致(圖4),骨骼肌組織中可見直徑約為8~10 nm纖維結構(如箭頭所示)。

圖3 淀粉樣纖維在肌肉組織中沉積部位
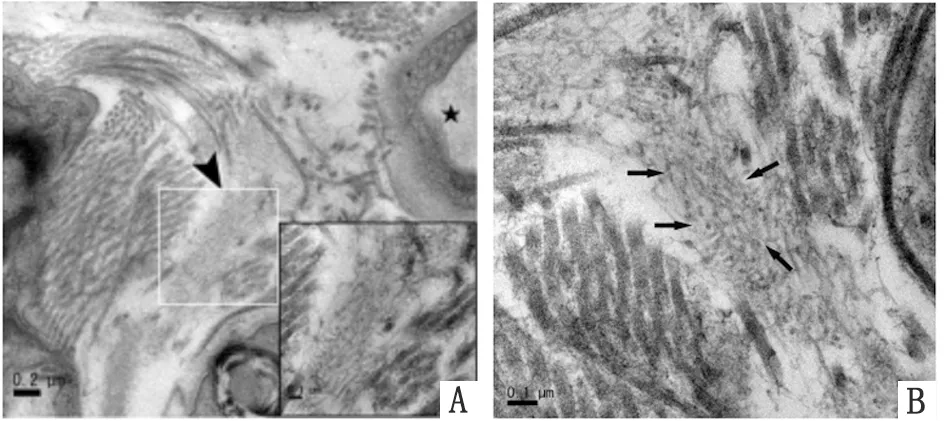
圖4 淀粉樣纖維在肌肉組織中沉積情況的電鏡觀察
2.5二次傳播實驗結果 通過二次傳播實驗可見,AApoAII淀粉樣纖維沉積的骨骼肌中提取物(圖5)可引起系統性淀粉樣變; 而提取物進行變性處理后不能誘發二次系統性淀粉樣變(圖6,表1)。
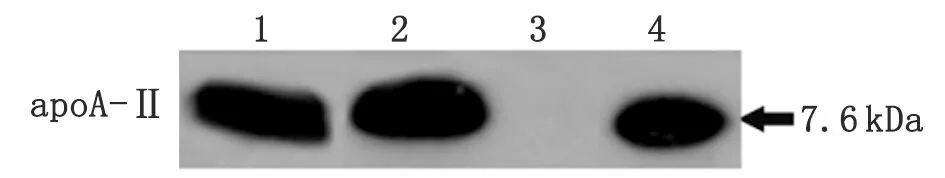
圖5 肌肉組織提取物中淀粉樣纖維組分
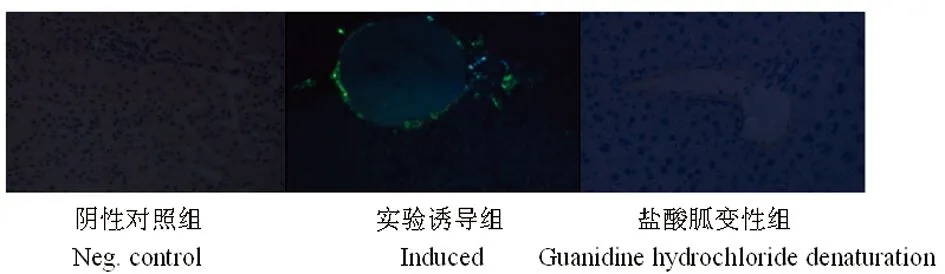
圖6 剛果紅染色觀察二次傳播實驗各實驗組肝臟組織中淀粉樣纖維沉積情況(放大倍數×400)
3 討 論
根據已有研究證實AApoA-II淀粉樣纖維可以引起小鼠系統性淀粉樣變,并沉積于小鼠的腦和骨髓以外的全身各器官,如肝臟,脾臟,舌等組織器官,但在骨骼肌組織中是否存在AApoAII纖維,尚未有相關報道。
目前,已有研究顯示在患有慢性消耗性疾病的鹿和散發性Creutzfeldt-Jakob病患者的骨骼肌中均有朊病毒蛋白PrPSc的表達[12]。此外,患有AA amyloidosis的牛的骨骼肌中也發現有AA淀粉樣纖維的存在[13]。本研究首次發現apoA-II mRNA在小鼠肱三頭肌、股四頭肌、豎脊肌、胸大肌中均有表達,其表達量低于肝臟中的表達量(圖1),Western blot技術同樣檢測到4個部位的骨骼肌中存在AApoAII淀粉樣纖維,但在4個部位骨骼肌的沉積程度不盡相同,分別為胸大肌>豎脊肌>肱三頭肌>股四頭肌(圖2),可能與各部位的骨骼肌功能狀態和血液供應相關。我們的結果還發現,由前體蛋白apoA-II通過蛋白變構所形成的AApoAII纖維主要沉積于骨骼肌組織的血管壁和肌纖維間質中,而在骨骼肌細胞內和神經纖維中沒有發現(圖3, 4)。此外,骨骼肌中提取的AApoAII纖維成分,可以誘發淀粉樣變二次傳播實驗(圖5,6,表1)。
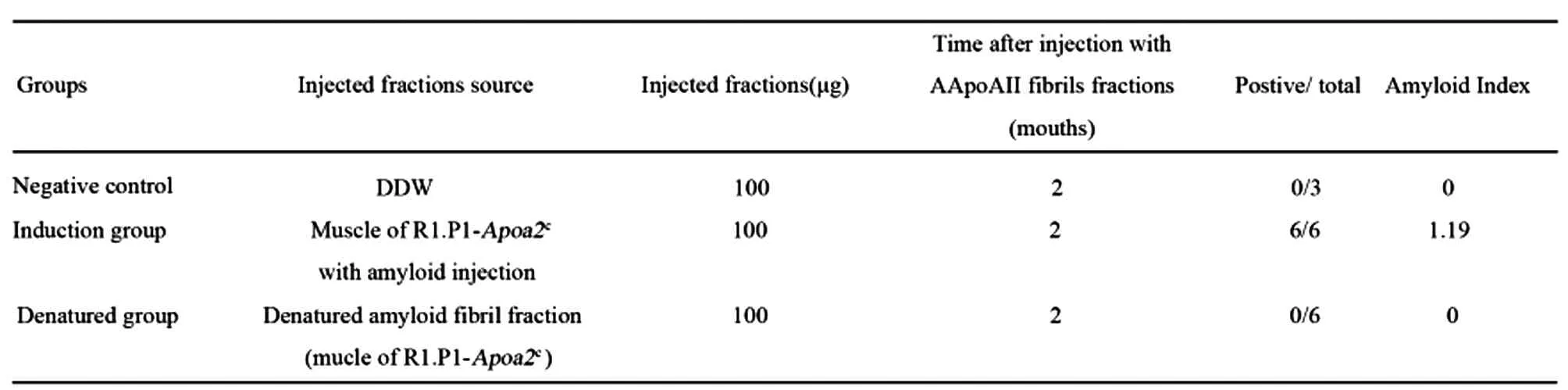
表1 肌肉組織中提取的淀粉樣纖維進行二次傳播實驗情況
目前研究證實,作為人類食物主要來源的動物肌肉,可以傳播傳染性海綿狀腦病(transmissible spongiform encephalopathy, TSE )[10];在小鼠、倉鼠和羊的骨骼肌中高表達的朊蛋白(PrPC)可作為朊病毒(PrPSc)復制的底物;大量沉積于鹿的骨骼肌中的朊病毒則可導致慢性消耗性疾病;沉積于人類骨骼肌中的朊病毒PrPSc可以誘發散發性Creutzfeldt-Jacob 病(CJD)。此外,日本的研究人員通過對高齡牛的骨骼肌檢測,也發現炎癥相關淀粉樣蛋白A(AA)同樣具有與朊病毒相似的以肌肉為媒介的傳播特性[11]。因此,以上研究均支持AApoAII通過骨骼肌進行傳播的觀點。已有研究發現, AApoAII淀粉樣纖維可通過唾液、 乳汁、糞便等媒介進行種間傳播,而本實驗通過淀粉樣變誘導實驗首次證實了AApoAII淀粉樣纖維可沉積于肌肉組織中,并且可通過肌肉組織進行二次傳播。
綜上所述,存在于人類、小鼠、大鼠和魚類血清中的apoA-II,可以誘發小鼠老化淀粉樣變,并且以骨骼肌為媒介而傳播的可能性是存在的,進一步闡明了淀粉樣變疾病的發病機制,并且對此類疾病的治療和預防方法的研發提供了新的有效的理論實驗支持。
參考文獻:
[1]Benson MD, James S, Scott K, et al. BLeukocyte chemotactic factor 2: A novel renal amyloid protein[J]. Kidney Int, 2008, 74(2): 218-222. DOI: 10.1038/ki.2008.152
[2]Li WH, Tanimura M, Luo CC, et al. The apolipoprotein multigene family: biosynthesis, structurefunction relationship, and evolution[J]. J Lipid Res, 1988, 29(3): 245-271.
[3]Chapman MJ. Comparative analysis of mammalian plasma lipoproteins[J]. Methods Enzymol, 1986, 128: 70-143.
[4]Xing Y, Nakamura A, Korenaga T, et al. Induction of protein conformational change in mouse senile amyloidosis[J]. J Biol Chem, 2002, 277(36): 33164-33169. DOI: 10.1074/jbc.M111570200
[5]Xing Y, Nakamura A, Chiba T, et al. Transmission of mouse senile amyloidosis[J]. Lab Invest, 2001, 81(4): 493-499.
[6]Korenaga T, Yan J, Sawashita J, et al. Transmission of amyloidosis in offspring of mice with AApoAII amyloidosis[J]. Am J Pathol, 2006, 168(3): 898-906. DOI: 10.2353/ajpath.2006.050350
[7]Prusiner SB. Prions[J]. Proc Natl Acad Sci USA, 1998, 95(23): 13363-13383. DOI: 10.1073/pnas.95.23.13363
[8]Collinge J. Prion diseases of humans and animals: their causes and molecular basis[J]. Annu Rev Neurosci, 2001, 24(1): 519-550. DOI: 10.1146/annurev.neuro.24.1.519
[9]Qian J, Yan J, Ge F, et al. Mouse senile amyloid fibrils deposited in skeletal muscle exhibit amyloidosis-enhancing activity[J]. PLoS Pathog, 2010, 6(5): e1000914. DOI: 10.1371/journal.ppat.1000914
[10]Bosque PJ, Ryou C, Telling G, et al. Prions in skeletal muscle[J]. Proc Natl Acad Sci USA, 2002, 99(6): 3812-3817. DOI: 10.1073/pnas.052707499
[11]Yoshida T, Zhang P, Fu X, et al. Slaughtered aged cattle might become one dietary source exhibiting amyloid enhancing factor activity[J]. Amyloid, 2009, 16(1): 25-31. DOI: 10.1080/13506120802676831
[12]Glatzel M, Abela E, Maissen M, et al. Extraneural pathologic prion protein in sporadic Creutzfeldt-Jakob disease[J]. N Engl J Med, 2003, 349(19): 1812-1820. DOI: 10.1056/NEJMoa030351
[13]Yamada M, Kotani Y, Nakamura K, et al. Immunohistochemical distribution of amyloid deposits in 25 cows diagnosed with systemic AA amyloidosis[J]. J Vet Med Sci, 2006, 68(7): 725-729. DOI: 10.1292/jvms.68.725

