HBV S-ecdCD40L治療性疫苗對乙肝轉基因小鼠肝臟中樹突狀細胞表型和功能的影響
吳文治,徐英,吳金明,張歡
(溫州醫科大學附屬第一醫院 消化內科,浙江 溫州 325015)
HBV S-ecdCD40L治療性疫苗對乙肝轉基因小鼠肝臟中樹突狀細胞表型和功能的影響
吳文治,徐英,吳金明,張歡
(溫州醫科大學附屬第一醫院 消化內科,浙江 溫州 325015)
目的:檢測HBV S-ecdCD40L表達對乙肝轉基因小鼠樹突狀細胞(DC)成熟分化和功能的影響及其可能機制。方法:乙肝轉基因小鼠分別肌肉注射質粒pcDNA3.1-S-ecdCD40L、pcDNA3.1-S、pcDNA3.1或PBS,每只100 μg/25 g,2、4周后各加強免疫一次。首次免疫6周后,取血,分離DC,檢測細胞表型及功能,并用熒光定量PCR法檢測血清HBV DNA含量。結果:注射pcDNA3.1-S-ecdCD40L小鼠DC中CD80、CD86、MHC II及Toll樣受體4(TLR4)的表達,白介素-12(IL-12)的分泌及刺激淋巴細胞的能力均高于其余組小鼠,而平均血清HBV DNA含量明顯低于其余組小鼠。結論:pcDNA3.1-S-ecdCD40L重組表達載體介導的HBV S-ecdCD40L表達能有效地促進轉基因小鼠的DC成熟分化和功能提高,激活DC中的TLR4可能是其機制之一。
乙型肝炎病毒;樹突狀細胞;Toll樣受體;小鼠
雖然安全有效的乙肝疫苗被各國列入嬰兒常規免疫近20年,但乙型肝炎病毒(hepatitis B virus,HBV)感染仍是全球關注的健康問題。據統計目前全世界至少有4億人感染HBV,其中我國就有1.2億感染者,且每年有超過100萬的患者死于HBV相關的肝病,如肝硬化、肝癌等。因此控制HBV的復制,緩解肝組織活動性病變仍是醫學界需要長期努力攻克的堡壘。本實驗采用HBV轉基因小鼠代替慢性乙肝患者,通過對照比較檢測疫苗pcDNA3.1-S-ecdCD40L介導的HBV S-ecdCD40L表達能否有效刺激轉基因小鼠樹突狀細胞(dendritic cell,DC)成熟及其可能的機制。
1 材料和方法
1.1材料
1.1.1 動物:HBV轉基因小鼠購自解放軍第458醫院全軍肝病中心,該小鼠為高表達復制型1.3拷貝HBV全基因轉基因小鼠。
1.1.2 疫苗:pcDNA3.1-S-ecdCD40L重組表達載體[1]、pcDNA3.1-S載體均來自本室前期構建。
1.1.3 試劑:HBV DNA定量試劑盒購自深圳匹基公司;CDllc microbead、磁柱均購自Miltenyi Biotec公司;PE/FITC標記的CD80、CD86、MHC I I及Toll樣受體4(Toll like receptor 4,TLR4)均購自Ebioscience公司;IL-12p70酶聯免疫吸附試驗(ELISA)試劑盒購自RD公司;CCK-8購自日本同仁公司;膠原酶IV購自Sigma公司。
1.2 免疫轉基因小鼠稱重后,隨機分為四組,分別肌肉注射pcDNA3.1-S-ecdCD40L(pcDNA3.1-S-ecd CD40L組)、pcDNA3.1-S(pcDNA3.1-S組)、pcDNA3.1(pcDNA3.1組)或PBS(PBS組),每只100 μg/25 g,首次免疫2周和4周后各加強免疫1次,每次100 μg/25 g。首次免疫6周后,處理小鼠。
1.3 肝臟微環境DC分離培養參照Lu等[2]分離肝臟DC的方法并作一些改進。HBV轉基因小鼠戊巴比妥腹腔麻醉,無菌開腹,1 mL注射器針頭門靜脈注射20 mL含EGTA 0.19 g/L D-Hanks液,肝臟變白后,下腔靜脈注射5 mL 0.5%膠原酶IV,取肝臟,剪碎后,放入0.5%膠原酶中繼續消化,37 ℃,30 min。尼龍網過濾,PBS清洗,稀釋成4~5 mL細胞懸液,percoll密度梯度離心后吸取兩液體界面的非肝實質細胞,PBS清洗2次。免疫磁珠法分離肝臟DC(按免疫磁珠說明書操作)。按每l×107個細胞用80:l磁珠分離液重懸細胞并加入20 μL CDllc+磁珠的比例操作,4 ℃孵育15 min,經細胞磁性分離系統陽性分選CDllc陽性細胞,用含lO%胎牛血清的RPMI 1640培養基重懸細胞,調整細胞濃度為4×105個/mL。
1.4 外周血淋巴細胞分離培養稀釋后血液與淋巴細胞分離液1:1,2 000 r/min,密度梯度離心20 min后,吸取白膜層,加15%血清完全培養液培養,隔天取不貼壁細胞,即為淋巴細胞。
1.5 DC表型和功能鑒定
1.5.1 DC表型及TLR4表達檢測:取EP管,每管加100μ L DC懸浮液,分別加入PE-CD86、FITC-CD80、PE-MHC I I、PE-TLR4及同型各5μ L,室溫避光20 min,PBS洗1次,加150 μL 1%多聚甲醛固定,4 ℃保存,流式細胞儀檢測細胞表型。
1.5.2 混合淋巴細胞反應:分離培養小鼠T淋巴細胞作為效應細胞,DC作為刺激細胞,DC/T比值為1:5、1:10、1:20 等,另設只含淋巴細胞的孔為對照組,含RPMI 1640的孔為本底組。培養結束前4 h,每孔各加入CCK-8 20μL,繼續孵育4 h,振蕩混勻后,于參比波長630 nm、檢測波長450 nm處檢測吸光度(A值)。刺激指數(SI)=(A實驗組-A本底組)/(A對照組-A本底組)。
1.5.3 細胞因子檢測:收集混合淋巴細胞反應培養96 h上清液,采用ELISA法檢測IL-12,按試劑盒說明書進行操作。根據試劑盒中標準品的檢測結果繪制標準曲線,酶標儀檢測出樣品的A值,在標準曲線上換算出對應細胞因子的含量。
1.5.4 血清HBV DNA熒光定量檢測:樣本處理及定量PCR檢測按深圳匹基公司HBV熒光PCR試劑盒操作流程進行。分別取0、3、6周的小鼠,眼眶后靜脈叢采血,每次0.3 mL左右,37 ℃恒溫箱孵育30 min,12 000 r/min離心10 min,吸取上層血清各50μL,加入50μL DNA提取液1,振蕩混勻,10 000 r/min離心10 min,棄上清,再加入12.5 μ L DNA提取液2,振蕩混勻,2 000 r/min離心10 s。100 ℃沸水浴10 min,13 000 r/min離心10 min,取上清2μ L進行PCR檢測。由電腦軟件分析計算給出HBV DNA初始拷貝數定量結果。
1.6 統計學處理方法采用SPSS13.0統計軟件進行統計學分析。所有數據均以±s表示。采用單因素方差分析法比較各組間的差異。P<0.05為差異有統計學意義。
2 結果
2.1 DC表型及TLR4表達檢測pcDNA3.1-S-ecdCD40L組CD80、CD86、MHC I I表達分別為61.36 ±5.95、60.61±5.25、77.71±3.09,較pcDNA3.1-S組、pcDNA3.1組和PBS組均顯著增高(均P<0.05),見圖1。pcDNA3.1-S-ecdCD40L組、pcDNA3.1-S組、pcDNA3.1組和PBS組的TLR4表達分別為(40.88± 8.79)%、(35.35±7.41)%、(29.30±3.64)%和(28.93±3.18)%,pcDNA3.1-S-ecdCD40L組與pcDNA3.1組、PBS組比較差異均有統計學意義(均P<0.05)。
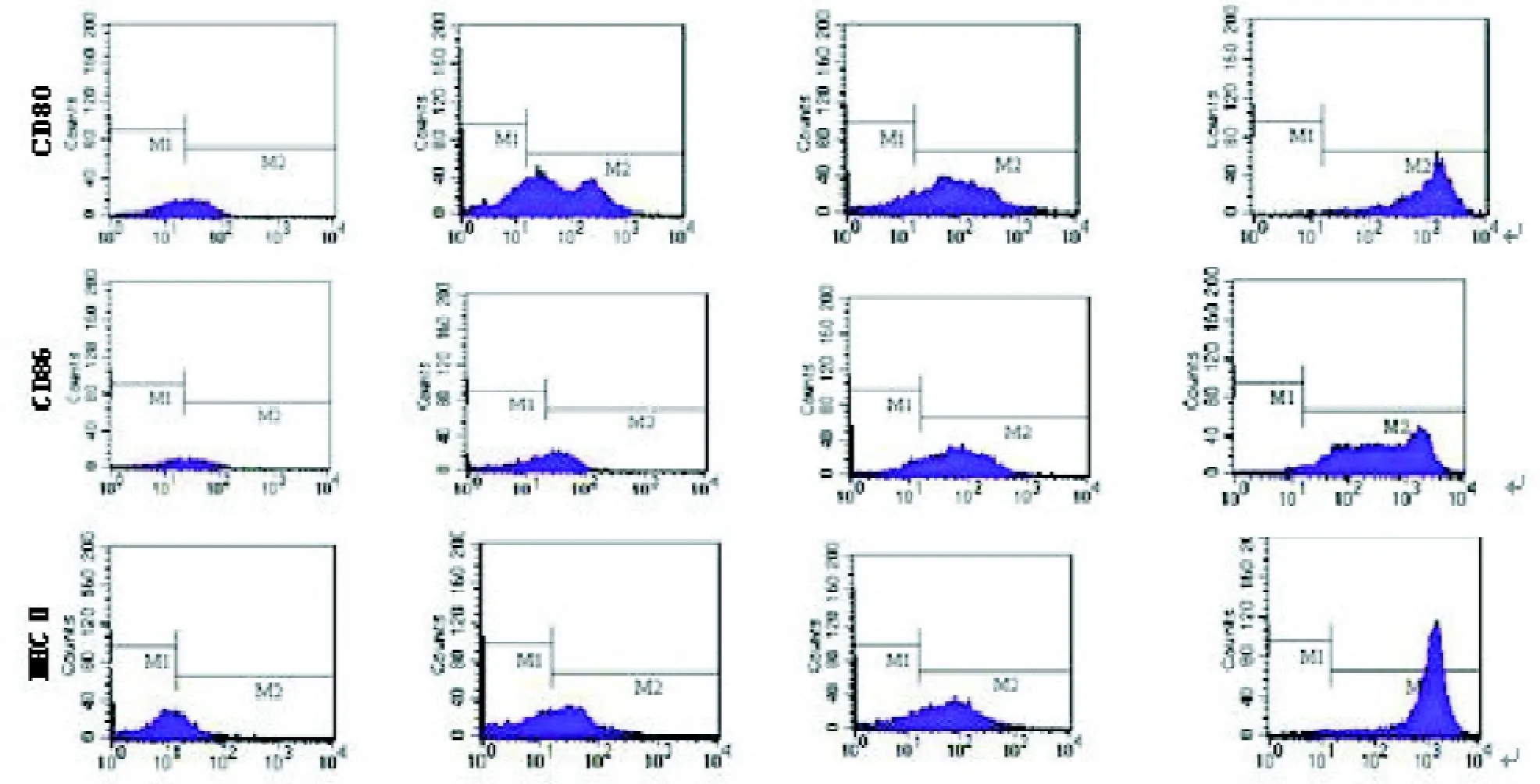
圖1 各組DC表面CD80、CD86和MHC I I表達
2.2 混合淋巴細胞反應pcDNA3.1-S-ecdCD40L組SI最高,DC/T比值為1:5時,SI=3.00±0.32;DC/ T比值為1:10時,SI=2.49±0.31;DC/T比值為1: 20時,SI=1.63±0.24。當DC/T比值為1:5及1: 10時,pcDNA3.1-S-ecdCD40L組SI與另外三組相比有明顯提高(均P<0.05);當DC/T比值為1:20時,pcDNA3.1-S-ecdCD40L組SI與其他三組相比差異無統計學意義(P>0.05)。表明該組DC刺激T淋巴細胞增殖的能力最強,且DC/T的比值越大,DC的刺激能力越強。見圖2。
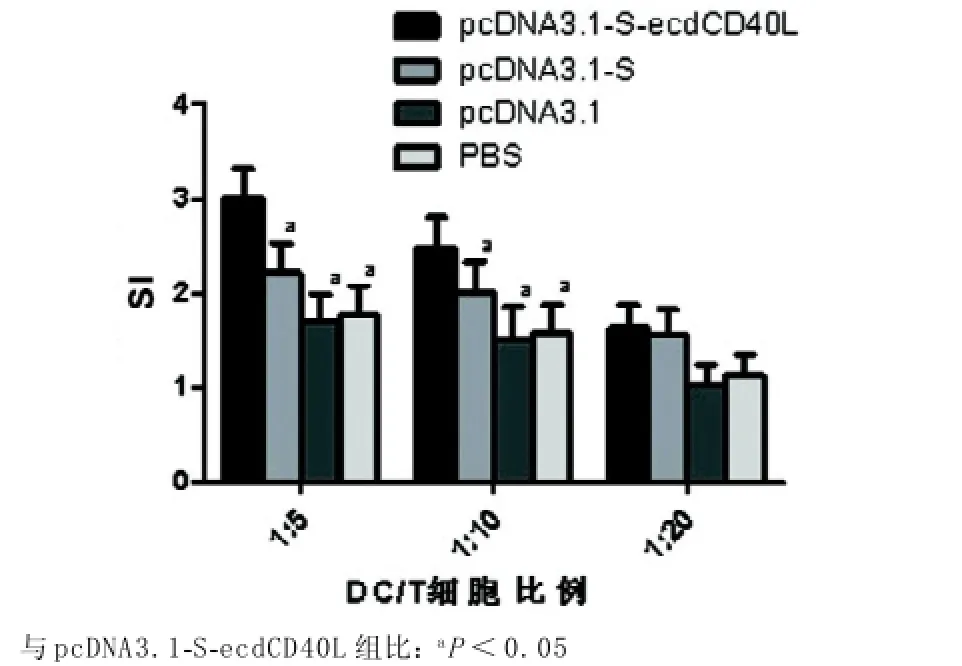
圖2 混合淋巴細胞反應
2.3 細胞因子檢測pcDNA3.1-S-ecdCD40L組上清液中IL-12p70含量為(107.16±19.09)pg/mL,pcDNA3.1-S組、pcDNA3.1組和PBS組分別為(72.23 ±23.60)pg/mL、(23.89±4.68)pg/mL和(23.19 ±4.21)pg/mL, pcDNA3.1-S-ecdCD40L組IL-12p70含量明顯高于其余三組(均P<0.05)。
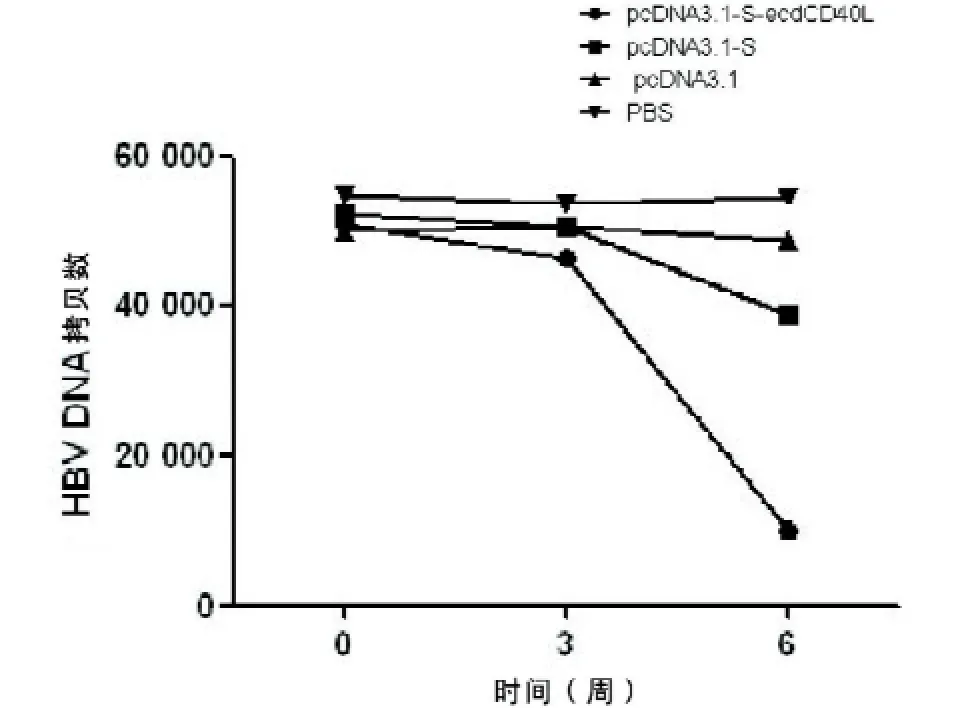
圖3 乙肝轉基因小鼠HBV DNA熒光定量檢測
2.4 血清HBV DNA熒光定量檢測免疫治療6周后,pcDNA3.1-S-ecdCD40L組小鼠平均血清HBV DNA拷貝數明顯低于其他三組。見圖3。
3 討論
HBV感染的徹底控制和清除有賴于機體的免疫系統。DC作為體內作用最強的抗原遞呈細胞,在HBV感染控制中起到重要作用。研究認為HBV可能通過影響DC分化和成熟,進而影響輔助T細胞的分化,導致Th1/Th2失衡,致使特異性細胞免疫功能降低,HBV感染得以慢性化[3]。所以DC分化成熟是治療HBV感染的關鍵。
我們的前期體外試驗證明,pcDNA3.1-S-ecdCD40L成功轉染的DC表型及刺激淋巴細胞增殖的能力有很大的提高[4]。為了進一步驗證該治療性疫苗能否在活體內取得同樣的效果,我們采用轉基因小鼠代替慢性乙肝患者進行檢驗。通過與另外三組對比,由pcDNA3.1-S-ecdCD40L介導的HBV S-ecdCD40L表達能有效刺激轉基因小鼠DC成熟,細胞表面抗原CD80、CD86、MHC I I表達提高,細胞因子IL-12分泌增多,混合淋巴細胞反應顯示經HBV S-ecdCD40L誘導的DC刺激T淋巴細胞增殖能力提高。
有研究[5]表明,TLR4識別配體后,可通過髓樣分化因子 88(MyD88)依賴和非依賴兩種信號轉導途徑,激活NF-κ B和MAPK,引起多種細胞因子的釋放,上調DC表面CD80、CD86等共刺激分子,并最終激活特異性免疫系統。我們在本實驗中發現PBS組的TLR4表達較低,經pcDNA3.1-S-ecdCD40L刺激后DC表面TLR4的表達較pcDNA3.1組和PBS組顯著增多,提示該疫苗可增加TLR4表達,從而促使機體清除病毒。推測TLR4很可能在HBV轉基因小鼠DC成熟中起到重要作用,這有待以后更加深入的研究。
總之,由pcDNA3.1-S-ecdCD40L介導的HBV S-
ecdCD40L表達能有效促進HBV轉基因小鼠DC成熟,在將來可能成為治療HBV感染的新方法。
[1]林賢凡, 吳金明, 陳瑾, 等. 乙肝表面抗原-CD40L胞外段融合蛋白的設計和生物活性預測[J]. 溫州醫學院學報, 2009, 39 (3): 205-208.
[2]Lu L, Woo J, Rao AS, et al. Propagation of dendritic cell progenitors from normal mouse liver using granulocyte/macrophage colony-stimulating factor and their maturational development in the presence of type-1 collagen[J]. J Exp Med, 1994, 179(6): 1823-1834.
[3]王少林, 林玉梅, 馬衛閩, 等. HBcAg/HBeAg對慢性乙型肝炎患者PBMC中Th1/Th2類細胞應答的影響[J]. 免疫學雜志, 2000, 16(6): 451-453.
[4]Wu JM, Lin XF, Huang ZM, et al. Construction of the HBV S-ecdCD40L fusion gene and effects of HBV S-ecdCD40L modication on function of dendritic cells[J]. J Viral Hepat, 2011, 18(10): 461-467.
[5]Akira S, Takeda K. Toll-like receptor signaling[J]. Nat Rev Immunol, 2004, 7(4): 499-511.
(本文編輯:丁敏嬌)
Effects of HBV S-ecdCD40L on phenotype and function of dendritic cells from hepatitis B virus genome transgenic mouse
WU Wenzhi, XU Ying, WU Jinming, ZHANG Huan.Department of Gastroenterology,the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To examine the influence of expression of HBV S-ecdCD40L on the maturity differentiation and function of the dendritic cells (DC) from hepatitis B virus (HBV) genome transgenic mouse models, and to explain the possible mechanism.Methods:HBV transgenic mice were injected with pcDNA3.1-S-ecdCD40L, pcDNA3.1-S, pcDNA3.1 and PBS respectively, (each 100 μg/25 g). Vaccination was performed on, day 15 and day 30. Six weeks after first injection sera were collected. Isolate DC and examine the phenotypic and functional changes, and the HBV DNA copies in HBV transgenic mice serum were detected by real-time PCR.Results:Compared with other three control groups, DC from injection with pcDNA3.1-S-ecdCD40L mice enhanced expression of costimulatory molecules (CD80, CD86, MHC II), Tollrike receptor 4 (TLR4), proinflammatory cytokine (IL-12p70) and also the capacity to induce allogeneic lymphocytes proliferation. And the average copies of serum HBV DNA were lower than those of the other three control groups. Conclution: The study in vivo supports the concept that the recombinant plasmids pcDNA 3.1-S-ecdCD40L-mediated HBV S-ecdCD40L expression may be a useful strategy for activating DC’s maturity and enhancing its functions.
hepatitis B virus; dendritic cell; Toll like receptor; mice
R512.6
A
1000-2138(2014)04-0248-04
2013-02-25
浙江省自然科學基金資助項目(Y2110768,Y12H 030023);溫州市科技局科研基金資助項目(Y20100204)。
吳文治(1977-),男,湖北武漢人,主治醫師,碩士。
吳金明,教授,主任醫師,Email:wujm0516@ yahoo.com.cn。

