局部進展期中低位直腸癌新輔助治療后病理消退影響因素分析
左志貴,王顥,高顯華,于志奇,竇唯龍,傅傳剛,宋華羽,李激
(1.溫州醫科大學附屬第一醫院 肛腸外科,浙江 溫州 325015;2.第二軍醫大學附屬長海醫院肛腸外科,上海 200433)
·論 著·
局部進展期中低位直腸癌新輔助治療后病理消退影響因素分析
左志貴1,王顥2,高顯華2,于志奇2,竇唯龍2,傅傳剛2,宋華羽1,李激1
(1.溫州醫科大學附屬第一醫院 肛腸外科,浙江 溫州 325015;2.第二軍醫大學附屬長海醫院肛腸外科,上海 200433)
目的:分析局部進展期中低位直腸癌患者新輔助治療后病理消退相關影響因素,探討規范化新輔助治療對提高局部進展期直腸癌治療效果的價值。方法:對2002年1月至2009年12月期間122例局部進展期中低位直腸癌患者接受新輔助治療后行手術的臨床資料及術后病理消退分級進行回顧性研究,logistic回歸分析與直腸癌新輔助治療后病理消退相關的影響因素。結果:122例患者中明顯病理消退52例,其中完全病理消退11例,病理消退不明顯70例。長程放療方案病理明顯消退率高于短中程放療(60% vs 30.56%,P=0.005),同步放化療病理明顯消退率高于單純放療(54.05% vs 25%,P=0.002),放療總量>4 000 cGy病理明顯消退率高于總量≤4 000 cGy(60.42% vs 31.08%,P=0.001),logistic回歸分析顯示同步放化療及長程放療是局部進展期直腸癌患者新輔助治療后病理消退分級的兩個獨立影響因素(P<0.05)。自2006年1月至2009年12月4年間接受新輔助治療的直腸癌患者(A組,66例)中同步放化療、長程放療、放療總量達到4 000 cGy以上及術前放化療后時間間隔達到6周的比率均高于自2002年1月至2005年12月4年間接受新輔助治療的直腸癌患者(B組,56例)(71.43% vs 51.51%,57.14% vs 27.27%,48.21% vs 30.30%,50% vs 28.79%)。結論:局部進展期中低位直腸癌行長程放療、同步放化療臨床療效優于短中程放療、單純術前放療,延長術前同步放化療后時間間期有提高臨床療效的趨勢,規范化術前同步放化療可提高局部進展期直腸癌患者的臨床療效。
直腸腫瘤;病理消退;新輔助治療;影響因素
隨著新輔助治療聯合全直腸系膜切除(TME)術及術后輔助化療作為局部進展期中低位直腸癌的標準治療方案,新輔助治療臨床效果成為醫生共同關注的問題。新輔助治療直腸癌術后標本的病理消退分級與其預后密切相關,目前大多臨床研究將病理消退分級作為判斷新輔助治療后直腸癌患者長期生存率的替代指標,故提高局部進展期中低位直腸癌新輔助治療后病理消退分級是提高直腸癌治療效果的關鍵[1]。本研究分析了局部進展期中低位直腸癌新輔助治療后病理消退有關的影響因素,為提高局部進展期直腸癌新輔助治療效果提供一些參考。
1 資料和方法
1.1 一般資料
1.1.1 納入標準:①術前活檢病理診斷為直腸癌;②腫瘤遠端距肛緣≤10 cm;③患者年齡≥18歲;④依據第7版直腸癌TNM分期標準,經盆腔CT或MRI等檢查,證實腫瘤侵犯漿膜下或者侵犯無腹膜覆蓋的直腸周圍組織(T3),或者直接侵犯其他器官、結構和/或穿透臟層腹膜(T4),有或無淋巴結轉移(N+),即確診為T3-4NxM0局部進展期直腸癌;⑤術前接受單純放療或者同步放化療;⑥臨床資料及術后標本石蠟塊等病理資料完整。
1.1.2 排除標準:①治療前X線胸片、CT、超聲及MRI等檢查排除肺部、縱隔、肝臟、腹主動脈旁淋巴結等遠處轉移者;②既往接受過直腸手術、因其他疾病接受過化療或者盆腔放療者;③合并其他腫瘤患者;④姑息性切除或非根治性切除者。
1.1.3 對象:按照上述納入和排除標準,第二軍醫大學附屬長海醫院肛腸外科2002年1月至2009年12月收治的局部進展期中低位直腸癌患者122例納入研究,其中男79例,女43例;年齡23~88歲,中位年齡52歲,平均(52.89±13.94)歲。所有患者均行TME術切除并達根治性切除。
1.1.4 分組:為了解隨時間推移局部進展期直腸癌患者接受新輔助治療的總體情況變化,將8年間納入研究的122例患者分為兩組,2002年1月至2005年12月4年間接受新輔助治療患者納入A組(66例),2006年1月至2009年12月4年間接受新輔助治療患者納入B組(56例)。
1.2 新輔助治療方法放射治療采用VARIAN牌CLINAC21EX型6MVX射線醫用直線加速器(美國瓦里安公司),照射野為盆腔前后野加兩個水平側野或盆腔后野加兩個水平側野。放療方案分三種:①短程高劑量放療(總劑量25 Gy,每天1次,照射5次,單次劑量500 cGy),療程l周,放療結束1周手術;②中程中劑量放療(總劑量30~45 Gy,照射10~15次。單次劑量300 cGy),療程2~3周,放療結束4周手術;③長程小劑量放療(總劑量45~54 Gy,照射25~30次,單次劑量180 cGy),療程5~6周,放療結束4~6周手術。手術方式包括低位前切除(Dixon)術、腹會陰聯合切除(Miles)術以及Hartmann手術。同步放化療患者放療期間希羅達口服同步化療(825 mg/m2,每天2次,每周5 d或7 d)。
1.3 術后輔助化療情況所有術前放療或同步放化療患者均給予術后輔助化療。術前單純放療者術后給予mFOLFOX6(氟尿嘧啶、亞葉酸鈣和奧沙利鉑)或CapeOX方案(卡培他濱和奧沙利鉑)持續6個月,術前接受同步放化療患者予CapeOX方案8療程。
1.4 放療后病理消退分級評估標準參考國際上普遍采用Dworak等[2]制定的直腸癌放療后病理消退分級TRG標準:TRG0為腫瘤病理上完全無消退,腫瘤細胞無變化;TRG1為腫瘤輕微消退,腫瘤組織中伴部分纖維化,但纖維化組織占全部腫瘤組織≤25%;TRG2為病理中度消退,腫瘤組織中有較明顯纖維化,纖維化占26%~50%;TRG3為為腫瘤消退良好,纖維化細胞占腫瘤全部50%以上;TRG4為腫瘤完全消退,已經完全找不到腫瘤細胞,僅見纖維組織。定義直腸癌放療后病理消退明顯為TRG2-3,見圖lA,統計分析時TRG4納入病理消退明顯組,病理消退不明顯為TRG0-1,見圖1B。

圖1 直腸癌放療后標本病理改變(HE,×50)
1.5 隨訪方法所有患者均錄入直腸腫瘤病例隨訪登記表,記錄患者一般資料、手術情況、術后病理及輔助化療情況,術后隨訪方法主要是門診復查、電話問詢。隨訪起始時間從患者出院后1個月開始,2年內3個月隨訪1次,2~5年6個月隨訪1次,5年后1年隨訪1次。末次隨訪時間為2012年12月,生存期從手術后第1天開始計算。
1.6 統計學處理方法使用SPSS17.0統計軟件。分別采用x2檢驗和logistic回歸分析對直腸癌病理消退分級的影響因素進行單因素和多因素分析,2005年前4年與2005年后4年兩組患者臨床及治療因素比較采用x2檢驗,2005年前4年與2005年后4年兩組患者3年生存率比較采用x2檢驗,總體生存率比較采用Kaplan-Meier生存分析及Log-rank檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 影響新輔助治療病理消退分級單因素分析結果122例患者明顯病理消退52例(占42.62%),其中完全病理消退11例(占9.02%),病理消退不明顯70例(占57.38%)。單因素分析顯示長程放療、同步放化療方案、放療總量>4 000 cGy是提高局部進展期直腸癌術前放化療后病理明顯消退率的影響因素(60.00% vs 30.56%,P=0.005;54.05% vs 25%,P= 0.002;60.42% vs 31.08%,P=0.001),延長術前同步放化療后間隔時間有提高病理明顯消退率的趨勢,但差異沒有統計學意義(P=0.062),其他因素均不是術前放化療后病理消退影響因素(P>0.05)(見表l)。
2.2 影響新輔助治療病理消退分級的多因素分析結果上述單因素分析有統計學意義的指標和可能對病理明顯消退有影響的術前同步放化療后時間間隔一起納入logistic多因素回歸分析,結果顯示只有長程放療和同步放化療方案為提高直腸癌放療后病理明顯消退的兩個獨立影響因素(P=0.02和P=0.04)(見表2)。
2.3 A組與B組治療情況比較結果兩組患者在性別、年齡、手術方式、腫瘤分化以及TNM分期方面差異無統計學意義(P>0.05),B組同步放化療方案、放療總劑量>4 000 cGy以及術前放化療后時間間隔≥6周的患者比例均顯著提高,與A組相比差異有統計學意義(P=0.03,P=0.04,P=0.02),隨著臨床實踐增加和患者依從性提高,術前同步放化療規范化程度顯著提高(見表3)。
2.4 A組與B組患者生存分析結果至隨訪截止時間時15例失訪,其余患者均獲得隨訪,隨訪率為87.7%,最長隨訪時間120個月,最短隨訪時間11個月,中位隨訪時間68個月。B組3年生存率為71.43%(40/ 56),明顯高于A組的45.55%(36/66),但兩組之間差異無統計學意義(x2=3.68,P=0.06)。兩組患者生存曲線顯示生存曲線分開,B組總體生存時間相對A組延長(見圖2),但Log-rank檢驗顯示兩組間總體生存率比較差異無統計學意義(P=0.06)。
3 討論
3.1 局部進展期直腸癌新輔助治療臨床療效的影響因素影響局部進展期直腸癌患者新輔助治療效果的因素主要包括腫瘤相關因素和治療相關因素。腫瘤相關因素是腫瘤固有生物學特征,可以通過基因檢測將對放化療敏感患者從局部進展期中低位直腸癌患者群中篩選出來,使敏感患者從中獲益而提高治療效果,有研究顯示P53、P21、P27及MRP4等是與放療敏感性相關的基因[3-4],但目前尚無可應用于臨床篩選的有效分子標志物,同時腫瘤相關因素具有不可控性,目前醫療方法尚不能改變腫瘤固有的生物學特征。
而治療相關因素具有明顯的可控性,規范化的術前同步放化療對于提高局部進展期直腸癌患者的治療效果具有重要作用。臨床研究顯示與新輔助治療效果治療相關的因素主要包括放化療方案、同步化療藥物、放療總劑量以及放化療后手術時間間隔等許多方面。我們的研究結果顯示術前同步放化療較單純放療可以提高病理明顯消退率,這與2006年Gé rard等[5]報道來自法國FFCD 9203臨床試驗結果相符,該研究將733例局部晚期直腸癌患者隨機分為術前放療聯合氟尿嘧啶組和術前單純放療組,結果顯示術前放療聯合氟尿嘧啶組有較高的病理完全緩解率(11.4% vs 3.6%,P<0.01)和較低局部復發率(8.1% vs 16.5%,P<0.01)。2010年Latkauskas等[6]行Meta分析納入1984-2006年間總共4項術前聯合放化療與術前單獨放療的隨機對照研究顯示術前聯合放化療可以降低局部復發率,提高病理明顯緩解率,進一步說明氟尿嘧啶與放療在局部晚期直腸癌術前放化療中具有良好協同作用。雖然2010年法國Gerard等[7]報道ACCORD12研究、2011年意大利Aschele等[8]報道STAR-01研究以及美國Roh等[9]報道NSABP R-04研究均認為奧沙利鉑用于術前新輔助放療沒有增加臨床療效,反而增加了不良反應,但2012年德國Rodel等[10]報道CAO/ ARO/AIO-04研究顯示奧沙利鉑用于術前新輔助放療增加臨床療效(奧沙利鉑組613例,氟尿嘧啶組623例,pCR兩組比較17% vs 13%,P=0.038),但其效果有待長期隨訪結果。
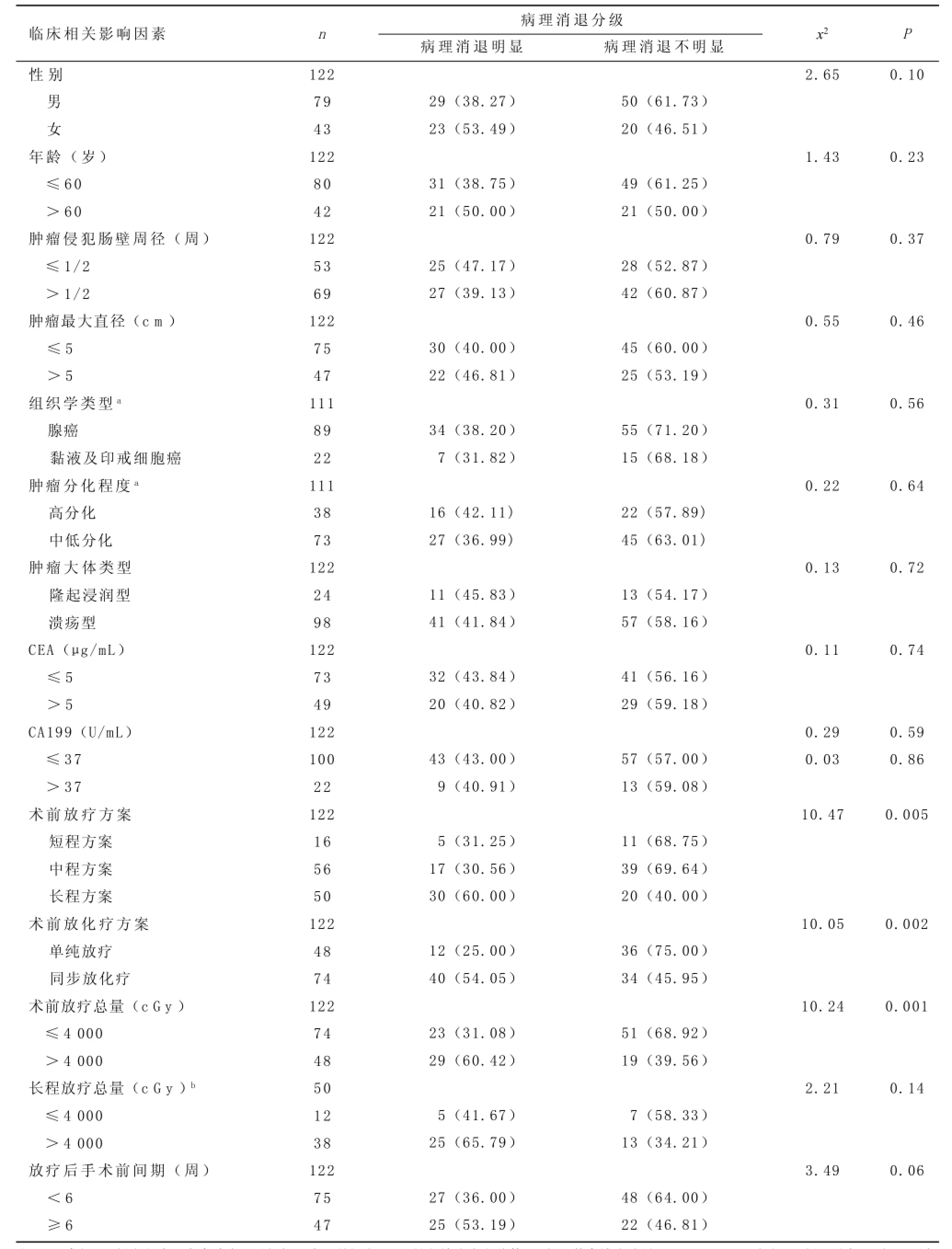
表1 影響直腸癌新輔助治療后病理消退分級的單因素分析 n(%)

表2 影響直腸癌新輔助治療后病理消退分級的多因素logistic回歸分析

表3 A組與B組新輔助治療直腸癌患者臨床相關因素比較n(%)
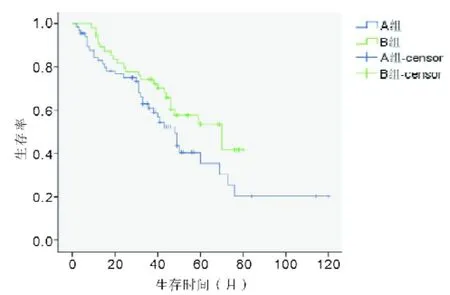
圖2 A組與B組接受新輔助治療中低位直腸癌患者生存曲線比較
目前臨床應用的放療方案主要有長、中、短三種,這些方案各有優缺點,放療作為一種對腫瘤直接殺傷作用的物理治療方式可能與其總劑量有關,本研究顯示長程放療和放療總劑量超過4 000 cGy時病理明顯消退率明顯高于短中程放療和低于4 000 cGy的照射劑量,多因素分析顯示長程放療方案是病理消退的獨立影響因素,說明超過4 000 cGy時明顯病理消退主要來自長程方案的貢獻。2012年Jakobsen等[11]報道在50.4 Gy總量的基礎上在腫瘤局部追加10 Gy的放療可以使腫瘤明顯消退率明顯增加(29% vs 44%,P=0.04),顯示增加放療劑量可提高臨床效果。Tulchinsky等[12]研究顯示術前放化療與手術時間間隔大于7周時術后病理明顯消退率增加,而de Campos-Lobato等[13]研究則顯示術前放化療與手術時間間隔大于8周時不僅安全,而且術后病理完全消退率及病理明顯消退率增加,但是Glynne-Jones等[14]研究認為延長時間間隔需要謹慎,因可能增加遠處轉移率,所以術前放化療后手術前行加強化療可能是一種可供選擇的穩妥方案。
3.2 規范化術前同步放化療可以提高局部進展期直腸癌治療效果本研究比較了2002年1月至2005年12月4年與2006年1月至2009年12月4年間接受術前放化療直腸癌患者的基本特征及術前放化療的完成情況,結果顯示2005年以后患者接受同步放化療、放療總量>4 000 cGy、手術時間達到6周患者比例均明顯增加,說明隨著術前放化療臨床重視程度的不斷增加及患者依從性不斷提高,直腸癌術前同步放化療規范化程度不斷增加。
隨訪結果顯示B組3年生存率明顯高于A組,同時生存曲線顯示兩組生存曲線隨時間延長逐漸分離,但差異沒有統計學意義,考慮可能存在以下兩個原因:首先由于B組病例隨訪時間相對A組時間短,獲得死亡結局事件少;其次,本組病例數較少,更準確的結論需要更大樣本研究結果。因兩組患者在性別、年齡、手術方式、腫瘤分化以及TNM分期方面統計學檢驗顯示差異無統計學意義,所以在兩組其他影響長期生存因素基本均衡的前提下,結果提示規范化術前同步放化療包括足夠的放療總量、放化療后時間間隔的延長這些治療相關因素的規范化在提高患者的總體生存率上起主要作用。規范化術前同步放化療的完成取決于患者及醫生雙重因素,需要通過完善的術前教育提高患者的依從性從而提高術前同步放化療的完成率,規范化的同步放化療必將使患者從中獲益。
[1]Mohiuddin M, Mohiuddin MM, Marks J, et al. Future directions in neoadjuvant therapy of rectal cancer: Maximizing pathological complete response rates[J]. Cancer Treat Rev, 2009, 35(7): 547-552.
[2]Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy[J]. Int J Colorectal Dis, 1997, 12(1): 19-23.
[3]柴瑞, 于志奇, 傅傳剛, 等. 多藥耐藥蛋白4與直腸癌放療敏感性關系的初步研究[J]. 中華胃腸外科雜志, 2011, 14(8): 627-630.
[4]胡芝, 柯曉慧, 黃一統, 等. P27在宮頸鱗癌放療前后的表達及臨床意義[J]. 溫州醫學院學報, 2007, 37(2): 162-164.
[5]Gérard JP, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203[J]. J Clin Oncol, 2006, 24(28): 4620-4625.
[6]Latkauskas T, Paskauskas S, Dambrauskas Z, et al. Preoperative chemoradiation vs radiation alone for stage II and III resectable rectal cancer: a meta-analysis[J]. Colorectal Dis, 2010, 12(11): 1075-1083.
[7]Gerard JP, Azria D, Gourgou-Bourgade S, et al. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer[J]. J Clin Oncol, 2012, 30(36): 4558-4565.
[8]Aschele C, Cionini L, Lonardi S, et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase III trial[J]. J Clin Oncol, 2011, 29(20): 2773-2780.
[9]Roh MS, Colangelo LH, O'Connell MJ, et al. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03[J]. J Clin Oncol, 2009, 27(31): 5124-5130.
[10]Rodel C, Liersch T, Becker H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ ARO/AIO-04 randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(7): 679-687.
[11]Jakobsen A, Ploen J, Vuong T, et al. Dose-effect relationship in chemoradiotherapy for locally advanced rectal cancer: a randomized trial comparing two radiation doses[J]. Int J Radiat Oncol Biol Phys, 2012, 84(4): 949-954.
[12]Tulchinsky H, Shmueli E, Figer A, et al. An interval >7 weeks between neoadjuvant therapy and surgery improves pathologic complete response and disease-free survival in patients with locally advanced rectal cancer[J]. Ann Surg Oncol, 2008, 15(10): 2661-2667.
[13]de Campos-Lobato LF, Geisler DP, da Luz Moreira A, et al. Neoadjuvant therapy for rectal cancer: the impact of longer interval between chemoradiation and surgery[J]. J Gastrointest Surg, 2011, 15(3): 444-450.
[14]Glynne-Jones R, Grainger J, Harrison M, et al. Neoadjuvant chemotherapy prior to preoperative chemoradiation or radiation in rectal cancer: should we be more cautious?[J]. Br J Cancer, 2006, 94(3): 363-371.
(本文編輯:吳健敏)
Influencing factors of good pathological tumor regression grades after neoadjuvant therapy in locally advanced rectal cancer
ZUO Zhigui1, WANG Hao2, GAO Xianhua2, YU Zhiqi2, DOU Weilong2, FU Chuangang2, SONG Huayu1, LI Ji1.1.Department of Colorectal Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Colorectal Surgery, Changhai Hospital, the Second Military Medical University, Shanghai, 200433
Objective:To analyze the influencing factors of good pathological tumor regression grades after neoadjuvant chemoradiotherapy (CRT) in locally advanced rectal cancer (LARC) and evaluate the value of standardized concurrent preoperative CRT in improving the clinical efficacy in LARC.Methods:A total of 122 patients with LARC receiving neoadjuvant CRT between January 2002 and December 2009 were analyized retrospectively. The tumor regression grades (TRG) were detected by HE staining. Logistic regression analysis was used to evaluate the influencing factors associated with clinical efficacy after neoadjuvant CRT in LARC.Results:Fifty-two patients reached good TRG, including 11 patients with pathological complete response, 70 patients were poorly responsive to radiation. The good response rate after long-course radiation therapy (RT) was significantly higher than that of patients who underwent short/medium course RT (60% vs 30.56%, P=0.005), the good response rate with concurrent preoperative CRT was significantly higher than that of patients with preoperative RT alone (54.05% vs 25%, P=0.002), the good response rate after RT dose>4 000 cGy was significantly higher than that of patients underwent RT dose≤4 000 cGy (60.42% vs 31.08%, P=0.001). Logistic regression analysis showed the concurrent preoperaticve CRT and long-course RT were independently associated with theclinical efficacy in LARC after neoadjuvant CRT. The rate of patients received concurrent preoperative CRT, longcourse RT, RT dose>4 000 cGy and the interval between neoadjuvant CRT and surgery≥6 weeks between January 2006 and December 2009 was significantly higher than that of patients between January 2002 and December 2005 (71.43% vs 51.51%, 57.14% vs 27.27%, 48.21% vs 30.30%, 50.0% vs 28.79%). Conclusion: Concurrent preoperative CRT and long-course RT provide higher good response rate, standardized preoperative concurrent CRT may improve the clinical efficacy in patients with LACR.
rectal neoplasm; tumor regression grades; neoadjuvant chemoradiotherapy; clinical influencing factors
R735.37
A
1000-2138(2014)04-0235-06
2013-10-28
國家自然科學基金資助項目(30973460,81272561);溫州市科技局科研基金資助項目(Y20100021)。
左志貴(1976-),男,湖北京山人,主治醫師,醫學博士。

