微創通道與傳統內固定治療胸腰椎骨折的療效比較
吳增志,賴茂松,熊浩,羅鵬剛,林偉文,凌華軍,夏雄超
(佛山市高明區人民醫院脊柱外科,四川 佛山 528500)
隨著車禍及工傷發生率的增加,胸腰椎骨折的發病率也隨之上升,治療不當將嚴重影響患者的生活質量。傳統手術以切開復位內固定為主,但開放手術中廣大的椎旁肌肉剝離,過多腰椎后路肌肉組織的破壞易導致術后頑固性腰背部疼痛[1]。因此,脊柱微創手術受到廣大患者及醫生的青睞[2]。目前,通過套管擴張小切口內窺鏡下后路微創胸腰椎椎弓根釘棒內固定術已應用于臨床[3],而經胸腰椎微創牽開器Mast Quadrant行微創椎弓根釘內固定聯合傷椎椎體成形術治療胸腰椎骨折的臨床報道在國內尚不多見,且臨床初步應用顯示出明顯的優越性。自2008年2月至2012年5月采用Mast Quadrant微創手術系統椎弓根內固定并傷椎椎體成形術治療T10~L3新鮮骨折20 例,并與26 例傳統開放手術患者進行比較,效果滿意,現報道如下。
1 資料與方法
1.1 一般資料 自2008年2月至2012年5月共收治無明顯神經損傷的胸腰段壓縮性骨折患者46 例,接受微創或傳統開放椎弓根螺釘內固定聯合傷椎椎體成形術。微創組:20 例,男8 例,女12 例;年齡48~65 歲,平均54 歲。傳統開放組:26 例,男11 例,女15 例;年齡45~61 歲,平均56 歲。受傷原因:交通事故傷22 例,高處墜落傷13 例,平地跌倒傷11 例;受傷節段:T11骨折5 例,T12骨折13 例,L1骨折17 例,L2骨折9 例,L3骨折2 例。所有病例均常規行胸腰椎正側位X線、CT平掃及三維重建、MRI等檢查,以全面了解骨折的類型及椎管占位情況。經CT檢查證實兩組間術前各影像學指標(Cobb角、椎體矢狀面指數、椎體前緣高度)比較差異無統計學意義(P>0.05),且椎管占位小于椎管矢狀徑1/3,無明顯神經損傷癥狀、無需椎管減壓。
1.2 手術方法 微創組:手術取全麻俯臥位,術前在C型臂前后位透視下,定位病變節段上、下位椎體椎弓根根部,用記號筆作體表標記,沿2個中心點橫向劃線,與脊柱后正中線交點之間即為手術切口(見圖1),長約為4.0 cm。依次切開皮膚、皮下,顯露腰背筋膜。先在一側椎旁1.5~2.0 cm處切開,從傷椎多裂肌間隙將最細導管直接插入,逐級擴張導管,并用導管做上下、左右的軟組織剝離。依據擴張導管外壁的深度標尺,選擇合適深度的Quadrant通道葉片,連接固定至自由臂,使用Quadrant系統的自動撐開裝置將通道兩臂撐開,形成上窄下寬的圓錐形狀手術通道,連接Quadrant系統專用冷光源,完成通道的建立(見圖2)。根據需要調整工作通道的方向,使視野清晰暴露關節突關節,于病變節段上下位椎體椎弓根內各置入椎弓根螺釘,內固定后縱向撐開,利用完整的前后縱韌帶的牽拉及壓迫作用完成壓縮椎體高度恢復,再經病椎椎弓根打入穿刺針,C型臂透視下證實穿刺針經椎弓根至椎體前1/3,完成工作通道。用專用注射器將處于黏稠狀態的骨水泥注入病變椎體,注射時應在側位透視下全程觀察注射過程,當注射壓力很小時,可能發生椎體滲漏,要停止注射。注射完成后停留約5 min,旋轉穿刺針后拔出,再于傷椎椎弓根置入椎弓根釘,連接棒固定后取出Quadrant系統,將皮膚牽向對側,同法行對側椎弓根釘棒內固定,雙側分別放置引流管并逐層縫合手術切口。

圖1 手術標記及切口示意
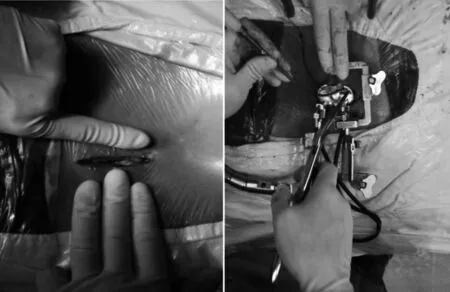
圖2 Mast Quadrant系統工作通道
傳統開放組:手術體位、定位及麻醉方式同微創組,由腰背部正中切口進入,暴露傷椎及上下各1個椎體,具體置入椎弓根釘棒系統及傷椎注入骨水泥流程同微創組。
1.3 圍手術期處理 術前1 h及術后48 h常規應用抗生素預防感染,并進行規范抗骨質疏松等治療,24 h引流量小于30 mL予拔出引流管,術后3~5 d配帶腰圍逐漸下地行走,術后3個月內避免過度彎腰及旋轉腰部。術后1年內每隔3個月、1年后每6個月進行隨訪,復查胸腰段X線片。
1.4 療效評價
1.4.1 臨床評價 a)圍手術期觀測:手術切口長度、手術時間、術中出血量、術后引流量及住院天數等指標。b)疼痛評分:采用疼痛視覺模擬評分(visual analogue scale,VAS)[4]評估術前、術后1個月、3個月、6個月、1年及末次隨訪時的疼痛情況,對腰背部疼痛進行臨床評估,1代表無痛,10代表嚴重疼痛。
1.4.2 影像學評估 術后1周全部病例行X線檢查,并與術前X線片對比觀察,測量傷椎前緣高度、矢狀面Cobb角的恢復及隨訪時丟失情況。
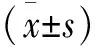
2 結 果
2.1 圍手術期觀察指標 微創手術組與開放手術組的住院時間差異無統計學意義(P>0.05),而手術切口的長度、手術時間、術中出血量、術后引流量等差異均有統計學意義(P<0.05,見表1)。
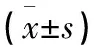
表1 微創手術組與開放手術組圍手術期觀察指標比較
2.2 VAS評分對比 微創組與開放組術后疼痛均明顯緩解,與術前比較差異有統計學意義(P<0.05)。微創組術后6個月內疼痛緩解較明顯,兩組比較差異有統計學意義,術后1年左右兩組趨于一致,無明顯統計學差異(見圖3)。
2.3 影像學結果 兩組術前與術后影像學比較(見圖4~6),矢狀位后凸Cobb角與傷椎椎體前緣高度差異均有統計學意義(P<0.05),微創組術后Cobb角、傷椎前緣高度的改善程度與開放手術組比較差異無統計學意義(P>0.05),末次隨訪期間兩組矯正度丟失差異無統計學意義(P>0.05),見表2。
3 討 論
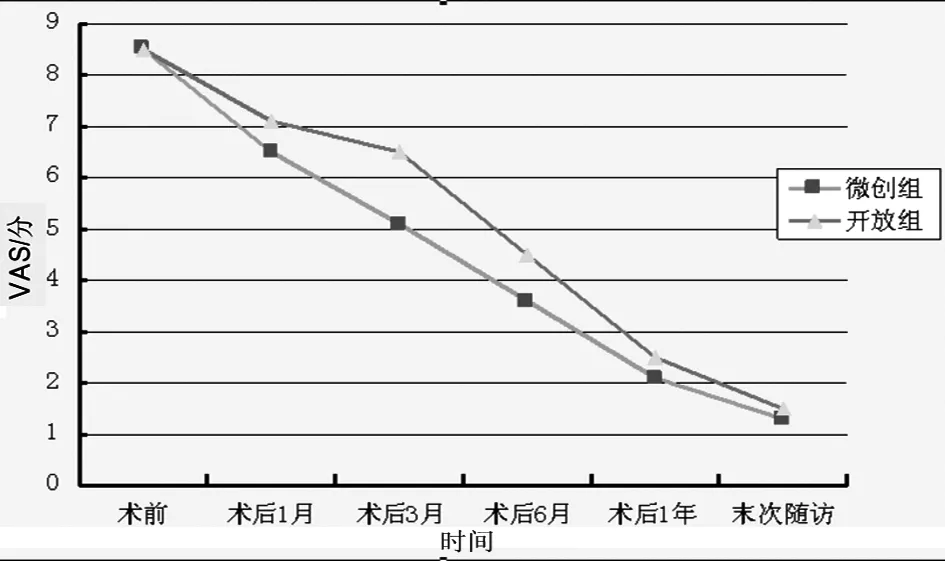
圖3 兩組各時期VAS評分比較
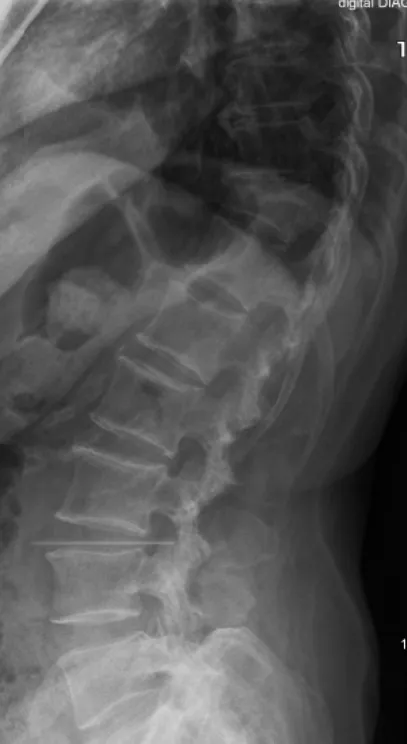
圖4 胸腰椎壓縮性骨折術前X線片

圖5 胸腰椎壓縮性骨折術前MRI
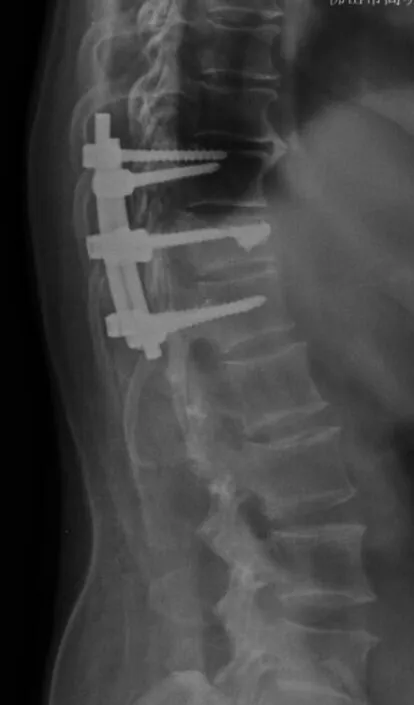
圖6 胸腰椎壓縮性骨折術后X線片
目前,對于無神經損傷癥狀的胸腰椎骨折的治療方案仍存在爭議,傳統后路切開短節段椎弓根釘復位固定仍是胸腰椎骨折最常采用的技術。由于傳統開放性椎弓根釘內固定手術需剝離胸腰椎椎旁肌群,尤其是雙側多裂肌,并牽開以暴露視野,勢必對多裂肌造成損傷及失神經支配,同時切除棘突及其周圍韌帶使后柱結構遭受嚴重破壞,容易導致胸腰椎屈伸力量減弱和遲發性脊柱不穩;骶棘肌受到剝離后通過瘢痕相互愈合,其正常生理特性遭受損害,可影響軀干肌肉強度,導致部分患者術后殘留頑固性腰背痛[5]。脊柱后路手術中椎旁肌止點的剝離已成為腰椎術后失敗綜合征的一個重要因素[6]。同時,肌肉軟組織廣泛剝離不但造成術中出血量大大增加,也影響植骨融合區域的血液供應,降低融合率[7]。經Mast Quadrant管道行后路椎弓根釘棒固定術可直接到達病變節段,可以在直視下行椎弓根釘內固定,并行傷椎注入適量骨水泥椎體成形。其工作原理是經多裂肌間隙插入擴張通道管,在由小到大逐級置入擴張管的過程中,擴張管主要通過肌肉間隙或肌束間隙,肌纖維逐漸被推開,肌肉排列順序不會發生改變,術后肌纖維之間基本不形成瘢痕組織,有效保留椎旁軟組織的生理功能,降低術后殘留腰背痛的發生率。
表2 微創組與開放組影像學比較
然而,單純依靠釘棒系統撐開牽拉只能恢復傷椎的高度和大體外形,傷椎體內松質骨缺損導致蛋殼樣改變,椎體負重后前柱的支撐力不足,早期下地后椎體有塌陷、高度丟失的趨勢,導致椎弓根釘棒上的應力急劇增加,易出現螺釘松動、斷釘斷棒等現象,內固定失敗率很高。以往微創椎弓根內固定雖然能為骨折早期提供可靠的穩定,但傷椎椎體內骨小梁未完全復位,傷椎內存在空隙,如空隙過大不會全部骨愈合,部分會以纖維組織形式填充,不能及時重建脊柱的前、中柱穩定性,使后路內固定持續負重,導致內固定失敗及糾正度丟失[8]。Korovessis等[9]報告用磷酸鈣骨水泥進行椎體重建并與椎弓根釘相結合可減小椎弓根釘的應力,明顯降低內固定失敗率,是治療椎體壓縮性骨折安全而有效的方法。
本研究經mast Quadrant微創手術系統椎弓根內固定并傷椎椎體成形術治療T10~L3新鮮骨折20 例,并與26 例傳統開放手術患者進行比較,結果顯示:微創手術組與傳統開放手術組相比,具有更小的手術切口,更短的手術時間,更少的術中出血量及術后引流量,術后患者傷口疼痛VAS評分明顯降低。通過影像學檢查的評估結果顯示:微創手術組與傳統開放手術組術后脊柱后凸畸形(術后Cobb角)及傷椎椎體前緣高度均較術前有明顯改善,而兩組比較在脊柱后凸畸形矯正率方面差異無統計學意義。
在嚴格掌握手術適應證的前提下,經MAS Quadrant微創椎弓根內固定并傷椎椎體成形術不但手術操作簡單、安全可靠,具有創傷少、出血少、恢復快等優勢,而在傷椎畸形矯正和內固定中已達到傳統開放手術的效果,可使骨折椎體獲得更好的復位并得以維持,從而更加放心地進行術后早期下地鍛煉。脊柱外科微創手術革新了傳統開放手術方式,推動了脊柱外科技術的發展,使用可擴張通道微創系統(mast Quadrant)手術特點是可直視下完成手術,彌補了非直視下手術鏡下二維視野的局限性,適應性較廣。
參考文獻:
[1]Kim KT,Lee SH,Suk KS,etal.The quantitative analysis of tissue injury markers after mimi-open lumbar fusion[J].Spine,2006,31(6):712-716.
[2]Park Y,Ha JW.Comparison of one-Level posterior lumbar interbody fusion performed with a minimally invasive approach or a traditional open approach[J].Spine,2007,32(5):537-543.
[3]Jarvel K,Kaukinen S.Hypertonic saline(7.5%) decreases perioperative weight gain following cardiac surgery[J].J Cardiothorac Vassc Anesth,2002,16(1):43-46.
[4]Huskisson EC.Measurement of pain[J].Lancet,1974,2(7889):1127-1131.
[5]Tajima N,Chosa E,Watanabe S.Posterolateral lumbar fusion[J].J Orthop Sci,2004,9(3):327-333.
[6]Fourney DR,Dettori JR,Norvell DC,etal.Does minimal access tubular assisted spine surgery increase or decrease complications in spinal decompression or fusion[J].Spine,2010,35(9):57-65.
[7]Bawa M,Schimizzi AL,Leek B,etal.Paraspinal muscle vasculature contributes to posterolateral spinal fusion[J].Spine,2006,31(8):891-896.
[8]周其璋,劉永恒,梁必如.經椎弓根植骨內固定治療胸腰椎骨折的臨床分析[J].中國骨與關節損傷雜志,2006:21(4):283-284.
[9]Korovessis P,Repantis T,Petsinis G,etal.Direct reduction of thoracolumbar burst fractures by means of balloon kyphoplasty with calcium phosphate and stabilization with pedicle-screw instrumentation and fusion[J].Spine,2008,33(4):100-108.

