冬凌草甲素對骨肉瘤細胞的凋亡誘導效應的研究
唐新橋,朱寶玉,王萬春
·藥理毒理·
冬凌草甲素對骨肉瘤細胞的凋亡誘導效應的研究
唐新橋1,朱寶玉1,王萬春2
目的:考察冬凌草甲素是否能誘導MG-63細胞凋亡。方法:用不同濃度的冬凌草甲素作用于MG-63細胞,用Hochest33258染色鑒定MG-63細胞凋亡的形態學特征;用流式細胞儀分析MG-63早期凋亡細胞的百分率;用Caspase-8蛋白印跡分析證明MG-63細胞凋亡發生的分子特征。結果:凋亡細胞形態學鑒定、流式細胞儀檢測均有力證明冬凌草甲素能以濃度依賴性方式誘導MG-63細胞凋亡;冬凌草甲素誘導MG-63細胞凋亡伴有Caspase-8蛋白表達上調和裂解激活。結論:冬凌草甲素能以濃度依賴性方式誘導MG-63細胞凋亡。
冬凌草甲素;人骨肉瘤細胞株MG-63細胞;凋亡;分子機制
多項研究表明,冬凌草甲素能抑制前列腺癌[1]、乳腺癌[2]、肝癌[3]、肺癌[4]和血液系統腫瘤[5]等多種腫瘤的發生發展,在臨床治療惡性腫瘤方面展示出良好的應用前景。其具體作用機制尚不甚清楚,有研究認為增殖抑制是冬凌草甲素抗腫瘤作用的重要環節之一,也有研究發現冬凌草甲素抗腫瘤作用常常與其誘導腫瘤細胞凋亡有關[6]。為了解冬凌草甲素對人骨肉瘤細胞MG-63細胞株是否具有凋亡誘導效應,作者在體外條件下對不同濃度冬凌草甲素干預的MG-63細胞的凋亡現象進行了研究。
1 材料和方法
1.1 實驗材料
人骨肉瘤細胞株MG-63細胞引自中南大學湘雅二醫院內分泌研究所。冬凌草甲素購自中國科學院昆明植物研究所。Hochest33258染料購自凱達生物公司。兔抗人Caspase-8抗體為StressGen 公司產品;ECL(Enhanced chemiluminescence)試劑盒購自Amersham公司;Annexin V-FITC/PI凋亡試劑盒購自BECTON DICKINSON公司。BD FACSCalibur型流式細胞儀為美國BECTON DICKINSON公司產品;Lamda-Bio10型紫外分光光度計為美國Perkin Elmer公司產品;PAC200型電泳轉膜系統及Mini-PROTEAN II 電泳槽為美國Bio-Rad公司產品;自動X光沖片機和膠片為美國柯達公司產品。
1.2 研究方法
1.2.1 細胞培養 液氮內取出凍存的人骨肉瘤細胞株MG-63細胞,復蘇后貼壁生長,傳代培養。取對數生長期的MG-63細胞,制成細胞懸液,待用。
1.2.2 Hochest33258染色檢測細胞凋亡 取對數生長期的MG-63細胞,胰蛋白酶消化,制成細胞懸液,調整細胞數為3.0×105個/mL,接種于無菌6孔培養板中,每孔2 mL。各實驗組加入等體積不同濃度的冬凌草甲素,混勻,使冬凌草甲素終濃度分別為
12.5 、25、50 μmol.L-1,對照組加等體積DMSO。48小時后,離心去液體,用冷的PBS洗兩遍,涂片,1 mL 4%的甲醛溶液4℃固定10 min,PBS洗兩遍,滴加100 μL Hochest33258工作液,室溫下放置10分鐘,沖洗干凈,自然風干,在熒光顯微鏡下紫外光340 nm波長激發觀察。立即在熒光顯微鏡下觀察并照相,鏡下隨機計數10個視野,按以下公式計算細胞凋亡率:凋亡率(%)=(凋亡細胞數/總細胞數)×100%,重復3次。
1.2.3 Annexin V-FITC/PI雙標記法檢測細胞早期凋亡 取對數生長期的MG-63細胞,胰蛋白酶消化,制成細胞懸液,調整細胞數為3.0×105個/mL,接種于無菌6孔培養板中,每孔2 mL,各實驗組加入等體積不同濃度的冬凌草甲素,混勻,使冬凌草甲素終濃度分別為12.5、25、50 μmol.L-1,對照組加入等體積DMSO。分別培養24和48小時后,1000 rpm離心5分鐘,棄上清后消化收集細胞,流式細胞儀上進行Annexin V檢測(按試劑盒說明書進行操作,步驟略)。
1.2.4 Western印跡檢測Caspase-8蛋白表達 取對數生長期的MG-63細胞,胰蛋白酶消化,制成細胞懸液,調整細胞數為3.0×105個/mL,接種于無菌培養瓶中。各實驗組加入等體積不同濃度的冬凌草甲素,混勻,使冬凌草甲素終濃度分別為12.5、25、50 μmol.L-1,對照組加等體積DMSO。48小時后,收集細胞,按常規步驟抽提蛋白質,Bradford 法測定蛋白質含量,SDS聚丙烯酰胺凝膠電泳,將凝膠中的蛋白質電轉至PVDF膜,加入兔抗人Caspase-8抗體孵育,ECL試劑盒檢測液Caspase-8蛋白信號,自動X光沖片機沖片。
1.2.5 統計學分析 不同藥物濃度處理組與對照組的細胞凋亡率比較采用t檢驗分析;各種統計圖采用SPSS11.5 for windows及Microcoft Excel統計軟件獲得。
2 結果
2.1 Hochest33258染色結果
對照組MG-63細胞的細胞核界限清晰,呈圓形或橢圓形,為均勻藍綠色熒光,染色質分布均勻(圖2-1A);冬凌草甲素處理后的細胞,部分細胞的細胞核縮小,染色質凝集呈顆粒團狀分布,有的核碎裂形成多個球形顆粒(圖2-1B箭頭所示)。經12.5 μmol.L-1冬凌草甲素處理后,MG-63細胞的凋亡率為12.6±1.6%,是對照組的3.8倍(凋亡率為3.3±0.8%),干預組與對照組相比差異顯著,具有統計學意義(P<0.05);用濃度分別為25 μmol.L-1和50 μmol.L-1的冬凌草甲素處理后,MG-63細胞的凋亡率分別是對照組的5.3倍和7.8倍,差異有顯著的統計學意義(P<0.01)(圖2-2及表2-1)。根據Hochest33258染色結果可以看出,冬凌草甲素有誘導MG-63細胞凋亡的作用,且隨著藥物濃度的增高,細胞的凋亡率也逐漸增高。
表1 冬凌草甲素對MG-63細胞凋亡率(%)影響(Hochest33258染色)()

表1 冬凌草甲素對MG-63細胞凋亡率(%)影響(Hochest33258染色)()
注:與對照組比較,* P<0.05;* *P<0.01
干預時間 對照組 12.5 μmol.L-125 μmol.L-150 μmol.L-148hr 3.3±0.8 12.6±1.6* 17.3±1.9* 26.0±2.5 **
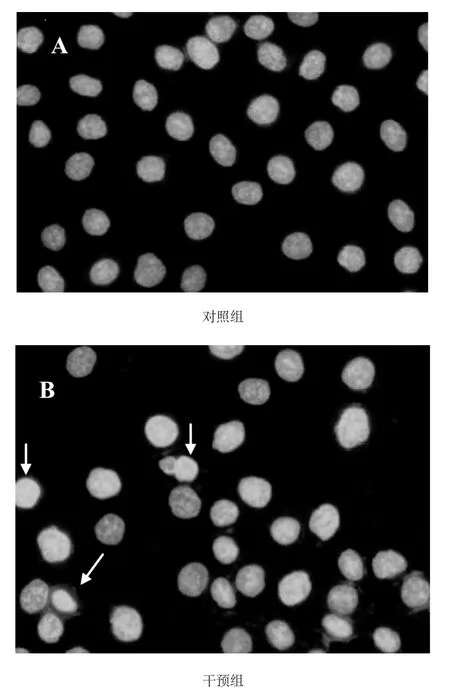
圖1 正常細胞和50 μmol.L-1冬凌草甲素干預后MG-63細胞Hochest33258染色結果(×400)
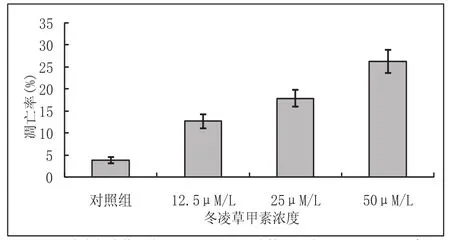
圖2 不同濃度冬凌草甲素處理后MG-63細胞的凋亡率:Hochest33258染色(3次獨立實驗結果)
2.2 Annexin V-FITC/PI雙標記法檢測MG-63細胞早期凋亡結果
流式細胞儀檢測MG-63細胞的早期凋亡率結果顯示,經不同濃度的冬凌草甲素(0,12.5,25,50 μmol.L-1)干預48小時后,MG-63細胞的早期凋亡率分別為3.94%±0.92%,13.242%±2.32%,18.87%±3.19%和25.33%±3.86%,即隨著藥物濃度的增加,MG-63細胞的早期凋亡率也逐漸增加,且差異明顯(P<0.05);在相同的藥物濃度下,對照組24小時的早期凋亡率為3.65%±0.82%,12.5 μmol.L-1組為8.25%±2.54%,25 μmol.L-1組為10.72%±2.98%,50 μmol.L-1組為14.12%±3.63%。可見在相同的藥物濃度下,24小時 MG-63細胞的早期凋亡率明顯低于48小時,尤其是25 μmol.L-1組與50 μmol.L-1組,差異非常顯著(P<0.01)(表1及圖1,圖2),由此可見冬凌草甲素誘導的MG-63細胞早期凋亡呈時間和濃度依賴性。
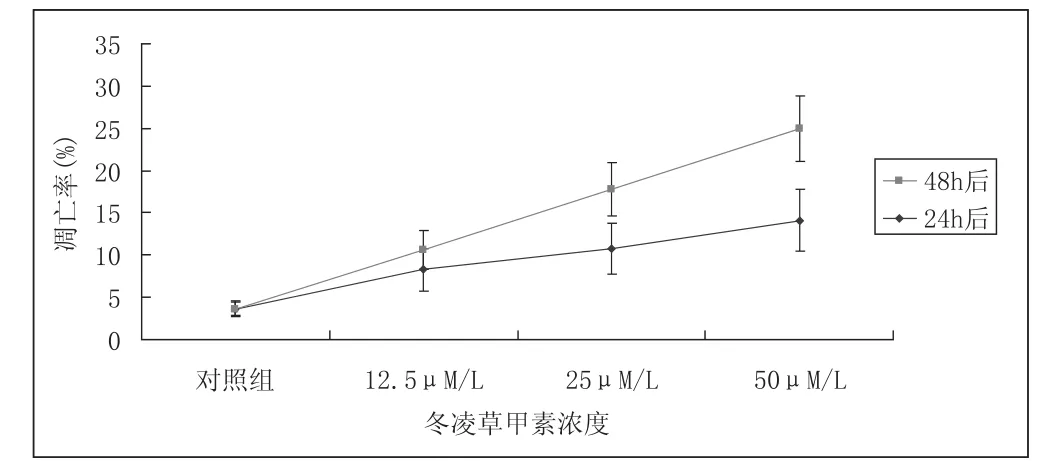
圖3 不同濃度冬凌草甲素處理后MG-63細胞的早期凋亡率:Annexin V-FITC/PI染色
冬凌草甲素分別干預24 hr和48 hr后,隨著藥物濃度的提高,MG-63細胞的早期凋亡率逐步增加;在相同濃度的藥物干預下,MG-63細胞48 hr的早期凋亡率明顯高于24 hr,即MG-63細胞的早期凋亡率表現出對冬凌草甲素的濃度與時間的依賴性。
表2 冬凌草甲素對MG-63細胞早期凋亡率(%)影響(Annexin V-FITC/PI染色)()

表2 冬凌草甲素對MG-63細胞早期凋亡率(%)影響(Annexin V-FITC/PI染色)()
注:在同一時間內,與對照組比較,* P<0.05;* *P<0.01 ;在同一濃度內,48 hr 的細胞凋亡率與24hr 的比較,▲P<0.05
干預時間 對照組 12.5 μmol.L-125 μmol.L-150 μmol.L-124hr 3.65±0.82 8.25±2.54 10.72±2.98 * 14.12±3.63 * 48hr 3.94±0.92 13.242±2.32 * 18.87±3.19*▲25.33±3.86 **▲
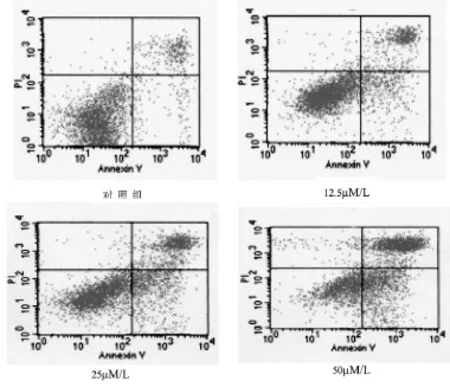
圖4 Annexin V-FITC/PI染色檢測48小時后冬凌草甲素對MG-63細胞早期凋亡率的影響
四格中右下格代表膜完整的凋亡細胞數,右上格代表晚期凋亡細胞和壞死細胞數,左下格代表正常活細胞數,左上格代表消化、收集過程中出現的損傷細胞數。與對照組相比,隨著冬凌草甲素濃度增加,MG-63細胞早期凋亡細胞數、晚期凋亡細胞和壞死的細胞數逐漸增多。
2.3 Western印跡檢測Caspase-8蛋白表達的結果
從Western印跡可以看出(見圖5),對照組與12.5 μmol.L-1冬凌草甲素處理組的Caspase-8蛋白表達較微弱,但無裂解激活;從25 μmol.L-1濃度開始到50 μmol.L-1濃度,Caspase-8表達逐步上調,并且出現裂解激活片段。上述結果提示,冬凌草甲素可以濃度依賴性方式使Caspase-8表達上調和裂解激活,冬凌草甲素誘導的MG-63細胞凋亡涉及到Caspase信號轉導途徑。
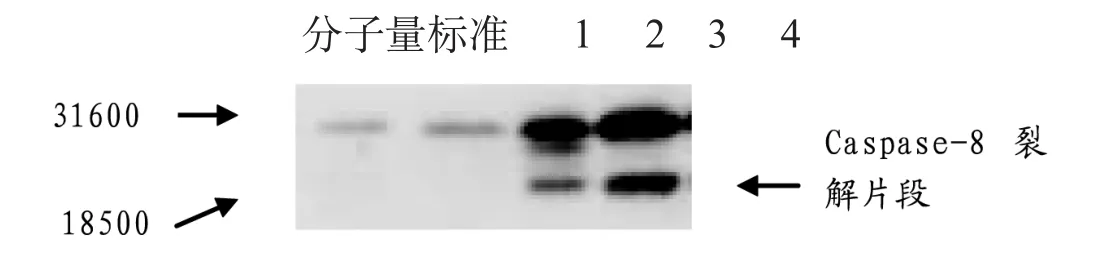
圖5 冬凌草甲素誘導MG-63細胞凋亡伴Caspase-8蛋白表達上調及裂解激活的Western印跡結果
1-4泳道分別代表0、12.5 μmol.L-1、25 μmol.L-1和50 μmol.L-1的冬凌草甲素濃度組。
3 討論
為了解冬凌草甲素對MG-63細胞是否具有凋亡誘導作用,作者通過對藥物作用后的MG-63細胞進行Hochest33258染色分析和流式細胞儀分析,以證明凋亡現象的發生。將膜聯蛋白V(Annexin V)與碘化丙啶(Propidine iodide, PI)匹配使用,可以把凋亡早晚期的細胞和已經死亡的細胞區分開來:正常細胞Annexin V-FITC和PI染色均為陰性,早期凋亡階段的細胞Annexin V-FITC陽性而PI陰性,晚期凋亡階段和已經死亡的細胞Annexin V-FITC和PI染色均為陽性[7~9]。本實驗用不同濃度的冬凌草甲素干預MG-63細胞,經Annexin V-FITC和PI染色,用流式細胞儀檢測其凋亡率。結果發現經不同濃度的冬凌草甲素干預不同時間后,隨著藥物濃度的升高和干預時間的延長,細胞早期凋亡率逐漸增加;冬凌草甲素對MG-63細胞早期凋亡的誘導呈時間和濃度依賴性。為進一步研究冬凌草甲素凋亡誘導效應,作者同時用Hochest33258染色方法對MG-63細胞晚期凋亡進行檢測。結果顯示,冬凌草甲素處理后的細胞,部分細胞的細胞核縮小,染色質凝集呈顆粒團狀分布,有的核碎裂形成多個球形顆粒,與對照組相比差異顯著(P<0.05)。實驗證明冬凌草甲素有誘導MG-63細胞凋亡的作用。由此可見,Annexin V-FITC和PI染色以及Hochest33258染色分析兩種實驗方法均有力證明冬凌草甲素可誘導MG-63細胞凋亡,其誘導細胞凋亡的作用呈劑量和時間依賴性。
死亡信號轉導途徑在凋亡的激活過程中具有重要作用,該途徑又可分為內源性和外源性兩條途徑:內源性死亡信號轉導途徑是由誘導凋亡的物質作用于死亡途徑的受體,下傳信號,激活Caspases;外源性死亡信號轉導途徑是由誘導凋亡的物質直接作用于線粒體,釋放細胞色素C,激活Caspases。Caspases裂解激活后,最終作用是將DNA降解為180-200bp及其整數倍的片段,故Caspases在凋亡過程中處于中心地位。Caspase-8是凋亡的啟動子,能夠通過寡聚而自身切割活化,并能激活下游Caspases,產生凋亡效應,其表達和裂解激活是反應凋亡啟動和發生的分子標志。
本實驗中,作者用靈敏度很高的Western印跡分析了Caspase-8裂解激活情況。結果清楚的顯示,12.5 μmol.L-1的冬凌草甲素組即可上調Caspase-8蛋白表達,25 μmol.L-1的冬凌草甲素組開始出現裂解激活,隨著冬凌草甲素濃度的增加,Caspase-8的裂解激活也越明顯,呈現明顯的藥物濃度依賴性活化。以上證據清楚的表明,冬凌草甲素在誘導MG-63細胞凋亡的同時可伴有Caspase-8的表達上調和裂解激活,并呈藥物濃度依賴性;冬凌草甲素誘導MG-63細胞凋亡的機制涉及到Caspase-8活化的信號轉導途徑。
本研究通過凋亡形態學和分子生物學等不同角度證實了冬凌草甲素對MG-63細胞具有顯著的凋亡誘導效應,并呈濃度依賴性,提示冬凌草甲素通過誘導MG-63細胞凋亡而具有抗骨肉瘤效應,這為冬凌草甲素用于骨肉瘤的治療提供了有用的實驗依據。
[1] Ikezoe T, Chen S, Heber D, et al. Baicalin is a major component of PC SPES which inhibits the proliferation of human cancer cells via apoptosis and cell cycle arrest[J]. Prostate, 2001, 49: 285.
[2] Hsieh TC, Wijeratne EK, Liang JY, et al. Differential control of growth, cell cycle progression, and expression of NF kappaB in human breast cancer cells MCF 7, MCF 10A, and MDA MB 231 by ponicidin and oridonin, diterpenoids from the chinese herb Rabdosia rubescens[J]. Biochem Biophys Res Commun, 2005, 337(1): 224.
[3] Zhang JF, Liu JJ, Liu PQ, et al. Oridonin inhibits cell growth by induction of apoptosis on human hepatocellular carcinoma BEL 7402 cells[J]. Hepatol Res, 2006, 35: 104.
[4] Leung CH, Grill SP, Lam W, et al. Novel mechanism of inhibi?tion of nuclear factor kappa B DNA binding activity by diterpenoids isolated from Isodon rubescens[J]. Mol Pharmacol, 2005, 68: 286.
[5] Ikezoe T, Yang Y, Bandobashi K, et al. Oridonin, a diterpenoid purifed from Rabdosia rubescens, inhibits the prolif?eration of cells from lymphoid malignancies in association with blockade of the NF kappa B signal pathways[J]. Mol Cancer Ther, 2005, 4(4): 578.
[6] 曲佳,郭坤元,昊秉毅,等.冬凌草甲素誘導人多發性骨髓瘤ARH-77細胞凋亡及其可能機制[J].中國腫瘤生物治療雜志, 2010,17(2):134.
[7] 段國慶,李書忠.凋亡抑制蛋白Survivin在骨肉瘤中的表達及其與PTEN cyclinD1蛋白表達的關系 [J].中國矯形外科雜志, 2007,3(15): 217.
[8] 聶濤,戴閩,宗世璋.Survivin在骨肉瘤中的表達及其與血管內皮生長因子的相關性研究[J].中國矯形外科雜志, 2005, 13 (9): 683.
[9] Trieb K, Lehner R, Stulnig T, et al. Survivin expression in human osteocarcoma is a marker for survival [J]. Eur J Surg Oncol, 2003, 29(4):379.
(責任編輯:陳思敏)
Apoptosis-inducing effect of Oridonin on Osteosarcoma MG-63 cells
TANG Xin-qiao1, ZHU Bao-yu1, WANG Wan-chun2// (1. Orthopedics, Xiangtan Central Hospital, Xiangtan 411100, Hunan; 2. Orthopedics, the Second Xiangya Hospital of Central South University, Changsha 410011, Hunan)
Objective:To investigate the effect of oridonin on the apoptosis of osteosarcoma MG-63 cells.Method:After MG-63 cells were incubated with different concentrations of Oridonin, the morphologic character of apoptosis was evaluated by Hochest33258 staining. The percentage of earlier apoptosis cell was analyzed by flow cytometry. The molecular character of apoptosis was analyzed by Western blot detecting Caspase-8 expression.Result:Hochest33258 staining and fow cytometry detection powerfully testifed that Oridonin could induce the apoptosis of MG-63 cells in a concentration-dependent way. The apoptosis of MG-63 cells induced by Oridonin was found to be companied with up-regulation and cleavage of Caspase-8.Conclusion:Oridonin can induce the apoptosis of MG-63 cells with a concentration-dependent manner.
Oridonin;osteosarcoma MG-63 cells;apoptosis;molecular mechanism
R 285.5
A
1674-926X(2014)04-006-04
1.湘潭市中心醫院骨科,湖南 湘潭 411100;2.中南大學湘雅二醫院骨科,湖南 長沙 410011
唐新橋(1965-),男,湖南邵陽人,漢族,博士,主任醫師,主要從事骨科創傷、腫瘤的醫療與研究 Email:Zhubaoyu101@163.com
2013-11-20

