草莓中甲型肝炎病毒檢測
高世光,王海燕,郭 慧,馮華煒,于 洋,麻麗丹,*
(1.丹東出入境檢驗檢疫局,遼寧 丹東 118000;2.大窯灣出入境檢驗檢疫局,遼寧 大連 116600)
草莓中甲型肝炎病毒檢測
高世光1,王海燕2,郭 慧1,馮華煒1,于 洋1,麻麗丹1,*
(1.丹東出入境檢驗檢疫局,遼寧 丹東 118000;2.大窯灣出入境檢驗檢疫局,遼寧 大連 116600)
目的:建立草莓中甲型肝炎病毒(hapatitis A virus,HAV)的有效富集方法及病毒RNA提取方法,用于草莓中HAV檢測。方法:利用甲肝減毒疫苗對已知陰性的草莓樣品進行人工污染,通過有效富集條件的優化及RNA提取后,采用實時熒光逆轉錄-聚合酶鏈式反應進行檢測。結果:病毒富集選擇Tris-甘氨酸-1 g/100 mL牛肉浸提物緩沖液洗脫、果膠酶30 U、氯仿-正丁醇為抑制劑去除劑、聚乙二醇沉淀、5 ℃孵育1 h等優化條件,檢測靈敏度較高;最優RNA提取方法為美國ABI公司生產的RNA提取試劑盒。采用優化后的方法對草莓樣品中HAV病毒的檢測顯示,該病毒粒子的檢測靈敏度可以達31.36 CCID50/20 g樣品。同時對50 份送檢樣品進行檢測,結果均為陰性。結論:所建立的病毒富集方法和核酸提取方法更適合草莓樣品中HAV的檢測,靈敏度較高。
草莓;甲型肝炎病毒;病毒富集;RNA提取
食源性病毒感染是人類患病毒性疾病的重要原因[1-2],甲型肝炎病毒(hapatitis A virus,HAV)屬微小RNA病毒科,HAV屬,是一種常見的食源性病毒疾病。該病毒經糞-口途徑傳播,引起人肝腫大、肝功能受損以及黃疸等癥狀[3]。容易發生HAV感染的食物為生的、未煮熟的肉或海鮮(如貝類等)、方便食品以及水果和蔬菜等缺少熱處理的食品[4-11]。無論是發展中國家還是發達國家,每年都會發生因感染HAV引起的急性胃腸炎和甲肝的爆發流行,其中食源性感染占很大比例。加拿大、美國、澳大利亞、芬蘭、瑞典都曾發生過因食用草莓或木莓而引起的HAV爆發流行。感染的場所主要有老人院[12-13]、醫院、游船、學校、餐館和一些宴席上[14]。
農作物在生產、加工和包裝等過程中,由于施肥、灌溉等生產環節易污染HAV以及攜帶有HAV操作人員的二次污染等皆可以造成該產品污染HAV[15]。然而,由于缺乏有效的檢測方法以及病毒在食品樣品中分布不均勻性、病毒含量低等特性使得HAV引起的食源性病毒感染很少能被檢測到[16]。由于HAV細胞培養周期長,實驗極為繁瑣[17],故而實時熒光逆轉錄-聚合酶鏈式反應(reverse transcription polymerase chain reaction,RTPCR)方法成為臨床、食物和環境樣品中HAV檢測的金標準。食品中HAV的檢測比臨床樣品中HAV的檢測更困難,原因為食品樣品中病毒含量很低以及存在PCR檢測抑制物質[18-19]。目前國內外對于食品中HAV的檢測研究大部分針對的是貝類樣品,對小漿果類樣品報道很少,小漿果如草莓樣品,由于其特殊的基質特性,必須采用有效的病毒富集和處理方法,才能高效提取樣品中低濃度的病毒,因此本研究針對草莓樣品中HAV檢測的關鍵步驟進行了優化,包括草莓樣品中病毒洗脫的最佳緩沖液、果膠酶的最適添加量、聚乙二醇(polyethylene glycol,PEG)沉淀病毒的最佳條件、RNA最佳提取方法和最佳PCR抑制劑去除劑等,以建立草莓中HAV的有效富集方法及病毒RNA提取方法,用于草莓中HAV檢測。
1 材料與方法
1.1 材料、試劑與儀器
草莓樣品來自出遼寧省丹東出入境檢驗檢疫局出口樣品以及丹東各大草莓種植基地監測樣品。
Tris、甘氨酸 美國Sigma公司;三氯三氟乙烷天津市科密歐化學試劑有限公司;牛肉浸出粉 北京路橋科技有限公司;PEG8000 中國Biosharp公司;氯仿 北京化工廠;果膠酶(30U/g) 國藥集團化學試劑有限公司;正丁醇 賽默飛世爾科技(中國)有限公司;MagMAX?-96 Viral RNA Isolation Kit(貨號:AM1836)、AgPath-IDTMOne-step RT-PCR Kit(貨號:AM1005) 美國應用生物系統公司;QIAamp Viral RNA Mini Kit(貨號:74104) 德國凱杰生物技術公司;TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0(貨號:DV819A) 寶生物工程(大連)有限公司;HAV減毒疫苗(滴定度為106.5CCID50/mL,陽性對照) 長春長生生物科技股份有限公司。
表1中所用的引物參照ISO/TS 15216—2[20]中的引物,由Invitrogen公司合成。
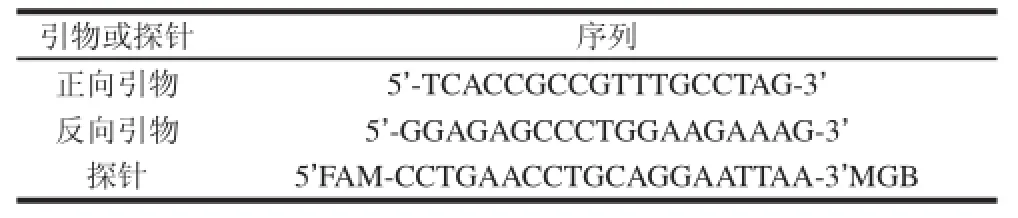
表1 HAV實時熒光RT-PCR檢測的引物及探針Table 1 Primers and probes for RT-PCR amplification of HAV
3-18K臺式高速冷凍離心機 德國Sigma公司;7300實時熒光定量PCR系統、MagMax Express核酸提取儀 美國ABI公司;SK-1快速混勻器 江蘇省金壇市榮華儀器制造有限公司。
1.2 方法
1.2.1 人工污染樣品的制備
剪取20 g已知HAV陰性的草莓樣品(未完全解凍或冷藏樣品[21])表皮放至離心管中,然后加入10 μL的甲肝減毒疫苗,生物安全柜中室溫靜置20 min,使得病毒與草莓樣品充分吸附。
1.2.2 草莓樣品中病毒富集方法的優化
1.2.2.1 草莓樣品中HAV洗脫緩沖液的優化
本研究共對4 種不同的緩沖液進行評估,包括:1)蒸餾水;2)牛肉浸提物(Tris glycine 1g/100mL beef extract,TGBE)(0.1 mol/L Tris-0.05 mol/L甘氨酸-1 g/100 mL牛肉浸出粉,pH 9.5)[20];3)0.1 mol/L甘氨酸-0.3 mol/L NaCl(pH 9.5)[22];4)3 g/100 mL牛肉浸提物(pH 9.5)[4]。
按照1.2.1節的方法制備樣品,分別加入35 mL上述4 種洗脫緩沖液及30 U的果膠酶,混勻,不要強烈振蕩避免草莓樣品中果汁和糖分大量溶出[23]。同時以已知陰性的草莓樣品作為陰性對照。室溫100 r/min孵育10 min后,用1 mol/L NaOH溶液調節至9.5,室溫100 r/min孵育20 min;10 000×g,4 ℃離心30 min,將上清液轉入干凈的離心管中,并用1 mol/L鹽酸溶液將pH值調節至7.0±0.2;加入0.25體積的5×PEG-NaCl溶液,振蕩60 s混勻,5 ℃、100 r/min 孵育60 min;5℃、10 000×g離心30 min,棄去上清液,然后5 ℃、10 000×g離心5 min ,以壓實沉淀物;棄上清液,加入500 μL PBS重懸沉淀;加入1 000 μL的氯仿-正丁醇,渦旋混合,然后在室溫條件下孵育5 min;5 ℃、10 000×g離心15 min,將上層水相小心地轉移到一個新的離心管中,保留用于提取RNA。
用ABI公司的MagMax Express核酸提取儀提取RNA,采用ABI OneStep RT-PCR kit進行RT-PCR擴增,共做兩個平行。
采用優化后的緩沖液分別對10 份添加HAV減毒疫苗的草莓樣品進行實驗,通過其陽性檢出率來評價緩沖液的穩定性。
1.2.2.2 果膠酶添加量的優化
按照1.2.2.1節方法進行優化實驗,其中果膠酶的添加量分別為0、10、20、30、40、50 U,共做兩個平行。
1.2.2.3 PEG沉淀劑的優化
按照1.2.2.1節方法進行優實驗,對PEG(50 g/ 100 mL PEG8000,1.5 mol/L NaCl溶液)的優化包括兩個方面:PEG沉淀劑作用時間和作用溫度。采用優化后的洗脫緩沖液進行病毒洗脫,加入PEG沉淀劑后分別采取5 ℃孵育1 h、5 ℃孵育4 h、5 ℃孵育18 h、室溫孵育1 h、室溫孵育4 h、室溫孵育18 h等條件進行孵育。
1.2.2.4 抑制劑去除劑的優化
按照1.2.2.1節方法進行優實驗,采用抑制劑去除劑包括:氯仿-正丁醇(1∶1)和三氯三氟乙烷。以不加抑制劑去除劑的樣品作為對照,研究抑制劑去除劑對HAV檢測的影響。
1.2.3 病毒RNA提取方法比較
病毒RNA的提取分別為:1)美國應用生物系統公司的RNA提取試劑盒;2)QIAamp Viral RNA Mini Kit;3)TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0。按照其說明書進行RNA的提取,提取完畢的病毒RNA于-20 ℃保存備用。
1.2.4 實時熒光RT-PCR反應體系和反應參數
反應體系:總體積25 μL,包括模板RNA溶液5 μL,25×RT-PCR酶預混液1 μL,2×RT-PCR緩沖液12.5 μL,正向引物1.25 μL、反向引物2.25 μL、熒光探針0.625 μL,滅菌超純水6.375 μL;其中各引物和探針的濃度均為10 ?mol/L;以上各組分加入至0.2 mL實時熒光PCR反應管中,混勻,5 000 r/min離心10 s。
反應參數為:45 ℃反轉10 min;95 ℃預變性10 min;40 個循環擴增(95 ℃、15 s,60 ℃、45 s)。
每次循環的退火時收集熒光,檢測結束后,根據擴增曲線和Ct值判定結果。
結果判斷:Ct值≥40,可判斷樣品中HAV核酸檢測陰性;Ct值≤35,可判斷該樣品中HAV核酸檢測陽性;35<Ct值<40,建議重做樣本。重做結果Ct值≥40者為陰性,否則為陽性。
1.2.5 草莓樣品中HAV靈敏度的測定
將提取的HAV病毒RNA樣品分別按1∶10進行梯度系列稀釋(100、10-1、10-2、10-3、10-4、10-5)后,按照1.2.4節的反應體系和參數進行多次RT-PCR反應,確定本方法的靈敏度。
1.2.6 樣品檢測
按照上述建立的快速檢測體系,對送檢的50 份草莓進行前處理,提取和純化病毒核酸,設立陽性和陰性對照,參照1.2.4節進行實時熒光RT-PCR檢測,以檢驗本實驗方法的效果。
1.2.7 數據分析
所有的統計分析的完成均采用SPSS進行分析,差異顯著為P<0.05。
2 結果與分析
2.1 草莓樣品中HAV富集方法的優化
2.1.1 洗脫緩沖液優化
采用上述4 種緩沖液洗滌草莓表皮試樣時,試樣中大量的果汁會溶出,整個試樣液的體積明顯增加,果汁中的酸性物質會使得溶液的pH值下降,10 min孵育后,TGBE緩沖液(pH 9.5)維持pH值的能力最強(pH 8.8左右),3 g/100 mL牛肉浸提物(pH 9.5)和0.1 mol/L甘氨酸-0.3 mol/L NaCl (pH 9.5)次之(pH 8.0左右),蒸餾水則維持pH值在4.0左右。因此TGBE緩沖液更容易將病毒粒子與樣品分開。
4 種洗脫緩沖液對人工污染HAV疫苗的草莓樣品進行病毒洗脫測試結果(圖1)表明:4 種洗脫緩沖液按照PCR后Ct值的大小,順序為:TGBE緩沖液(25.43)<3 g/100 mL牛肉浸提物(26.22) <0.1 mol/L甘氨酸-0.3 mol/L NaCl(30.24)<蒸餾水(31.56)(P<0.05)。

圖1 病毒洗脫緩沖液對草莓樣品病毒富集的影響Fig.1 Effect of elution buffers on HAV enrichment
4 種洗脫緩沖液對10 份草莓樣品的檢測結果顯示(圖2),TGBE緩沖液的陽性檢出率為100%,3g/100mL牛肉浸提物和甘氨酸緩沖液的陽性檢出率為90%,而蒸餾水的陽性檢出率為70%。表明TGBE緩沖液對草莓樣品中HAV的緩沖效果最穩定。

圖2 4 種洗脫緩沖液對草莓樣品種HAV的陽性檢出率的影響Fig.2 Effect of four elution buffers on HAV positive detection rate in strawberry
2.1.2 果膠酶添加量優化結果
果膠酶的加入有效消化雜質以減少PCR抑制劑,對果膠酶添加量的實驗結果(圖3)表明,果膠酶添加量為0 U時,Ct值最高,為35.36。隨著果膠酶添加量的增加,Ct值越來越低,30 U時效果最佳,為24.75。果膠酶添加量在40 U和50 U時,Ct值(25.15和25.64)反而升高,其原因可能為剩余果膠酶形成的基質會增加PCR抑制劑的存在,并且添加量過多造成浪費,因此,草莓樣品中病毒富集的果膠酶最佳添加量為30 U。

圖3 果膠酶添加量對病毒富集的影響Fig.3 Effect of pectinase dosage on HAV enrichment
2.1.3 PEG沉淀劑優化結果
PEG是具有很強吸水性及凝聚和沉淀蛋白作用的高分子聚合物,是食品中病毒濃縮的有效方法[24]。本研究對PEG沉淀劑的作用時間和作用溫度的結果(圖4)表明,PEG 5 ℃孵育1 h,5 ℃孵育4 h和5 ℃孵育18 h沒有差別,而室溫孵育與5℃孵育相比較孵育效果較差,其中順序為室溫孵育4 h>室溫孵育1 h>室溫孵育過夜。綜合以上結果,PEG沉淀時間選取1 h,有利于降低整個檢測時限,故最佳PEG沉淀時間和溫度為5 ℃孵育1 h。

圖4 PEG孵育時間和溫度對草莓樣品中HAV病毒富集的影響Fig.4 Effect of incubation time and temperature in the presence ofPEG on the enrichment of HAV in strawberry
2.1.4 抑制劑去除劑優化結果

圖5 PCR抑制劑去除劑對草莓樣品中HAV富集的影響Fig.5 Effect of different PCR inhibitor removers on the enrichment of HAV in strawberry
采用氯仿-正丁醇(1∶1)和三氯三氟乙烷兩種抑制劑去除劑對病毒富集效果進行實驗,圖5表明:氯仿-正丁醇的Ct值大于三氯三氟乙烷,但統計學分析沒有顯著差異。而根據環保要求,氯仿-正丁醇優于三氯三氟乙烷。采用氯仿-正丁醇和三氯三氟乙烷兩種抑制劑去除劑對病毒富集效果進行實驗,表2表明:10 份草莓樣品(同一批次)中添加抑制劑去除劑后HAV的陽性檢出率為100%,而不添加抑制劑去除劑的HAV陽性檢出率為70%。由此可見,添加抑制劑去除劑能提高檢測靈敏度。

表2 草莓樣品中使用和不使用抑制劑去除劑時對HAV檢測陽性率的影響Table 2 Effect of PCR inhibitor removers on the positive detection rate of HAV
2.2 RNA提取方法比較結果
采用美國應用生物系統公司的RNA提取試劑盒、QIAamp Viral RNA Mini Kit和TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0三種試劑盒對人工接種草莓樣品中的HAV(稀釋10-1)病毒進行RNA提取的結果如圖6所示。

圖6 不同RNA提取方法的比較Fig.6 Comparison of different RNA extraction methods
由圖6可知,3 種方法提取RNA效果為美國應用生物系統公司的RNA提取試劑盒(ABI)> QIAamp Viral RNA Mini Kit(Qiagen)>TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0(TaKaRa),但是三者之間沒有差異(P>0.1),沒有統計學意義。
而在RNA提取過程中,3 種方法各有優缺點,TaKaRa的試劑盒在操作過程中較為繁瑣,提取時間長;Qiagen的提取方法與之相比較為簡化,但是二者提取RNA所需要的病毒懸液較多(均大于200 μL),所需時間也長(40 min左右),而且反復開蓋容易引起污染。而ABI RNA提取試劑盒建立在全自動儀器設備配套的基礎上,只需將所需提取試劑加入,封閉狀態自動提取,避免了操作過程中的污染,提取RNA所需的病毒懸液只需50 μL,而且完成整個操作僅需要20 min左右。因此,本實驗選取的最優方法為ABI RNA提取試劑盒。
2.3 靈敏度實驗結果
HAV病毒RNA梯度稀釋檢測結果(圖7)表明,在稀釋度為10-3時,Ct值≤35(結果為陽性),且重復性和穩定性良好,稀釋度分別為10-4~10-5無典型擴增曲線,Ct值≥40(結果為陰性),表明本研究對于草莓樣品中HAV的檢測靈敏度為31.36 CCID50/20 g。

圖7 草莓樣品中HAV檢測靈敏度Fig.7 Sensitivity of RT-PCR for the detection of HAV
2.4 樣品檢測結果
按照優化的最佳條件,以添加HAV減毒疫苗的樣品為過程控制,進行病毒RNA提取,對送檢的50 份樣品進行檢測,結果見圖8。由檢測結果可以知道,所檢樣品均為陰性,陽性和陰性對照正常。結果證明本研究所建立的方法適用于草莓樣品中HAV的檢測。

圖8 50 份草莓樣品中HAV的檢測結果Fig.8 Amplification curves of 50 strawberry samples using RT-PCR
3 討 論
本實驗對HAV病毒在草莓樣品中病毒富集步驟和RNA提取方法進行優化。病毒富集是本檢測方法的關鍵步驟,PEG沉淀作為一種快速和溫和的方法用于濃縮病毒,它能夠在中性pH值和不含其他化學物質的高離子濃度的溶液中進行作用[25],饒紅[18]、莫雪梅[21]等采用PEG過夜孵育以濃縮病毒,進行HAV病毒的檢測。本研究對PEG8000孵育時間和孵育溫度對HAV病毒富集影響進行了研究,結果發現1 h孵育與過夜孵育具有同等的效果。優化后的方法較領域內普遍使用的方法而言,極大地縮短了檢測時間,整個檢測過程僅用時5~6 h。檢測方法的靈敏度可達到31.36 CCID50/20 g,檢測方法的特異性為100%。
莫雪梅等[21]對來自廣州市的45 份草莓樣品進行檢測,結果顯示,45 份中有3 份呈陽性,檢出率為6.67%。但是,本實驗對50 份草莓樣品進行檢測,結果均為陰性,這種檢出率差異可能是由于地區差異和產業規范程度不同造成的。本實驗樣品均來自丹東地區,該地區氣候條件良好,降雨量多,很大程度上避免了因灌溉引起的HAV污染問題。此外,該地區草莓種植管理較為規范,并且部分企業已獲得歐盟認可,這也是造成本實驗草莓樣品HAV陽性檢測率低的重要原因。
目前,國內尚未有草莓中HAV的標準檢測方法,鑒于HAV在食源性疾病中的重要性,評價和優化食品中HAV的檢測方法具有重要意義。本研究中優化的HAV檢測的操作步驟可用于HAV相關的疾病爆發性檢測。該方法對于食源性疾病的調查和食品的監測極其重要,下一個研究方向為其他重要食品基質中特別是小漿果中病毒洗脫和濃縮等操作條件的優化。
[1] MULLENDORE J L, SOBSEY M D, SHIEH Y C. Improved method for the recovery of hepatitis A virus from oysters[J]. Journal of Virological Methods, 2001, 94(1/2): 25-35.
[2] MYRMEL M, RIMSTAD E, WASTESON Y. Immunomagnetic separation of a Norwalk-like virus (genogroup Ⅰ) in artificially contaminated environmental water samples[J]. International Journal of Food Microbiology, 2000, 62(1/2): 17-26.
[3] 陳廣全, 張慧媛, 曾靜. 食品安全檢測培訓教材微生物檢測[M]. 北京: 中國標準出版社, 2010: 480-481.
[4] KIM H Y, KWAK I S, HWANG I G, et al. Optimization of methods for detecting norovirus on various fruit[J]. Journal of Virological Methods, 2008, 153(2): 104-110.
[5] BOSCH A, SANCHEZ G, LE G F, et al. Human enteric viruses in Coquina clams associated with a large hepatitis A outbreak[J]. Water Science and Technology, 2001, 43(12): 61-65.
[6] DANIELS N A, BERGMIRE-SWEAT D A, SCHWAB K J, et al. A foodborne outbreak of gastroenteritis associated with Norwalklike viruses: first molecular traceback to sandwiches contaminated during preparation[J]. Journal of Infectious Diseases, 2000, 181(4): 1467-1470.
[7] GUEVREMONT E, BRASSARD J, HOUDE A, et al. Development of an extraction and concentration procedure and comparison of RT-PCR primer systems for the detection of hepatitis A virus and norovirus GII in green onions[J]. Journal of Virological Methods, 2006, 134(1/2): 130-135.
[8] HUTIN Y J, POOL V, CRAMER E H, et al. A multistate foodborne outbreak of hepatitis A[J]. The New England Journal of Medicine, 1999, 340: 595-602.
[9] le GUYADER F, DUBOIS E, MENARD D, et al. Detection ofhepatitis A virus, rotavirus, and enterovirus on naturally contaminated shellfish and sediment by reverse transcription-seminested PCR[J]. Applied and Environment Microbiology, 1994, 60(10): 3665-3671.
[10] POTASMAN I, PAZ A, ODEH M. Infectious outbreaks associated with bivalve shellfish consumption: a worldwide perspective[J]. Clinical Infectious Diseases, 2002, 35(8): 921-928.
[11] ROSENBLUM L S, MIRKIN I R, ALLEN D T, et al. A multifocal outbreak of hepatitis A traced to commercially distributed lettuce[J]. American Journal of Public Health, 1990, 80(9): 1075-1080.
[12] CALDERON-MARGALIT R S, HALPERIN R T, ORR N, et al. A largescale gastroenteritis outbreak associated with Norovirus in nursing homes[J]. Epidemiology and Infection, 2005, 133(1): 35-40.
[13] PARASHAR U D, DOW L, FRANKHAUSER R, et al. An outbreak of viral gastroenteritis associated with consumption of sandwiches: implications for the control of transmission by food handlers[J]. Epidemiology and Infection, 1998, 121(3): 615-621.
[14] RUTJES S A, LODDER-VERSCHOOR F, van der POEL W H, et al. Detection of noroviruses in foods: a study on virus extraction procedures in foods implicated in outbreaks of human gastroenteritis[J]. Journal of Food Protect, 2006, 69(8): 1949-1956.
[15] BAERT L, UYTTENDAELE M, STALS A, et al. Reported foodborne outbreaks due to noroviruses in Belgium: the link between food and patient investigations in an international context[J]. Epidemiology and Infection, 2009, 137(3): 316-325.
[16] CLIVER D O. Detection and control of food borne viruses[J]. Trends in Food Science and Technology, 1995, 6(11): 353-358.
[17] 陳廣全, 饒紅, 傅浦博, 等. 食品中諾沃克樣病毒和甲肝病毒檢測方法研究進展[J]. 檢驗檢疫科學, 2005, 15(6): 51-54.
[18] 饒紅, 陳廣全, 馮騫, 等. 蔬菜及水果中NLVs和甲肝檢測的研究[J].中國食品衛生雜志, 2007, 19(2): 131-134.
[19] 張其剛, 潘文良, 李想, 等. 豬胃黏蛋白偶聯磁珠和聚乙二醇富集檢測青蔥和葡萄中諾如病毒的比較研究[J]. 食品科學, 2012, 33(16): 241-245.
[20] International Organization for Standards. ISO/TS 15216—2 Microbiology of food and animal feed—Horizontal method for determination of hepatitis A virus and norovirus in food using realtime RT-PCR—Part 2: Method for qualitative detection[S]. Geneva: International Organization for Standardization, 2013.
[21] 莫雪梅, 高東微. 運用SYBRGreen熒光實時RT-PCR法檢測草莓中HAV[J]. 食品科學, 2010, 31(14): 153-157.
[22] 標準化管理委員會. GB/T 22287—2008 貝類中HAV檢測方法: 普通RT-PCR方法和實時熒光RT-PCR方法[S]. 北京: 中國標準出版社, 2008.
[23] 周陽, 欒軍, 蔣魯言, 等. 實時熒光RT-PCR檢測冷凍草莓中諾如病毒[J]. 食品安全質量檢測學報, 2013, 4(2): 515-520.
[24] 周曉紅. 食品中諾如病毒RT-PCR檢測技術研究進展[J]. 國外醫學:衛生學分冊, 2009, 36(4): 234-237.
[25] LEWIS G D, METCALF T G. Polyethylene glycol precipitation for recovery of pathogenic viruses including hepatitis A virus and human rotavirus, from oyster, water and sediment samples[J]. Applied and Environment Microbiology, 1988, 54(8): 1983-1988.
An Optimized Method for the Detection of Hapatitis A Virus (HAV) in Strawberry
GAO Shi-guang1, WANG Hai-yan2, GUO Hui1, FENG Hua-wei1, YU Yang1, MA Li-dan1,*
(1. Dandong Entry-Exit Inspection and Quarantine Bureau, Dandong 118000, China; 2. Dayaowan Entry-Exit Inspection and Quarantine Bureau, Dalian 116600, China)
Objective: To establish the optimal enrichment and RNA extraction procedures for detecting hepatitis A virus (HAV) in strawberries. Methods: After artificial contamination of known negative samples, HAV enrichment under optimized conditions and RNA extraction were performed for analysis by real-time fluorescence PCR. Results: The virus was enriched by elution with Tris glycine 1 g/100 mL beef extract buffer (TGBE), removal of the inhibitors using 30 U of pectinase and a mixture of chloroform with n-butanol, precipitation with PEG, and 1 h incubation at 5 ℃. The detection method was sensitive. The best RNA extraction results were achieved with a RNA extraction kit from ABI. The sensitivity of the optimized method for detecting HAV particles was 31.36 CCID50/20 g of sample. Negative results were reported for all 50 samples tested. Conclusion: The established method is suitable for the detection of HAV in strawberry samples with high sensitivity.
strawberry; hepatitis A virus; virus enrichment; RNA extraction
R373.2;TS207.5
A
1002-6630(2014)24-0213-06
10.7506/spkx1002-6630-201424041
2014-07-29
國家質檢總局科研項目(2014IK094);遼寧出入境檢驗檢疫局科研項目(LK2013-18)
高世光(1981—),男,工程師,學士,主要從事病原微生物研究。E-mail:ddciq99@sohu.com
*通信作者:麻麗丹(1976—),女,高級工程師,碩士,主要從事病原微生物研究。E-mail:2212097@163.com

