植物乳桿菌β-D-葡萄糖苷酶的定位及活性研究
張 哲,樊明濤,*,董 梅,李愛霞,劉延琳
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.西北農林科技大學葡萄酒學院,陜西 楊凌 712100)
植物乳桿菌β-D-葡萄糖苷酶的定位及活性研究
張 哲1,樊明濤1,*,董 梅1,李愛霞1,劉延琳2
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.西北農林科技大學葡萄酒學院,陜西 楊凌 712100)
以對硝基苯基β-D-葡萄糖苷為底物,通過比色法從5 株植物乳桿菌中篩選出2 株有較高β-D-葡萄糖苷酶酶活力的菌株,并利用 差速離心分級沉淀對其β-D-葡萄糖苷酶進行定位。根據對植物乳桿菌的生長狀況的分析,測定其在不同生長條件下β-D-葡萄糖苷酶的酶活力。結果表明:目的菌株體內的β-D-葡萄糖苷酶為胞內酶,屬于細胞膜結合酶;該酶在對數生長末期(培養至12 h)酶活力最高,最適產酶培養基為改良MRS培養基;以完整細胞為參照對象,植物乳桿菌520、XJ-25菌株所產的β-D-葡萄糖苷酶均受纖維二糖及熊果苷的誘導,熊果苷的誘導作用較強。
植物乳桿菌;β-D-葡萄糖苷酶;定位;酶活力
β-D-葡萄糖苷酶(β-Glucosidase,EC 3.2.1.21)是催化水解烴基或芳香基與糖基之間的糖苷鍵生成芳香物質和葡萄糖的一種水解酶[1-2],主要存在于細菌、真菌和植物中,不同來源的酶在分子大小及催化特性等方面存在較大差異[3]。在葡萄和葡萄酒中除了游離的揮發性風味物質外還有大量的以β-D-葡萄糖苷形式存在的非揮發性風味前體物質[4]。β-D-葡萄糖苷酶能將其水解為具有濃郁天然風味的香氣物質[5],另外,還可與其他風味酶協同作用釋放出揮發性糖苷配基,起到增香作用[6]。因此,開發β-D-葡萄糖苷酶作為水果風味增香酶在葡萄酒釀造中具有重要意義。
由于植物來源的β-D-葡萄糖苷酶含量低,成本高,目前的很多研究集中于黑曲霉、酵母菌、乳酸菌等微生物中β-D-葡萄糖苷酶[7-9]。國內對黑曲霉中β-D-葡萄糖苷酶研究較多,但其存在食品安全隱患,在食品加工中受到限制[10]。而與酵母菌相比,乳酸菌是在酒精發酵結束后接種于葡萄酒中[11],其生長環境比酒精發酵的葡萄醪環境穩定,因此不易在酶的作用下生成不利于葡萄酒質量的副產物。作為下一代蘋果酸乳酸發酵的發酵劑,植物乳桿菌有潛在啟動蘋果酸乳酸發酵的能力[12]。與常被用于蘋果酸乳酸發酵的酒酒球菌相比,植物乳桿菌含有更高的β-D-葡萄糖苷酶和酚酸脫羧酶,對于葡萄酒增香應用具有廣闊的前景[13]。此外,有關研究[14-15]表明該酶的存在形式分胞內、胞外兩種。存在形式不同,其分離提取的手段也各不相同。胞外酶容易提取,利用離心方法即可獲得;而胞內酶則需通過破碎細胞來釋放酶,細胞破碎則成為酶分離提取的關鍵。因此,酶的定位研究是其分離純化的前提,為其后續分離純化方法和條件的選擇提供參考和依據。目前關于植物乳桿菌糖苷酶活性及定位的研究較少,本實驗對不同來源的5 株植物乳桿菌進行了酶活力測定及其定位分析,為該酶在食品行業中的應用奠定了基礎,也對該酶的分離純化及其結構性質研究提供重要理論依據。
1 材料與方法
1.1 菌株與培養基
1.1.1 供試菌株
植物乳桿菌520(由泡菜中分離)由本實驗室分離、鑒定并保存;植物乳桿菌CS-1、XJ-14、XJ-25、XJA-2(由葡萄酒中分離)由西北農林科技大學葡萄酒學院提供。
1.1.2 培養基與試劑
MRS培養基:葡萄糖20 g/L、酵母浸粉4 g/L、蛋白胨10 g/L、牛肉膏5 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、乙酸鈉5 g/L、磷酸氫二鉀2 g/L、檸檬酸銨 2 g/L、吐溫80 1 mL/L,用1 mol/L NaOH調pH值至6.2~6.4,121 ℃滅菌20 min。
改良MRS培養基:在MRS培養基的基礎上,不添 加磷酸氫二鈉,添加胰蛋白胨15 g/L代替蛋白胨10 g/L,用1 mol/L NaOH調pH值至4.8,121 ℃滅菌20 min。
ATB培養基:葡萄糖10 g/L、酵母浸粉5 g/L、蛋白胨10 g/L、Mg SO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、鹽酸半胱氨酸0.5 g/L、番茄汁250 mL/L,用1 mol/L NaOH調pH值至4.8,121 ℃滅菌20 min。
MRST培養基:葡萄糖10 g/L、果糖5 g/L、酵母浸粉5 g/L、蛋白胨10 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.05 g/L、鹽酸半胱氨酸0.5 g/L、吐溫-80 1 mL/L、番茄汁100 mL/L,用1 mol/L NaOH將pH值調至5.0,121 ℃滅菌20 min[14]。
對硝基苯基-β-葡萄糖苷 上海寶曼生物科技有限公司;溶菌酶 美國Sigma公司;葡萄糖、纖維二糖、熊果苷 美國Amersc公司;其他常用試劑均為國產分析純。
1.2 儀器與設備
DH-420A電熱恒溫培養箱、水浴鍋 北京科偉永興儀器有限公司;HC-3018R高速冷凍離心機 安徽中科中佳科學儀器有限公司;HS-840U型水平層流單人凈化工作臺 蘇州凈化設備有限公司;pH計 上海雷磁儀器廠;UV-1700 紫外-可見分光光度計 日本Shimadzu公司;VC-130 超聲波細胞破碎儀 美國Sonics & Materials公司。
1.3 方法
1.3.1 高酶活力菌株的篩選及β-D-葡萄糖苷酶的初步定位研究
初步定位研究方法參照文獻[16],并稍加改動。分別取1 mL培養至對數生長末期的菌液,4 ℃、5 000×g離心10 min,得菌液上清及沉淀,用150 mmol/L NaCl洗滌沉淀2 次,得完整細胞。將完整細胞懸浮于細胞緩沖液中,冰浴條件下130 W超聲破碎15 min(間隔2 s)得破碎液,破碎液經4 ℃、12 000×g離心10 min后,得破碎上清液及細胞碎片。將完整細胞及細胞碎片重 懸浮于1 mL蒸餾水中,進行酶活力測定,菌液上清、破碎液及破碎上清液直接進行酶活力測定。
酶活力測定方法:方法參照文獻[16],并有所改動。一定量酶液(調整酶液量以確保最終比色值在0.2~0.8)用蒸餾水稀釋到500 μL,然后和500 μL 2×檸檬酸磷酸緩沖液/對硝基苯-β-D-葡萄糖苷(終pH 5.0,底物濃度 5 mmol/L)混合,在37℃下水浴1 h后4 ℃、12 000×g離心10 min,將上清加入2 mL、1 mol/LNa2CO3終止反應,在400 nm波長下比色。對照組為用蒸餾水代替處理樣品。
酶活力的定義:在反應體系中,1 min內1 g干質量菌體催化生成1 μmol對硝基苯酚所需的酶量為1 個酶活力單位,表示為1 μmol/(g·min)。
1.3.2 植物乳桿菌的的生長特性及最適產酶培養基的選擇
將1.3.1節確定的高產酶植物乳桿菌分別以2%的接種量接入200 mL的MRS、改良MRS、ATB、MRST液體培養基中,37 ℃條件下靜置培養(屬于兼性厭氧培養),每隔2 h取樣測定其OD600nm值并繪制生長曲線。根據生長曲線,測定各菌株在不同培養基中對數末期的酶活力,篩選出最適產酶培養基。
1.3.3 菌體不同生長時期的酶活力分布
根據1.3.2節中的各菌株生長曲線,分別對其對數生長中期、對數生長末期、穩定期取樣,按照初步定位方法進行各部位酶活力測定。
1.3.4 不同碳源對β-D-葡萄糖苷酶酶活力的誘導
將篩選出的高酶活力植物乳桿菌分別在碳源為纖維二糖(10 g/L)、熊果苷(20 g/L)、葡萄糖(10 g/L)加熊果苷(10 g/L)、葡萄糖(10 g/L)加纖維二糖(5 g/L)的培養基中靜置培養至對數生長末期,測其酶活力。以葡萄糖(20 g/L)碳源為對照組。
1.3.5 β-D-葡萄糖苷酶的進一步定位研究
參照文獻[17]方法并稍加修改。取8 mL菌液,4 ℃、5 000×g離心10 min,然后用0.5 mol/L蘋果酸鈉緩沖液(pH 6.6)洗滌沉淀,4 ℃、5 000×g再次離心10 min,得完整細胞,并將其懸浮于8 mL、0.5 mol/L蘋果酸鈉緩沖液中(pH 6.6),然后加入溶菌酶(終質量濃度75 μg/mL),37 ℃水浴2 h,直到細胞壁完全破裂。破壁后4 ℃、7 000×g離心20 min,用0.5 mol/L蘋果酸鈉緩沖液(pH 6.6)洗滌沉淀,再次4 ℃、7 000×g離心20 min,得原生質體。兩次離心所得上清混合在 一起命名為上清液A。原生質體再懸浮于8 mL低滲溶液中(10 mmol/L 蘋果酸鈉緩沖液,pH 6.6)使其破裂,將裂解液在4 ℃、24 000×g下離心1.5 h,得細胞膜和可溶性酶;上清液A在4 ℃、24 000×g下離心1.5 h,得細胞壁碎片和細胞周質。對所得各組分進行酶活力測定,確定β-D-葡萄糖苷酶的存在位置。
2 結果與分析
2.1 β-D-葡萄糖苷酶的初步定位
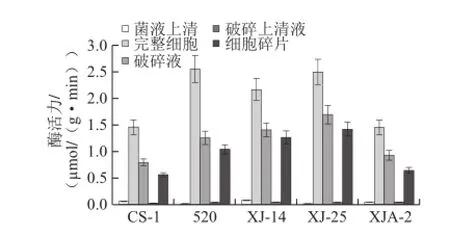
圖1 植物乳桿菌β-D-葡萄糖苷酶初步定位Fig.1 β-D--glucosidase activity of different fractions from five strains
由圖1可知,5 株植物乳桿菌均具有β-D-葡萄糖苷酶酶活力,其中植物乳桿菌520、XJ-25酶活力較高。此外,其不同部位酶活力顯示,完整細胞酶活力最高,破碎液與細胞碎片次之,而菌液上清及破碎上清液幾乎無酶活力。此與前人報道的β-D-葡萄糖苷酶主要存在于乳酸菌的完整細胞上,而菌液上清及破碎液上清液基本無酶活的結果一致[18],與一些研究者篩選出胞外及胞內β-D-葡萄糖苷酶的研究結果存在一定差異[14-15]。該結果也表明:β-D-葡萄糖苷酶屬于胞內酶,主要為不可溶性酶。
2.2 植物乳桿菌生長狀況

圖2 520菌株在不同培養基中的生長情況Fig.2 Growth curves of strain 520 in different media
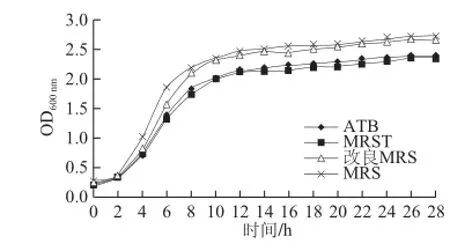
圖3 XJ-25菌株在不同培養基中的生長情況Fig.3 Growth curves of strain XJ-25 in different media
由圖2、3可知,植物乳桿菌520、XJ-25在不同的培養基上具有相同的生長趨勢,且不同培養基對其生長無顯著影響。菌株接種后0~2 h均為延滯期,菌體濃度基本保持不變,隨后進入對數生長期,接種12 h后進入穩定期。
2.3 產酶培養基的選擇
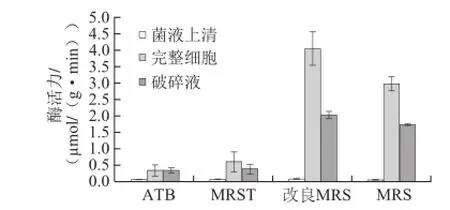
圖4 520菌株在不同培養基中的β-D-葡萄糖苷酶酶活力Fig.4 Determination of the highest activity of strain 520 in four media

圖5 XJ-25菌株在不同培養基中的β-D-葡萄糖苷酶酶活力Fig.5 Determination of the highest activity of strain XJ-25 in four media
圖4 、5顯示了植物乳桿菌520、XJ-25在4 種培養基中的酶活力情況,2 株菌株在不同培養基中均是完整細胞及破碎液酶活力較高,在改良MRS培養基中培養時,β-D-葡萄糖苷酶酶活力最高,在MRS培養基中次之,而適合酒酒球菌生長及產高酶活力的ATB、MRST培養基對植物乳桿菌并沒有展現出高酶活力的能力。
2.4 菌體在不同生長時期的酶活力分布
圖6、7顯示了菌株520、XJ-25的菌液上清、完整細胞和破碎液在對數生長中期(6 h)、對數生長末期(12 h)和穩定期(24 h)的β-D-葡萄糖苷酶活力。2 株菌的菌液上清及破碎上清液在3 個不同時期的酶活力都幾乎為零,這與細胞初步定位時的一致,而完整細胞、破碎液和細胞碎片酶活力均隨著生長時期的變化而呈現先增后降的趨勢。由此可知,2 株菌株均在對數生長末期具有最高β-D-葡萄糖苷酶酶活力。

圖6 520菌株不同生長時期的β-D-葡萄糖苷酶酶活力Fig.6 Effects of growth phages on β-D--glucosidase activity of strain 520

圖7 XJ-25菌株不同生長時期的β-D-葡萄糖苷酶酶活力Fig.7 Effects of growth phages on β-D--glucosidase activity of strain XJ-25
2.5 不同碳源對β-D-葡萄糖苷酶酶活力的誘導
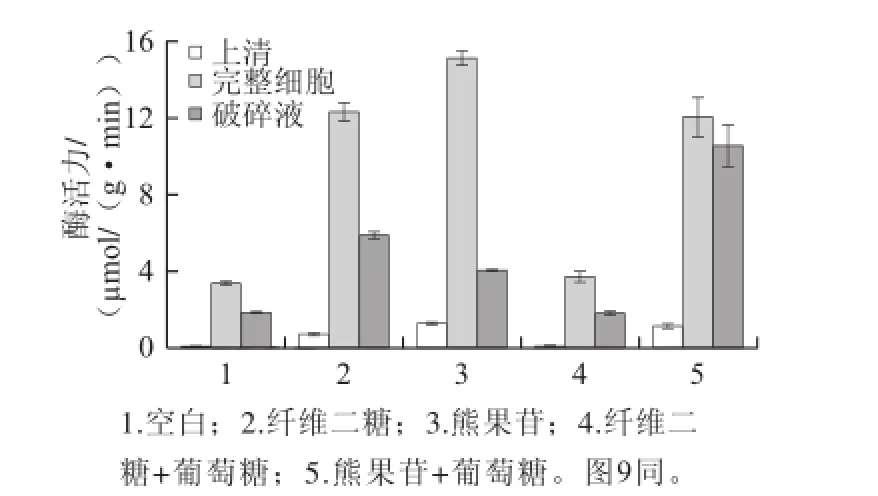
圖8 不同碳源對5200菌株β-D-葡萄糖苷酶酶活的誘導Fig.8 Induction of β-D--glucosidase activity of strain 520 by different carbon sources

圖9 不同碳源對XJ-255菌株β-D-葡萄糖苷酶酶活力的誘導Fig.9 Induction of β-D--glucosidase activity of strain XJ-25 by different carbon sources
由圖8、9可知,在有熊果苷作為碳源時上清液具有一定的酶活力,且顯著高于其他實驗組的酶活力,此原因可能是培養基中的熊果苷分解產生對羥基苯酚和葡萄糖,而對羥基苯酚在堿性條件下顯黃色,影響了酶活力的測定[19];對于完整細胞及細胞破碎液來說,在有纖維二糖或熊果苷作為碳源時的酶活力顯著高于以葡萄糖作為碳源時的酶活力,且在有熊果苷作為碳源時的酶活力要高于有纖維二糖作為碳源時的酶活力,這說明2 株菌株的酶活力在含有糖苷鍵碳源的誘導下會有不同程度的提高。
2.6 β-D-葡萄糖苷酶的進一步定位
由2.1節的初步定位研究(圖1)可知,本實驗所采用的5 株植物乳桿菌均具有β-D-葡萄糖苷酶酶活力,且該酶屬于胞內不可溶性酶。為了對該酶進行深入的了解,探尋其在細胞內的確切存在位置,故對其進行了進一步的定位研究,其結果如圖10、11所示。細胞壁β-D-葡萄糖苷酶活力很低,幾乎為零,細胞壁和細胞膜之間的周質腔內有一定的酶活力,且其酶活力幾乎等于上清A的酶活力,說明上清A的酶活力主要來自于周質腔內的酶活力;原 生質體也具有酶活力,原生質體裂解、離心后得到的上清(可溶酶)和沉淀(細胞膜)中都有酶活力,且沉淀的酶活力遠遠高于上清中的酶活力,說明原生質體內的β-D-葡萄糖苷酶主要為不可溶性酶,多存在于原生質體的細胞膜中,為膜結合酶。
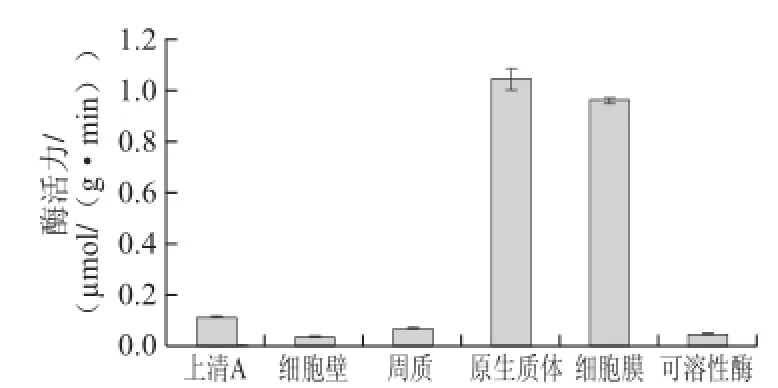
圖10 5200菌株β-D-葡萄糖苷酶細胞定位Fig.10 Cellular localization of β-D--glucosidase from strain 520
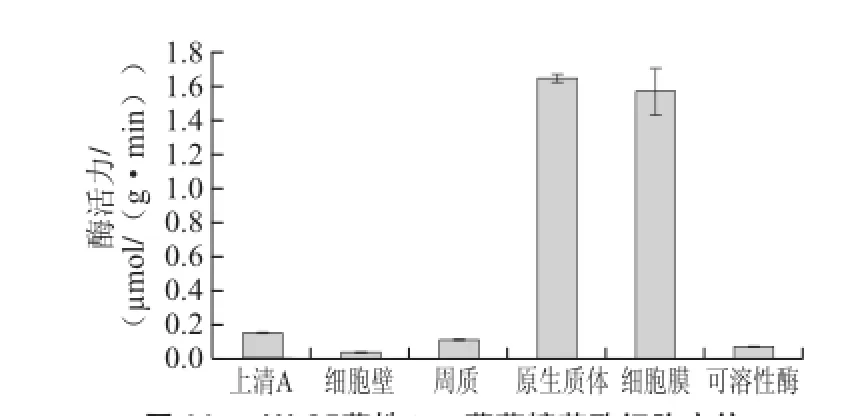
圖11 XJ-255菌株β-D-葡萄糖苷酶細胞定位Fig.11 Cellular localization of β-D--glucosidase from strain XJ-25
3 討論與結論
目前所發現的β-D-葡萄糖苷酶中有兩種:膜結合酶和非膜結合酶。因兩者之間的性質差異極大,其分離提取的方法也各不相同。本實驗結合國外的先進技術,采用差速離心分級沉淀對植物乳桿菌中的β-D-葡萄糖苷酶進行定位,結果表明其β-D-葡萄糖苷酶主要為胞內不可溶性酶,存在于細胞膜上,屬于膜結合酶。膜結合酶因其不可溶、難提取等特點很少被用于分離純化的研究中,但研究膜結合酶十分必要。分離純化制得酶液或酶制劑應用于實踐,不僅工序繁瑣而且價格昂貴不適合工業的大批生產,而具有高膜結合酶活性的菌株可直接被投入生產應用,對葡萄酒的釀造具有重要意義。
作為一種食品安全菌種,不同來源的2 株植物乳桿菌在4 種培養基中均能良好生長且無顯著差異,生長趨勢一致,說明培養基的成分差異對其生長幾乎無影響,但不同培養基下的酶活力差異, 則表明培養環境對產酶及酶活力有較大影響。2 株高酶活力菌株能否在葡萄酒苛刻條件(高酒精含量、低pH值、高糖及高SO2含量)下展現出高酶活力成為了目前探討的問題[12]。
本實驗從5 株植物乳桿菌中篩選出2 株高產β-D-葡萄糖苷酶菌株并對其進行定位及活性分析,結果表明該酶主要為胞內不可溶性酶,屬于細胞膜結合酶,且其在對數生長末期酶活力最高,最適培養基為改良MRS培養基。此外,不同碳源下的誘導結果顯示,該酶為組成型酶,但在纖維二糖和熊果苷的誘導下酶活力有不同程度的提高。
[1] 李華, 高麗. β-葡萄糖苷酶活性測定方法的研究進展[J]. 食品與生物技術學報, 2007, 26(2): 107-112.
[2] 謝宇, 尚曉嫻, 胡金剛. β-葡萄糖苷酶純化及酶學性質研究[J]. 江西農業大學學報, 2008, 30(3): 521-524.
[3] 鄭芳, 曹小芳, 張亞玲, 等. 一株β-葡萄糖苷酶產生菌株的分離鑒定及酶學性質研究[J]. 微生物學通報, 2012, 39(8): 1059-1068.
[4] 孟憲文, 李長彪, 劉長江, 等. 乳酸菌β-葡萄糖苷酶的分離純化及特性研究[J]. 食品科學, 2006, 27(11): 116-119.
[5] 楊芮, 呂珍, 文彥, 等. 酒類酒球菌中β-葡萄糖苷酶性質研究[J]. 食品科學, 2013, 34(4): 1-10.
[6] 陳靜, 郝偉偉, 王春梅, 等. 產β-葡萄糖苷酶真菌的篩選鑒定、純化及酶學性質分析[J]. 食品科學, 2013, 34(5): 191-196.
[7] GONZALEZ-POMBO P, FARINA L, CARRAU F, et al. A novel extracellular β-glucosidase from Issatchenkia terricola: isolation, immobilization and application for aroma enhancement of white Muscat wine[J]. Process Biochemistry, 2011, 46: 385-389.
[8] BAFFI M A, TOBAL T, LAGO J H G, et al. A novel β-Glucosidase from Sporidiobolus pararoseus: characterization and application in winemaking[J]. Journal of Food Science, 2011, 76(7): C997-C1002.
[9] CAPALDO A, WALKER M E, EORD C M, et al. β-Glucoside metabolism in Oenococcus oeni: cloning and characterization of the phospho-β-glucosidase CelD[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 69: 27-34.
[10] 謝爽. β-葡萄糖苷酶在食品增香中的應用[J]. 中外食品, 2004(12): 44-45.
[11] 李華. 葡萄酒工藝學[M]. 北京: 科學出版社, 2007.
[12] TOIT M D, ENGELBRECHT L, LERM E, et al. Lactobacillus: the next generation of malolactic fermentation starter cultures: an overview[J]. Food Bioprocess Technology, 2011, 4(6): 876-906.
[13] LERM E, ENGELBRECHT L, TOIT M D. Selection and characterisation of Oenococcus oeni and Lactobacillus plantarum south african wine isolates for use as malolactic fermentation starter cultures[J]. South African Journal of Enology and Viticulture, 2011, 32(2): 280-295.
[14] MICHLMAYR H, SCHUMANN C, BARREIRA BRAZ DA SLIVA N M, et al. Isolation and basic characterization of a β-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J]. Journal of Applied Microbiology, 2010, 108(2): 550-559.
[15] 萬振堂, 楊麗杰. 產胞外β-葡萄糖苷酶乳酸菌的篩選及其酶學性質的初步研究[J]. 食品與發酵工業, 2009, 35(4): 28-32.
[16] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of β-gl ucosidase activity in selected wild strains of Oenococcus oeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34(3): 292-296.
[17] de CORT S, SHANTHA KUMARA H M C, VERACHTER H. Localization and characterization of α-glucasidase activity in lactobacillus-brevis[J]. Applied and Environmental Microbiology, 1994, 60(9): 3074-3078.
[18] PEREZ-MARTI′N F, SESENA S, IZQUIERDO P M, et al. Screening for glycosidase activities of lactic acid bacteria as a biotechnological tool in oenology[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1423-1432.
[19] 李亞輝, 董梅, 崔禾苗, 等. 酒酒球菌SD-2a的β-D-葡萄糖苷酶活性研究[J]. 食品科技, 2013, 38(8): 48-52.
Localization and Activity of β-D-Glucosidase from Lactobacillus plantarum
ZHANG Zhe1, FAN Ming-tao1,*, DONG Mei1, LI Ai-xia1, LIU Yan-lin2
(1. College of Food Scienc e and Engineering, Northwest A&F University, Yangling 712100, China; 2. College of Enology, Northwest A&F University, Yangling 712100, China)
In this study, two strains of Lactobacillus plantarum (L. plantarum) with the highest β-D-glucosidase activity were obtained from five L. plantarum strains with p-nitro-phenyl-β-D-glucopyranoside as the substrate and their cellular localization of β-D-glucosidase was studied by using fractional precipitation with differential centrifugation. In addition, the enzymatic act ivity of β-D-glucosidase was determined under different growth conditions, followed by analyzing the growth of L. plantarum. Our results supported the conclusion that β-D-glucosidase was membrane-associated and might be insoluble. The highest activity was displayed at the late exponential phase and an improved MRS was verified as the optimal medium. For whole cells, β-D-glucosidase was induced by cellobiose and arbutin, but arbutin played more important role in the enzymatic activity.
Lactobacillus plantarum; β-D-glucosidase; cellular localization; enzymatic activity
TS261.1
A
1002-6630(2014)15-0161-05
10.7506/spkx1002-6630-201415033
2013-09-29
國家現代農業(葡萄)產業技術體系建設專項(nycytx-30-ch-03)
張哲(1990—),女,碩士研究生,研究方向為食品生物技術。E-mail:871805936@qq.com
*通信作者:樊明濤(1963—),男,教授,博士,研究方向為食品生物技術。E-mail:fanmt@nwsuaf.edu.cn

