拮抗羅非魚養殖水體中海豚鏈球菌功能性微生物的篩選
瞿建宏,陳 輝,吳 偉,*
(1.中國水產科學研究院 淡水漁業研究中心/中國水產科學研究院內陸漁業生態環境與資源重點開放實驗室,江蘇 無錫 214081;2.南京農業大學 無錫漁業學院,江蘇 無錫 214081)
羅非魚原產于非洲,因具有生長快、個體大、病害少、肉質營養豐富等特點,廣受世界各國消費者和養殖業者的青睞,已成為世界性養殖的經濟水產動物,被FAO列為人類六大主食品之一[1]。近幾年來,隨著羅非魚養殖規模的不斷擴大,養殖密度不斷提高,羅非魚病害時有發生,其中鏈球菌病是羅非魚主要的病害之一。據研究,養殖生態環境的惡化,特別是養殖水體中氨氮、亞硝酸鹽含量的增加,是羅非魚鏈球菌病爆發的誘因。不良生境不僅可直接危害養殖魚類,使魚體的免疫力下降,增加了細菌的易感性,而且也為病原菌的增殖和傳播提供了有利條件[2]。因此,從環境控制角度,尋求一種既能優化養殖水體環境又可抑制病原菌爆發性生長的有效方法顯得意義重大。
傳統的魚病防治方法是使用藥物防治,抗生素等化學藥物的使用一方面帶來了顯著的防治效果,但同時也會因使用不當造成病原菌的耐藥性增強、藥物殘留等問題。既破壞了生態平衡,又造成了水產品質量安全問題,而以微生態制劑為主的生物防治方法,避免了抗生素等化學藥物帶來的潛在危害,滿足了環境友好型水產養殖的要求,日益受到養殖業者的高度關注。在水產養殖中,微生態制劑不僅可以作為添加劑添加于飼料,還可以直接添加于水體中[3],起到凈化養殖水質、優化養殖水域生態結構、抑制水體中病原菌的生長、提高養殖生物的免疫力,使養殖活動良性循環發展。目前已有乳桿菌(Lactobacillussp.)、芽孢桿菌(Bacillussp.)、假單胞菌(Pseudomonassp.)等微生態制劑被應用于水產養殖的病害防治中,但針對某種特定的魚類和病原體的微生態制劑的研究幾乎未見報導。本文試圖從自羅非魚養殖水體中分離得到的具有凈化水質功能的微生物菌株中篩選出對羅非魚鏈球菌病原——海豚鏈球菌具拮抗功能的菌株,并從生長優勢、共凝集、凈化水質的能力等方面進一步篩選得到最適的拮抗菌株,以期為羅非魚鏈球菌病的生態防控提供有效方法和適宜菌株,為羅非魚的健康養殖提供技術支撐。
1 材料與方法
1.1 試驗材料
芽孢桿菌(Bacillussp.)、乳桿菌(Lactobacillussp.)、假單胞菌(Pseudomonassp.)、假絲酵母(Candidasp.)、諾卡氏菌(Nocardiasp.)等由中國水產科學院淡水漁業研究中心環境保護研究室分離鑒定并提供;海豚鏈球菌(Streptococcus iniae)由廣西壯族自治區水產科學研究院保存并提供。
1.2 試劑及儀器
試劑:蛋白酶K(≥250 μg/mg)、胰蛋白酶(≥2 500 μg/mg)、Tris-Hcl緩沖液、革蘭氏染液,由上海生工生物工程有限公司生產;硫酸銨、氯化銨、硝酸鈉、亞硝酸鈉、氯化鈉、磷酸氫二鉀、磷酸二氫鉀、碘化鉀、氫氧化鉀、硫酸鎂、碳酸鈣、硫酸鋅、硫酸鐵、酒石酸鉀鈉、二氯化汞、4-氨基苯磺酰胺、N-(1-萘基)-乙二胺二鹽酸鹽,均為分析純,由國藥集團化學試劑有限公司生產;丙酮、乙醇、乙酸乙酯、氯仿、乙醚、正丁醇、石油醚,均為分析純,由上海聯試化工試劑有限公司生產;BS培養基、MRS培養基、PDA培養基、BHI培養基,由北京陸橋生物技術有限公司生產。
儀器:0.02 mm游標卡尺、PHS-3TC PH酸度計、Eppendorf移液槍、AL 204電子分析天平、Sigma 2-16K臺式高速冷凍離心機、Agilent 7530型紫外分光光度計、Nikon 90i光學顯微鏡、ELx808酶標儀、SANYO MIR-153型高低溫恒溫培養箱、ZHWY200B恒溫振蕩搖床、TOMY Autoclave SS-325型全自動高壓滅菌器、ZHJH-1214雙面氣流式無菌工作臺、一次性細菌微孔濾膜器(膜孔徑為0.22 μm),一次性滅菌注射器(2 mL、5 mL),打孔器等。
培養基:芽胞肝菌、假單胞肝菌采用BS培養基;乳桿菌采用MRS培養基;假絲酵母、諾卡氏菌采用PDA培養基;海豚鏈球菌采用BHI培養基。
1.3 試驗方法
1.3.1 菌株的活化和純化 在紫外無菌操作臺從 4℃冷藏保存的菌種斜面上取一環菌苔,接種于 50 mL滅菌的液體培養基中,于28℃恒溫振蕩培養24 h,取菌液在含固體培養基的平板上劃線,置平板于恒溫28℃培養箱內培養48 h。從平板上挑取單菌落,進行革蘭氏染色鏡檢,合格后將單菌落接種于滅菌的斜面固體培養基上,經培養后于4℃冰箱保存備用。
1.3.2 拮抗海豚鏈球菌的功能微生物篩選 參照Tramer等[4]的抑菌圈方法進行。采用BHI液體培養基培養海豚鏈球菌,28℃培養24 h,吸取0.1 mL培養液于無菌平皿中,待經115℃滅菌的BHI固體培養基冷卻至40℃左右后,倒入平板,與菌液混勻后放置于無菌室約1 h,取出并倒置放于4℃冰箱中1 h。用打孔法(用直徑0.40 cm打孔器在平板表面均勻打孔,然后按照每孔15 μL的加樣量加入經過濾除菌的待測菌株培養液)將待測菌株的過濾除菌濾液引入平板,每一個處理3個重復,28℃培養24 h,用游標卡尺測量抑菌圈大小,計算平均抑菌圈直徑。
1.3.3 拮抗海豚鏈球菌的功能微生物的復篩
1.3.3.1 菌株生長曲線的測定 參照Niall等[5]的方法進行。待測菌株培養20 h后用0.85%的無菌生理鹽水調至菌濃度約為107 cfu/mL,取10 μL菌液分別加入含250 μL液體培養基的酶標板各孔中,每個樣品做3個平行,以10 μL無菌生理鹽水代替菌液為對照。將96孔板置28 ℃培養箱中培養,每隔30 min用酶標儀測定各孔OD630值,連續測定24 h。根據OD630值繪制生長曲線,然后選取生長曲線上最陡的8個點做生長曲線擬合度直線,直線斜率即為最大生長率(μ),直線在X軸上的截距為延滯期(λ),生長曲線穩定期切線在Y軸上的截距為最大生物量(A)。根據公式t=ln2/μ求得倍增時間(t),根據公式RI=1/(λ×td)求得各菌株的生長系數(RI)。
1.3.3.2 共凝集試驗 參照Chabrillon等[6]方法并稍作修改進行。于肉湯液體培養基中接種海豚鏈球菌和上述初篩的拮抗菌株,28℃過夜培養,測定其OD630值,并將其OD630值稀釋至0.5,然后各取海豚鏈球菌和拮抗菌株1.5 mL于無菌具塞試管中,渦旋振蕩混勻,28℃靜置培養4 h后測定OD630值。3.0 mL純培養的海豚鏈球菌和拮抗菌株28℃靜置培養4 h作為對照管。共凝集率=[(SC+LC)/2-(S+L)/(SC+LC)/2]×100;式中:SC和LC分別表示對照管海豚鏈球菌和拮抗菌株的終OD630值,S+L表示試驗管終OD630值。
1.3.3.3 不同菌株對水體中兩種形式無機氮的利用 取羅非魚養殖水體,經 121℃滅菌后備用。在上述養殖水體中加入經抽濾除菌的NH4Cl和NaNO2溶液,使水中NH4+-N的濃度為1.0 mg/L、3.5 mg/L和7.0 mg/L;NO2--N的濃度為0.15 mg/L、0.50 mg/L和1.00 mg/L。以養殖水體(初始濃度NH4+-N為0.34 mg/L,NO2--N為0.08 mg/L)為對照,加入經培養24 h后的海豚鏈球菌菌液,使各組水體中初始菌濃度為1.0×106cfu/mL,于28℃下恒溫培養24 h,分析在不同氨氮、亞硝酸鹽濃度下海豚鏈球菌的生長情況。同時,在NH4+-N濃度為7.0 mg/L或NO2--N濃度為1.00 mg/L 、pH值為7.0的滅菌養殖水體中加入所篩選的拮抗功能菌株,初始菌濃度為1.0×106cfu/mL,于28℃下恒溫培養,48 h后取樣,測定水樣中的NH4+-N和NO2--N濃度。試驗方法參照吳偉等[7]的方法并稍作修改,NH4+-N和NO2--N分別采用納氏試劑法、重氮-偶氮分光光度法[8]。試驗設3個平行。
1.4 數據分析
試驗數據采用SAS軟件進行差異顯著性檢驗,顯著度水平α為0.05。
2 結果與分析
2.1 菌種的活化培養和純化
將從羅非魚養殖水體中分離所得的具凈水功能的微生物菌株進行活化和純化,獲純菌株57株,分別標記為:B0901~B0918(芽孢桿菌))、L0901~L0920(乳桿菌)、C0901~C0910(假絲酵母)、N0901~N0906(諾卡氏菌)、P0901~P0903(假單胞菌)。
2.2 拮抗海豚鏈球菌的功能微生物篩選
采用打孔法對從水中分離的具有凈化水質功能的微生物菌株進行篩選,共篩選出11株對海豚鏈球菌具有拮抗作用的菌株,其中B0903、B0910、B0916(芽孢桿菌)、L0914、L0917(乳桿菌)、C0909(假絲酵母)、N0906(諾卡氏菌)7株菌株的拮抗效果比較明顯,結果見圖1、2。
圖1 采用打孔法測定菌株拮抗作用的結果
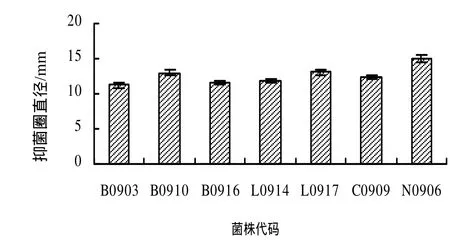
圖2 拮抗功能菌株對海豚鏈球菌的抑制作用
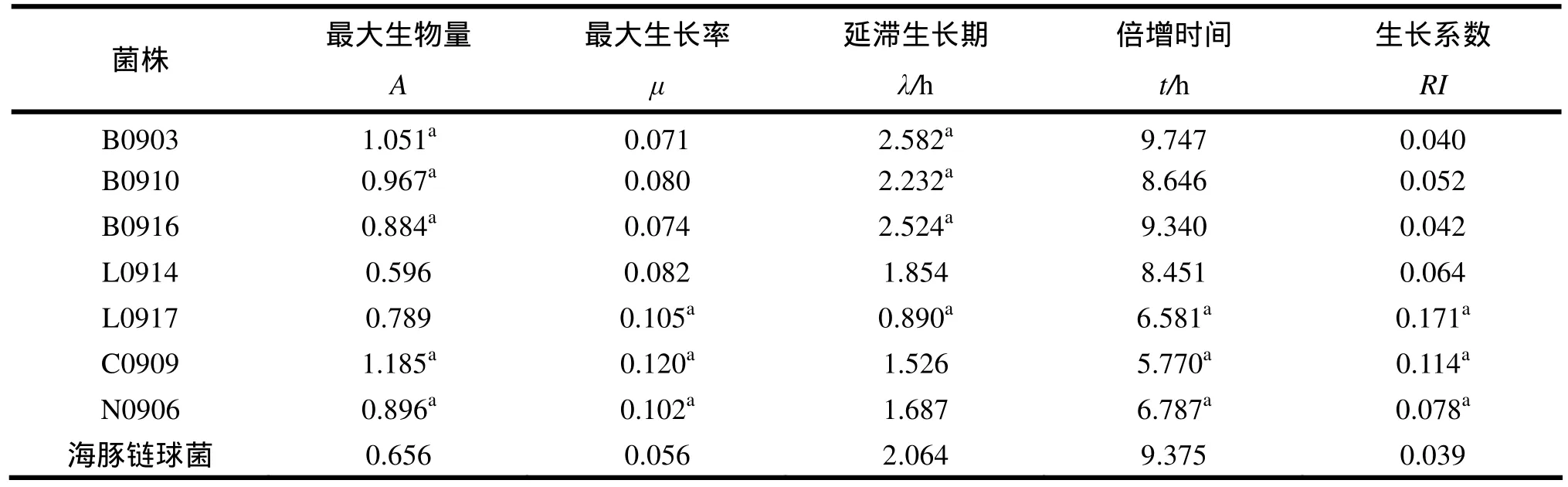
表1 拮抗菌株與海豚鏈球菌的生長曲線的參數(a: P<0.05 )
2.3 拮抗海豚鏈球菌的功能微生物的復篩
2.3.1 生長曲線的測定 對所篩的7株具拮抗功能的菌株和海豚鏈球菌進行了生長曲線的測定,從中推導得出了相關的生長參數,具體見表1。由表1可知,7株菌株中除L0914外,其余的最大生長量均高于海豚鏈球菌;7株菌株的最大生長率、生長系數均高于海豚鏈球菌;B0903、B0910、B0916的延滯生長期時間顯著長于海豚鏈球菌(P<0.05),L0917的延滯生長期顯著短于海豚鏈球菌(P<0.05);除B0903倍增時間長于海豚鏈球菌外,其余 6株均短于海豚鏈球菌的倍增時間,其中L0917、C0909、N0906的倍增時間顯著短于海豚鏈球菌的倍增時間(P<0.05)。生長系數較大且具有短的延滯生長期和短的倍增時間的菌株具有生長優勢,由此可知L0917、C0909 、N0906具有生長優勢,且C0909的生長優勢最強。
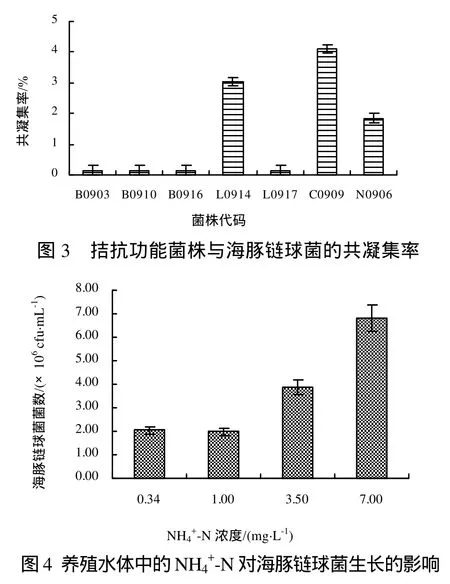
2.3.2 共凝集實驗 7株拮抗菌株與海豚鏈球菌的共凝集效果如圖 3所示。只有 L0914、C0909、N0906能與海豚鏈球菌產生共凝集作用,共凝集率分別為3.03%、4.11%、1.85%。
2.3.3 不同菌株對水體中兩種形式的無機氮的利用
2.3.3.1 海豚鏈球菌對水體中兩種形式無機氮的利用 研究結果(圖4和圖5)顯示,NH4+-N、NO2--N濃度對海豚鏈球菌的生長有一定的影響。NH4+-N濃度為7.0 mg/L的試驗組中海豚鏈球菌的菌量顯著高于對照組(P<0.05),NH4+-N濃度為1.0 mg/L的試驗組與對照組相比無顯著差異(P>0.05),表明一定量的NH4+-N可以為海豚鏈球菌提供氮源,促進其生長和繁殖;NO2--N濃度為0.50 mg/L、0.15 mg/L的試驗組與對照組無顯著差異(P>0.05),NO2--N濃度為1.00 mg/L的試驗組與對照組相比差異顯著(P<0.05),表明過高的NO2--N可對細胞產生較強的毒性作用而引起海豚鏈球菌生長受到抑制。
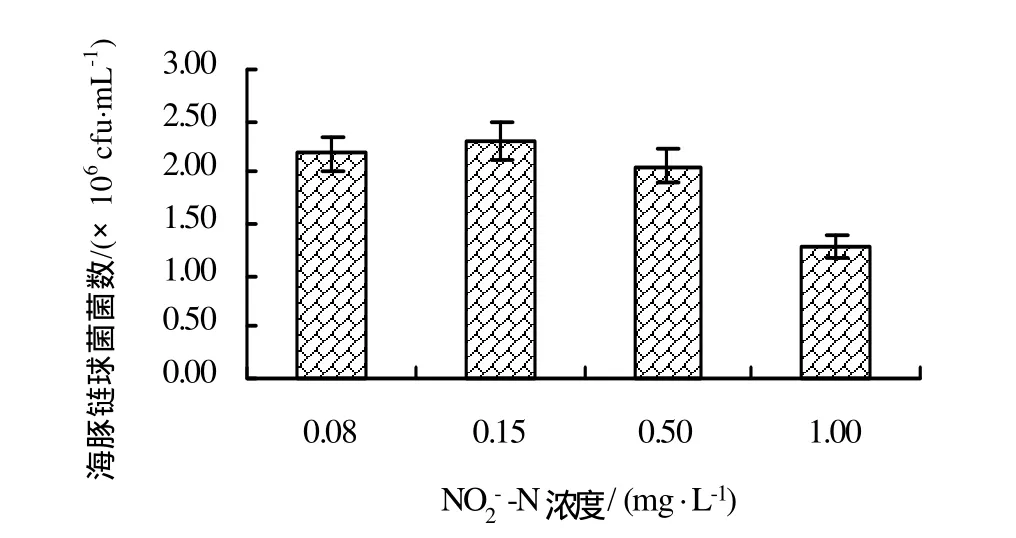
圖5 養殖水體中的NO2--N對海豚鏈球菌生長的影響
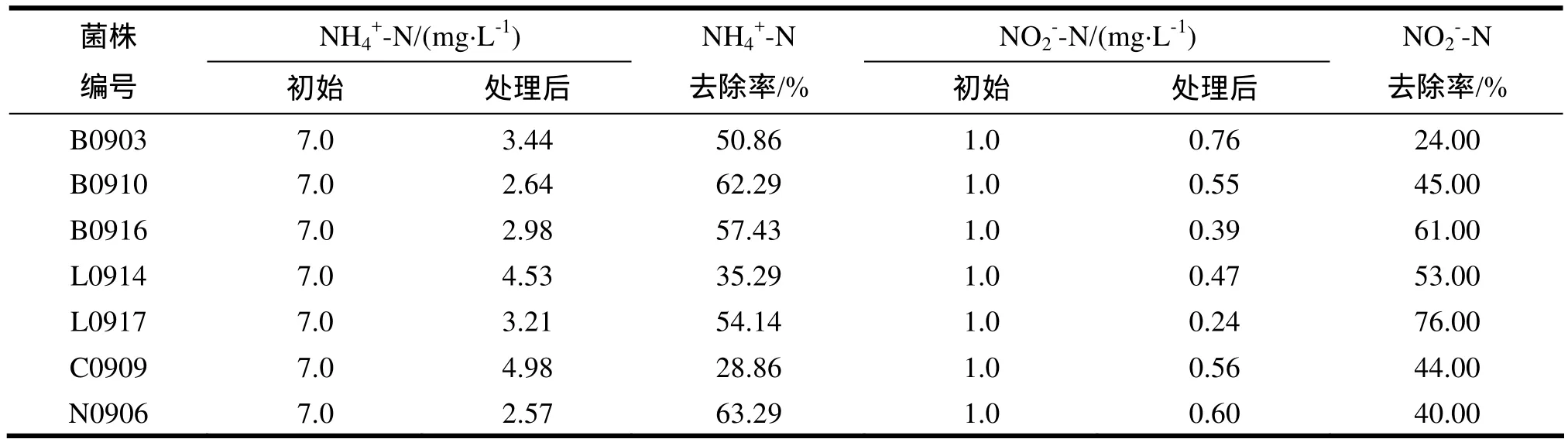
表2 7株拮抗功能菌株對氨氮、亞硝酸的去除能力
2.3.3.2 7株拮抗菌株對水體中兩種形式無機氮的利用 7株拮抗菌株對水體中兩種形式無機氮的利用以去除率表示,結果如表2所示。7株菌株對養殖水體中的NH4+-N、NO2--N都具有一定的去除能力。B0916、L0917具有較強的對NH4+-N和NO2--N的綜合去除能力,對NH4+-N的去除率分別為57.43%和54.14%,對NO2--N的去除率為61.00%和76.00%。去除NO2--N能力較強的菌株為B0916、L0914、L0917;而去除NH4+-N的能力由強到弱依次為N0906>B0910>B0916> 0917>B0903>L0914>C0909。菌株N0906與B0910在NH4+-N去除率上差異不顯著(P>0.05),而與其它菌株之間差異顯著(P<0.05)。根據海豚鏈球菌對水體中兩種形式無機氮的利用試驗結果可以看出,NH4+-N濃度較高時,海豚鏈球菌可以利用銨態氮滿足自身的生長和繁殖,因此降低水體NH4+-N的濃度有利于抑制海豚鏈球菌的快速增殖,B0910和N0906菌株具有較高的NH4+-N的去除率,有利于與海豚鏈球菌競爭銨態氮資源從而抑制其生長。
3 討 論
羅非魚鏈球菌病的發生主要是魚體、病原菌和環境三者之間相互復雜作用的結果,其中養殖生態環境的惡化加重了病害的流行與危害程度。據研究報道,大部分魚類發病池塘的水質很差,氨氮含量超過3 mg/L[1]。環境的惡化可導致魚體的生長和健康受到損害,抵抗力下降,而這種惡化環境中的主要污染因子(如氨氮、亞硝酸鹽)恰恰是病原菌良好的營養源,可促使其大量繁殖,最終導致疾病的大規模爆發。Narad等[9]認為羅非魚鏈球菌病的發生與水質理化因子、養殖密度等可引起魚體應激反應的因素有關。其也與水體中存在的大量鏈球菌有直接的關聯[10]。本項研究選擇從分離自羅非魚養殖水環境中具有凈化水質功能的微生物菌株中來篩選拮抗菌株,避免了外源生物的影響,保證了所篩選菌株的生態應用安全性。拮抗菌株的篩選方法主要是基于抑菌活性物質可以在固體或半固體培養基上擴散,從而抑制敏感指示菌的生長,在培養基上形成透明抑菌圈這一機制。目前常見的實驗方法有點種法(spot-on-the-lawn)、紙片法(disc-diffusion)、打孔法(well-diffusion)等。本研究采用紙片法和打孔法做了預試驗,并對2者的效果進行了比較。當用紙片法吸取同等體積的無菌濾液于直徑相同的濾紙圓片中時,濾紙圓片上的濾液向四周擴散的速度和數量可能會不一致,可導致抑菌圈變成橢圓形,不易于菌株拮抗活性大小的比較,故正式研究時采用的是打孔法。另外指示菌濃度也對抑菌圈的邊緣整齊程度、清晰度、抑菌圈直徑有著影響[11]。研究選用6×107cfu/mL、6×106cfu/mL、6×105cfu/mL 3種指示菌濃度做比較,濃度為6×106cfu/mL時,抑菌圈邊緣清晰,易于觀察和測量,且抑菌圈值較大。因此后續的試驗研究過程中采用的海豚鏈球菌濃度為6×106cfu/mL。
經打孔法初步篩選獲得了11株具拮抗功能的菌株,其中拮抗功能比較強的菌株有7株,分別為3株芽孢桿菌、2株乳酸桿菌、1株是諾卡氏菌和1株假絲酵母。關于芽孢桿菌、乳酸菌、酵母菌作為微生態制劑應用于水產病害生態防治的報道已很多,而放線菌在水產養殖方面的應用甚少,近幾年也都只局限于海洋放線菌上[12-13]。Salah等[14]在體外拮抗實驗中發現芽孢桿菌對嗜水氣單孢菌具有拮抗作用,將其添加到飼料中喂食羅非魚,魚體的成活率提高,免疫力增強。Vo Minh Son等[15]用添加乳酸桿菌的飼料喂食斜帶石斑魚,降低了由鏈球菌引起感染的死亡率,存活率提高了36.7%。Mohsen等[16]將不同量的釀酒酵母菌添加到飼料中喂養尼羅羅非魚 14周后,采用注射法感染嗜水氣單孢菌,10 d后魚體的死亡率和血清中病原菌的數量隨著添加釀酒酵母菌量的增加而降低。
微生態制劑進入復雜的養殖環境后需形成優勢種群才能充分發揮其作用,因此微生態制劑必須具有快速的生長優勢,以便能夠在水環境中迅速繁殖成為優勢種群凈化水質,并且也能夠有更多的機會粘附于魚類機體。通過產生抑菌物質、營養競爭等途徑而發揮抑菌作用。從生長參數來看,C0909的生長最具優勢,L09017、N0906的倍增時間顯著短于海豚鏈球菌,延滯期也較短,在一定條件下也可以形成優勢菌。
有益微生物與病原菌之間的共凝集被認為是排除病原菌的一種方法。本研究的7株拮抗菌株只有L0914、C0909、N0906與鏈球菌產生共凝集作用,共凝集率分別為3.03%、4.11%、1.85%,與Chabrillon等[6]的候選菌與病原菌2%左右的共凝集率結果相似,但卻明顯低于張子華等[17]從魚體腸道分離的候選菌與病原菌10%以上的共凝集率。這可能是從腸道分離的菌株本身具有分泌粘液粘附于腸道才得以在腸道中生存的本能所導致。共凝集有助于拮抗菌株與鏈球菌結合在一起后影響鏈球菌對羅非魚體表和鰓粘液的粘附作用,從而有效地排除病原菌。
在水產養殖生產中,氨氮、亞硝酸鹽是高產養殖池塘中2項極為重要、需引起重點關注的水質因子[18]。水體中的分子態氨、亞硝酸鹽對養殖生物而言屬有毒因子,它會破壞魚類及其它水生動物的鰓組織,并滲進血液中,使魚體抵抗力下降,對病原菌的易感性增強,因此本研究選擇氨氮和亞硝酸鹽兩個指標,研究海豚鏈球菌和7株拮抗菌株對兩種形式無機氮的利用能力。芽孢桿菌、乳酸桿菌、諾卡氏菌,假絲酵母四種菌株凈化養殖水質的研究均有報道[19-22],不同的菌株其凈化特性不同,在分解水中有機物、同化水中氨氮、降低亞硝酸鹽等方面發揮的作用各異。陳靜等[20]研究表明枯草芽孢桿菌B7對氨氮的去除率大于80%,對亞硝酸鹽的去除率大于29%,該結果說明枯草芽孢桿菌對氨氮和亞硝酸鹽具有一定的轉化去除功能。劉慧玲等[23]應用枯草芽孢桿菌凈化羅非魚魚苗養殖水體的結果顯示,枯草芽孢桿菌對氨氮、亞硝酸鹽的去除率分別為45.8%、75.9%。丁雷等[24]卻發現芽孢桿菌不能起到分解水體中小分子有機物、同化氨氮的作用,但有明顯降低亞硝酸鹽的作用。陳紅菊等[25]研究了光合細菌、芽孢細菌、放線菌對養殖水體中亞硝酸鹽含量的影響,其結果表明三種微生物都有凈化水質的作用,放線菌的凈化效果優于光合細菌和芽孢細菌。本研究中諾卡氏菌N0906去除氨氮的能力最強,去除率為63.31%,乳桿菌L0917具有很強的亞硝酸鹽去除能力,去除率為76.31%,雖然乳桿菌L0917在拮抗作用、生長優勢、共凝集作用上弱于諾卡氏菌N0906,但在亞硝酸鹽去除能力上優于諾卡氏菌N0906。在實際生產應用中,單一使用諾卡氏菌N0906會存在對亞硝酸鹽降解不足的缺點,因此可以利用乳桿菌L0917降解亞硝酸鹽能力強的特性,與諾卡氏菌N0906菌株相配互補,以進一步增強水體凈化的效果。
4 小 結
在羅非魚養殖水體中分離到多株具有凈化水質功能的菌株,通過對這些菌株的初篩,獲得了 11株對羅非魚鏈球菌病的病原——海豚鏈球菌具有拮抗功能的微生物菌株。對其中7株拮抗效果較為顯著的菌株從生長優勢、共凝集率、凈化水質能力等3方面進行進一步的篩選,獲得一株具綜合優勢的高效菌株——諾卡氏菌N0906。相對于其它的菌株,諾卡氏菌N0906具有良好的生長優勢、可與鏈球菌產生共凝集作用、具有良好的凈化水質功能,故適宜作為羅非魚養殖中控制養殖生態環境和鏈球菌病害的微生態菌株。但諾卡氏菌N0906的拮抗機理、生態安全性以及與其它菌株的互補協同等還有待于進一步研究,以便對菌株的應用前景作出科學評價,從而更好地應用于羅非魚養殖中水質的調控和鏈球菌病的生態防治。
[1]Liu C H, Chen J C.Effect of ammonia on the immune response of white shrimpLitopenaeus vannameiand its susceptibility toVibrio alginolyticus[J].Fish & Shellfish Immunology, 2004, 16(3): 321-334.
[2]Cheng W, Hsiao I S, Chen J C.Effect of ammonia on the immune response of Taiwan abaloneHaliotis diversicolorsupertexta and its susceptibility toVibrio parahaemolyticus[J].Fish & Shellfish Immunology, 2004, 16(3): 193-202.
[3]Thompson F L, Abreu P U, Cavalli R.The use of microorganisms as food source forPenaeus paulensislarvae [J].Aquaculture,1999, 174: 139-153.
[4]Tramer J, Fowler G C.Estimation of nisin in foods [J].Journal of the Science Food and Agriculture, 1964, 15(8): 522-528.
[5]Niall G V, Winston D L, Horst K.In Vitro growth characteristics of five candidate aquaculture probiotics and two fish pathogens grow in fish intestinal mucus [J].Fems Microbiology Letters, 2004, 231: 145-152.
[6]Chabrillon M, Rico R M, Arijo S, et al.Interactions of microorganisms isolated from gilthead sea bream,Sparus aurataL., onVibrio harveyi, a pathogen of farmedSenegalese sole,Solea senegalensis(Kaup)[J].Journal of Fish Diseases, 2005, 28(9): 531-537.
[7]吳偉, 胡庚東, 瞿建宏, 等.應用短乳桿菌去除養殖水體中亞硝酸鹽[J].生態與農村環境學報, 2007, 23(4): 37-40.
[8]國家環境保護總局.水和廢水監測分析方法[M].4版.北京: 中國環境科學出版社, 2002: 268-275.
[9]Naraids, Fanrongk, Dannyk, et al.Occurrence of rare genotypes ofStreptococcus agalactiaein cultured redTilapiaOreochromissp.andNiletilapianiloticusin Thailand-Relationship to human isolates[J].Aquaculture, 2008, 284: 35-40.
[10]Eldar A, Bejerano Y, Livoff A, et al.Experimental streptococcal menigo-encepgalitis in cultured fish[J].Veterinary Microbiology,1995, 43(1): 33-40.
[11]何寧, 王昌祿, 順小波, 等.杯碟法檢測乳酸菌素活性優化條件的研究[J].天津輕工業學院學報, 1999(2): 17-20.
[12]張梁, 沈建忠, 陳佳毅.噬菌蛭弧菌對草魚池水質及細菌群落的影響[J].水生態學雜志, 2009, 2(1): 6-10.
[13]暴增海, 馬桂珍, 吳少杰, 等.海洋放線菌BM-2菌株的抗菌特性[J].農藥, 2009, 48(9): 640-643.
[14]Salah M A,Youself A G A, Ahlam A A G, et al.Studies onBacillus subtilisandLactobacillus acidopHilus, as potential probiotics, on the immune response and resistance ofTilapia nilotica(Oreochromis niloticus) to challenge infections[J].Fish &Shellfish Immunology, 2008, 25: 128-136.
[15]Vo M S, Chang C C, Wu M C, et al.Dietary administration of the probiotic,Lactobacillus plantarum, enhanced the growth, innate immune responses, and disease resistance of the grouper EpinepHelus coioides[J].Fish & Shellfish Immunology, 2009, 26: 691-698.
[16]Mohsen A T, Azza M A R, Nahla E M.Evaluation of commercial live bakers’yeast,Saccharomyces cerevisiaeas a growth and immunity promoter for fry nile Tilapia,Oreochromis niloticus(L.) challenged in situ withAeromonas hydropHila[J].Aquaculture,2008, 280: 185-189.
[17]張子華, 鄢慶枇, 皺文政, 等.鰻鱺腸道中嗜水氣單胞菌的拮抗菌的篩選[J].集美大學學報, 2010, 14(3): 5-11.
[18]張來發, 蔣桂珍.高產池塘三項水質因子控制[J].水產科技情報, 1994, 22(9): 59-61.
[19]Salah M A, Youself A G A, Ahlam A A G, et al.Studies onBacillus subtilisandLactobacillus acidopHilus, as potential probiotics, on the immune response and resistance ofTilapia nilotica(Oreochromis niloticus) to challenge infections[J].Fish &Shellfish Immunology, 2008, 25: 128-136.
[20]陳靜, 徐海燕, 谷巍.枯草芽孢桿菌B7的分離和凈化水質的初步研究[J].河北漁業, 2008, 11(179): 10-11.
[21]張慶芳, 遲乃玉, 鄭學仿, 等.短乳桿菌(Lactobacillus brevis)去除亞硝酸鹽的研究[J].微生物學通報, 2004, 31(2): 55-60.
[22]吳偉, 余曉麗, 李詠梅.假絲酵母菌對養殖水體中亞硝酸鹽的降解特性研究[J].中國環境科學, 2001, 21(1): 8-11.
[23]劉慧玲, 黃翔鵠, 李長玲, 等.不同濃度的枯草芽孢桿菌對羅非魚魚苗的養殖水體水質及其抗病力的影響[J].水產養殖, 2009, 30(10): 5-9.
[24]丁雷, 岳永生, 李貴杰, 等.芽胞菌對養魚水質影響的研究[J].淡水漁業, 1999, 29(10): 7-10.
[25]陳紅菊, 岳永生, 丁雷, 等.生物凈化劑對養殖水體亞硝酸鹽含量影響的研究[J].淡水漁業, 2003, 33(1): 16-18.

