工程微生物發酵褐藻碳水化合物生產乙醇: 生物乙醇開發新方向
楊官品, 李斐斐
(1. 中國海洋大學 海洋生命學院 海洋生物遺傳育種教育部重點實驗室, 山東 青島 266003; 2. 中國海洋大學 海洋生物多樣性與進化研究所, 山東 青島 266003)
工程微生物發酵褐藻碳水化合物生產乙醇: 生物乙醇開發新方向
Fermenting brown algal carbohydrates into ethanol with engineered microorganisms: A new horizon for bioethanol production
楊官品1,2, 李斐斐1
(1. 中國海洋大學 海洋生命學院 海洋生物遺傳育種教育部重點實驗室, 山東 青島 266003; 2. 中國海洋大學 海洋生物多樣性與進化研究所, 山東 青島 266003)
生物質(biomass)是生產生物燃油和日用品的天然可再生資源。用生物質生產燃油和日用品有助于解決糧食、環境、能源等重大問題。遺傳育種、生物技術、化學加工、工程技術等領域的技術進步和整合, 正在逐步使利用生物質生產燃油和日用品成為可能。其中, 最具代表意義的是發酵生物質生產乙醇。攀升的油價和保護化石燃料資源的壓力, 使人們力圖用工程微生物發酵生物質生產生物燃油和日用品, 遺傳工程修飾和改造工業微生物, 規模化開發多樣生物質[1-2]。玉米和甘蔗可做工業用, 但“食物-燃油”憂慮(concerns)可能終結這一路經。木質纖維素來源豐富, 但處理木質纖維素釋放單糖, 成本高,環境壓力大[3-5]。因此, 需要全新思路和策略開發利用非木質纖維素生物質, 海洋大型褐藻是新希望。
褐藻具備生產燃油和日用化學品理想海洋生物質的突出優點: 不占用耕地、不使用肥料、不使用淡水。這些都是其他生物質的致命弱點。栽培褐藻可克服有關土地利用的擔憂, 避免對食物供給的沖擊。褐藻已有悠久栽培, 用于提取褐藻膠、甘露醇、食用或做動物飼料、肥料和各種多聚物原料。世界上許多國家都栽培褐藻, 年產1500萬t左右[6]。褐藻不含木質素, 其多糖可通過簡單研磨、舂碾等溶解于水,發酵前不需耗能的前處理。有報告稱每公頃可年產59t干褐藻生物質, 每單位干褐藻生物質產 0.254單位乙醇[6]。按照這樣的估計, 每公頃可年產19 000L乙醇, 比甘蔗高約2倍, 比玉米高約5倍[7]。用包括各種藻(algae)在內的海洋生物質生產乙醇已引起廣泛重視[8]。利用海洋藻類生物質生產乙醇克服了陸源生物質相關的問題, 且單位面積產量更高(本文中藻類指那些大規模栽培或可采集大型海藻, 如海帶等,不含微藻)。
1 遺傳工程改良工業釀酒酵母發酵木質纖維素水解物生產乙醇
2008年, 全世界生產了約870億L生物燃油, 相當于德國當年消耗量。但這些生物燃油都是用食用碳水化合物如玉米淀粉和甘蔗糖生產的。這引起人們對凈能源(net energy)獲得、溫室氣體效應(greenhouse gas effects)、燃油生產-食物、飼料和纖維生產用地競爭、燃油生產-生態系統功能維持用地競爭的擔憂。發酵非食用植物組分(木質纖維素)生產乙醇將使人們繞過這些擔憂[7]。
木質纖維素(lignocellulose)由纖維素(cellulose)、半纖維素(hemicelluloses)和木質素(lignin)構成。纖維素是平行排列的多聚纖維二糖(cellobiose)構成的結晶體。半纖維素是由阿拉伯糖(arabinose), 乳糖(galactose), 葡萄糖(glucose), 甘露糖(mannose)和木糖(xylose)等構成的分支多糖, 還含有乙酸(acetic acid), 糖醛酸(glucuronic acid), 阿魏酸(ferulic acid)等成分。根據單糖成分, 半纖維素可分為木聚糖(xylan), 甘露聚糖(mannan), 葡聚糖(glucan), 糖醛酸木聚糖(glucuronoxylan), 阿拉伯聚糖(arabinoxylan)等。纖維素排列較緊密, 水解較難; 而半纖維素的單糖多樣、糖鏈短、分支、非結晶, 水解比纖維素容易。木質素結構和成分發雜, 與纖維素和半纖維素結合緊密, 水解最難。纖維素多用酶法水解, 而半纖維素多用稀酸水解, 木質素多用堿水解[9]。
發酵木質纖維素生產乙醇被認為是纖維素生物乙醇最主要研究內容[10]。但木質纖維素不能直接發酵成乙醇, 必須進行前期處理, 降解成纖維二糖、纖維三糖(cellotriose)、纖維四糖(cellotetrose )等混合物構成的纖維糊精(cellodextrin)、木糖、葡萄糖等簡單糖后才能發酵成乙醇。來源不同種類植物的木質纖維素水解產物存在區別, 但一般含有約 70%纖維糊精和葡萄糖和約 30%的木糖[11]。將這些水解產物轉換成生物乙醇需要有效利用纖維糊精、木糖和葡萄糖的微生物[5,12]。
因缺少木糖同化途徑, 工業釀酒酵母(Saccharomyces cerevisiae)能發酵葡萄糖, 但不能發酵木糖。但釀酒酵母經戊糖磷酸途徑(pentose phosphate pathway, PPP)可以將戊糖(pentose)轉換成丙酮酸(pyruvate),利用五碳糖。畢赤酵母(新修訂名Scheffersomycesstipitis)含木糖還原酶(xylose reductase, XR)和木酮糖脫氫酶(xylitol dehydrogenase, XDH)基因, 是自然界已發現的最有效的木糖發酵菌[13-14], 但它不是成熟的工業酵母。如果將畢赤酵母的XR和XDH基因轉入釀酒酵母, 就能將木糖導入PPP途徑, 賦予釀酒酵母發酵木糖能力[15-16]。釀酒酵母存在內源木酮糖激酶(xylulokinase, XK)基因, 其過表達或導入畢赤酵母木酮糖激酶基因, 都能顯著改善釀酒酵母木糖發酵能力[17-19]。但長期努力獲得的工程釀酒酵母達不到畢赤酵母發酵木糖、工程釀酒酵母發酵葡萄糖生產乙醇的產量、發酵效率和乙醇耐受度, 不符合工程釀酒酵母標準。XR更多利用NADPH而XDH只能利用NAD+, NADPH與NADH因缺少酶難以相互轉換。這會導致細胞內氧化還原態不平衡、木酮糖積累、木糖發酵效率低[20-21]。另外, 微生物優先發酵葡萄糖, 被消耗完之前抑制其他糖發酵。葡萄糖發酵積累的乙醇, 會加劇乙醇耐受度問題。
畢赤酵母(Pichiapastoris, 新修訂名Scheffersomycesstipitis)不是成熟工業酵母, 但能利用木糖合成乙醇。釀酒酵母是成熟的工業酵母, 但不能利用木糖。將畢赤酵母木糖代謝基因整合到釀酒酵母染色體上, 使釀酒酵母獲得利用木糖合成乙醇能力。同時引入正常和突變的木糖還原酶基因, 使 NADPH和NADH平衡利用。將來源鏈孢霉(Neurosporacrassa)的纖維二糖轉運蛋白和β-葡萄糖苷酶基因整合到釀酒酵母染色體上, 使釀酒酵母獲得細胞內降解纖維二糖生成葡萄糖、代謝纖維二糖和木糖生成乙醇的能力, 并克服了酵母優先利用葡萄糖, 積累木糖的缺陷, 提高了釀酒酵母乙醇耐受度和乙醇發酵效率。木質纖維素經前期處理獲得纖維二糖和木糖, 利用遺傳工程改良釀酒酵母就能發酵木質纖維素生產乙醇(圖 1)。但木質纖維素前期處理困難, 對環境影響大, 木質纖維素目前不是最理想乙醇生產生物質。
葡萄糖和木糖同步發酵有望克服葡萄糖抑制問題, 而纖維二糖和木糖同步發酵能克服葡萄糖抑制問題, 同時也能發酵木質纖維素水解產物生產乙醇,因為木質纖維素水解產物主要是纖維糊精(纖維二糖為主)、木糖和葡萄糖(少量), 纖維二糖可進一步降解為葡萄糖。但是, 實現這一目標, 必須首先解決纖維糊精向釀酒酵母細胞內轉運的問題。纖維素分解真菌鏈孢霉(Neurospora crassa)具有纖維糊精轉運系統和β-葡萄糖苷酶[22], 但不是工業微生物。將鏈孢霉纖維糊精轉運系統(例如, cellodextrin transporter 1)和β-葡萄糖苷酶(β-glucosidase)基因轉入已轉入畢赤酵母XR、XDH和 XK(將木糖導入戊糖磷酸途徑)基因的工程釀酒酵母(存在內源β-葡萄糖苷酶), 就能實現葡萄糖和木糖同步發酵、纖維二糖和木糖同步發酵, 將木質纖維素水解產物發酵成乙醇。另外, 同時轉入原始XR和突變XR基因, 以使細胞內氧化還原態平衡,減少木酮糖積累, 提高發酵效率。原始XR更多利用DADPH, 而突變XR更多利用NADH, 這樣, 細胞內氧化還原態平衡, 木糖醇積累減少。另外, 在質粒上表達β-葡萄糖苷酶, 利用質粒多拷貝特點, 控制β-葡萄糖苷酶活性和纖維二糖降解成葡萄糖速度, 克服葡萄糖限制, 實現葡萄糖和木糖同步發酵。木質纖維素水解產物含有少量葡萄糖。獲得的工程釀酒酵母優先利用這些葡萄糖后就轉入同步發酵纖維二糖和木糖, 獲得了發酵木質纖維素水解產物生產乙醇的理想產量和發酵效率[23]。這是利用工程工業釀酒酵母發酵木質纖維素水解產物生產乙醇最成功的例子。
將自然界木質纖維素利用基因資源導入成熟工業微生物, 已取得木質纖維素水解產物發酵生產乙醇的較理想效果, 但將木質纖維素轉化成生物乙醇,最大的限制是木質纖維素的前期處理。這是目前最大的限制。這種限制不在技術, 而在前期處理的經濟成本和環境壓力。回避了“糧食-燃油”沖突, 發酵木質纖維素生產乙醇仍存在成本和環境限制。
2 遺傳工程改良非工業細菌發酵褐藻碳水化合物生產乙醇
褐藻碳水化合物有褐藻酸(alginate)、甘露醇(mannitol)和葡聚糖(glucan)。其中, 褐藻的葡聚糖又稱昆布多糖(laminarin)或就是纖維素。褐藻酸是多聚甘露糖醛酸(mannuronate, M)模塊、多聚古洛糖醛酸(guluronate, G)模塊、或兩者混合模塊組成的線性多聚糖醛酸(polyuronic acid), 占干重20%~40%[24]。發酵甘露醇和昆布多糖生產乙醇已有報道[25-27]。
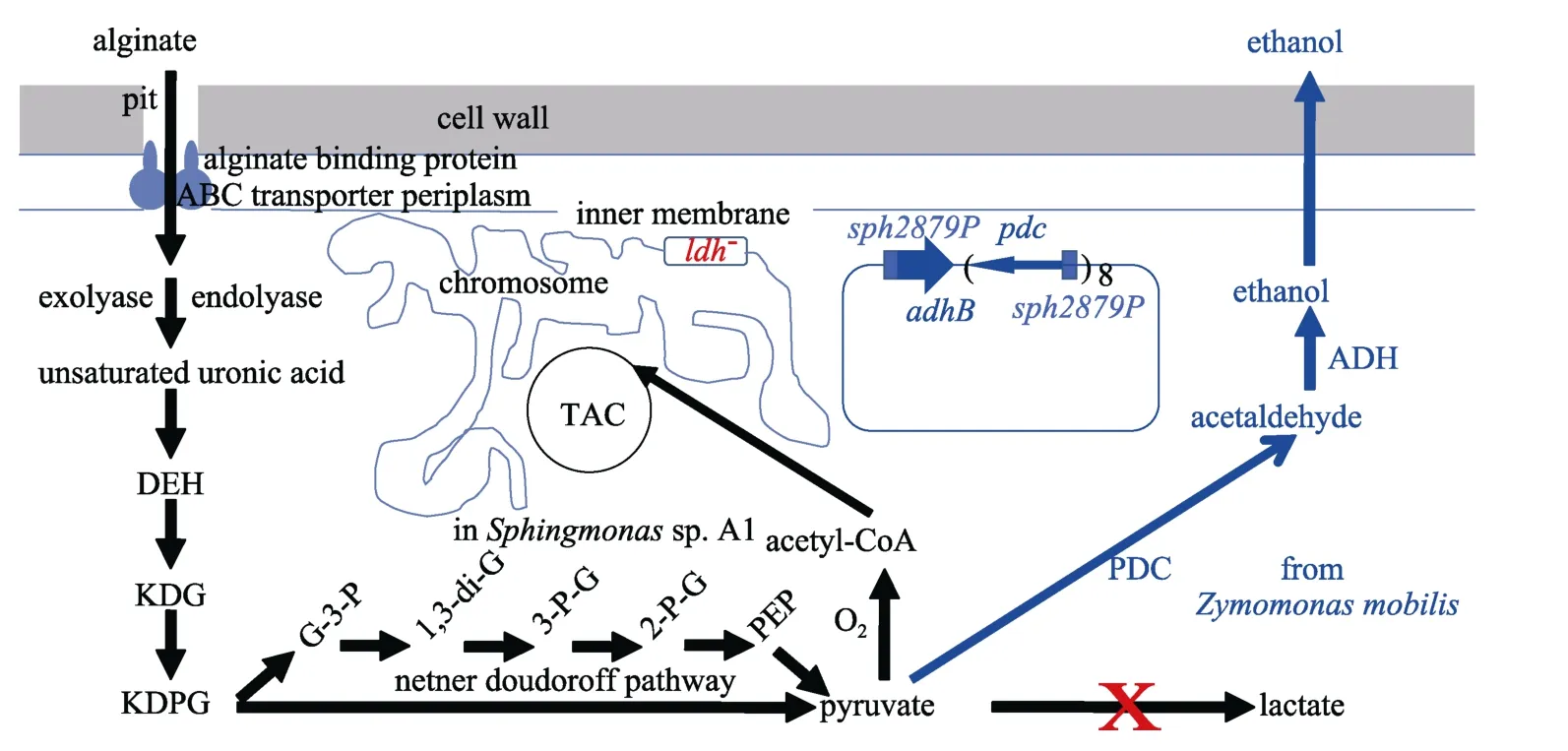
圖2 遺傳工程改良鞘氨醇單胞菌(Sphingomonas sp.)發酵褐藻酸生產乙醇代謝途徑
很多細菌降解、同化利用褐藻酸, 但已有工業細菌不能發酵褐藻酸。褐藻酸分解細菌合成褐藻酸裂解酶(alginate lyases, Alys), 經內解聚β消除反應(endolytic β-elimination reaction)解聚褐藻酸, 形成寡聚褐藻酸, 再經寡聚褐藻酸裂解酶(oligoalginatelyase, Oal)外解聚, 形成不飽和單體并變構成脫氧赤鮮 己 酮 糖 醛 酸 (4-deoxy-L-erythro-5-hexoseulose uronic acid, DEH), DEH還原酶(DehR)還原DEH, 形成酮脫氧葡萄糖醛酸(2-keto-3-deoxy-D-gluconate, KDG), KDG 進入恩-杜氏途徑(Netner Doudoroff pathway), KDG激酶(KdgK)和 KDG-6-磷酸醛縮酶(KDG-6-P aldolase, KDGPA/Eda)將其代謝成丙酮酸和甘油醛-3-磷酸, 同化利用褐藻酸[28-30]。鞘氨醇單胞菌(Sphingomonassp.)經褐藻酸結合蛋白(alginate-binding proteins)和 ATP結合框轉運體(ATP binding cassette transporters, ABC transporters)形成的超級通道吸收利用褐藻酸[31-32]。
鞘氨醇單胞菌具有坑洞結構。褐藻酸結合蛋白和ATP結合框轉轉運蛋白組成轉運褐藻酸通道。進入細胞后, 外褐藻酸裂解酶和內褐藻酸裂解酶分解褐藻酸形成不飽和糖醛酸, 自動變構成脫氧赤鮮己酮糖醛酸后, 被還原成酮脫氧葡萄糖醛酸, 最后經恩-杜氏途徑代謝成丙酮酸。用來源運動發酵單胞菌(Zymomonasmobilis)的丙酮酸脫羧酶、乙醇脫氫酶基因和來源鞘氨醇單胞菌的啟動子構建重組質粒, 并調整基因拷貝數, 使鞘氨醇單胞菌平衡表達兩個基因, 獲得代謝丙酮酸生成乙醇的能力(圖 2)。但鞘氨醇單胞菌不是成熟工業細菌, 遺傳操作工具少, 遺傳工程改良困難, 發酵效能難以提高。
能代謝到丙酮酸, 就有希望經遺傳工程改良合成各種需要的物質, 包括乙醇。從丙酮酸開始, 只要丙酮酸脫羧酶(pyruvate decarboxylase, PDC)和乙醛脫氫酶(acetaldehyde dehydrogenase, ADH)兩種酶作用, 就能生成乙醇。乳酸是乙醇發酵的主要副產物。只要將乳酸脫氫酶(lactate dehydrogenase, LDH)基因敲除, 就能消除乙醇發酵副產物。運動發酵單胞菌(Zymomonasmobilis)能厭氧發酵單糖生產乙醇, 其代謝途徑簡單, 代謝副產物少, 乙醇產率高, 具有工業細菌潛力。將運動發酵單胞菌的PDC和ADH基因轉入鞘氨醇單胞菌, 可構建發酵褐藻酸生產乙醇途徑。Takeda等[33]在質粒載體上表達ADH基因和串聯的PDC基因, 構建了發酵褐藻酸生產乙醇的遺傳工程修飾鞘氨醇單胞菌(Sphingomonassp. A1)。但是,鞘氨醇單胞菌缺乏常規工業發酵條件適用性, 不具備完善遺傳操作工具, 缺少大腸桿菌遺傳操作方便性和工業發酵適用性。這將限制快速遺傳操作鞘氨醇單胞菌, 優化其發酵性能, 減少發酵副產物[1]。
3 遺傳工程改良大腸桿菌發酵褐藻碳水化合物生產乙醇
從基因元件考慮, 遺傳工程改良成熟工業大腸桿菌發酵褐藻碳水化合物生產乙醇最合理。微生物發酵單位重葡聚糖和甘露醇分別產0.08和0.12單位重乙醇[6]。但目前還沒有發酵褐藻酸的工業微生物。發酵葡聚糖和甘露醇生產乙醇, 也達不到發酵葡萄糖生產乙醇的效率。例如, 釀酒酵母發酵糖海帶(Laminaria saccharina; 現修訂為Saccharina latissima)葡聚糖僅產約 0.45%體積乙醇[25]。發酵甘露醇生產乙醇還產生過剩還原當量(reducing equivalent), 使細胞內氧化還原態失衡。因為甘露醇經甘露醇脫氫酶氧化成果糖后進入恩-杜氏途徑, 代謝成乙醇。而甘露醇氧化同時也生成 NADH, 造成細胞內氧化還原態失衡。只有在微氧環境中, 或在轉氫酶作用下還原NADP+, 使電子分流, 才能再生 NAD+, 克服這一問題, 可多數微生物沒有轉氫酶, 因而不能在無氧環境下發酵甘露糖生產乙醇[26]。微氧環境中, 棕櫚發酵菌(Zymobacter palmae)發酵單位重甘露醇僅產生0.38單位重乙醇[26]。細菌和酵母都能發酵葡聚糖和甘露醇。棕櫚發酵菌可同時發酵極北海帶(Laminaria hyperborea, 現修訂為Saccharina hyperborea)葡聚糖和甘露醇, 單位體積極北海帶葡聚糖和甘露醇產生約1.6%單位體積乙醇[26-27]。如果能實現褐藻酸與葡聚糖、甘露醇同步發酵, 不僅增加了發酵糖總量,實現褐藻全部糖的利用, 而且發酵褐藻酸消耗還原當量, 可平衡甘露醇發酵導致的細胞內氧化還原態失衡[34]。
大腸桿菌可代謝甘露醇和葡萄糖。在最成熟工業大腸桿菌中構建發酵褐藻酸生產乙醇的途徑, 可實現褐藻碳水化合物同步發酵。大腸桿菌已用來發酵生產一系列產物, 如乙醇、聚酮化合物(polyketides)、植物天然產物、脂肪酸乙脂、烷烴(alkanes)、丙二醇(propanediol)和丁二醇(butanediol)等[34]。因此,在大腸桿菌中構建了發酵褐藻酸生產乙醇途徑就相當于在大腸桿菌中構建了發酵褐藻碳水化合物生產乙醇途徑, 也為發酵褐藻碳水化合物生產生物乙醇和其他日用品搭建了基礎平臺。
構建大腸桿菌發酵褐藻酸生產乙醇途徑第一個目標就是胞外分解褐藻酸成為單糖或寡糖的酶系。有很多細菌都能分解褐藻酸, 但分解產物多是寡糖而不是單糖。因此, 只要將褐藻酸分解成寡糖就算實現了第一個目標。假交替單胞菌 SM0524(Pseudoalteromonassp. SM0524)合成32kD、能分解褐藻酸多聚M或多聚G模塊、形成二到四聚糖的胞外褐藻酸裂解酶(alginate lyase, Aly)[35]。大腸桿菌抗原 43 (antigen 43, Ag43)可自主轉運到胞外。Ag43前體有信號態區域(signal peptide, SP)、α(乘客)結構域、β(載體)結構域和結構域間間隔。成熟時, α、β結構域形成聚合體并粘附(無共價結合)在大腸桿菌表面。Ag43已被開發成細菌抗原和蛋白表面展示系統[36]。將Ag43的信號肽、Aly、部分α結構域、β結構域組合成融合蛋白, Wargacki et al. (2012)[34]成功在大腸桿菌中表達了假交替單胞菌SM0524的Aly, 并完全分泌到培養基。融合Aly可以將褐藻酸降解成2~5個糖單體的褐藻酸寡糖(oligoalginate)。
將褐藻酸降解成褐藻酸寡糖, 大腸桿菌必須先將其轉運到細胞內才能利用。因此, 構建大腸桿菌發酵褐藻酸生產乙醇的目標就是轉運褐藻酸寡糖。盡管很多細菌都能降解褐藻酸, 但僅在鞘氨醇單胞菌(Sphingomonassp.)發現褐藻酸結合蛋白(alginatebinding proteins)和 ATP結合框轉運體(ATP binding cassette transporters, ABC transporters)形成的超級通道, 能將褐藻酸轉運到細胞質中[37]。這是一個龐大的系統, 向大腸桿菌引入這一系統非常困難, 也從來沒有人嘗試過。但是, 菊歐文氏菌(Erwinia chrysanthemi)果膠寡糖(oligopectin)轉運系統簡單得多,只有 ABC轉運體(TogMNAB)蛋白和同向轉運體(TogT)[38]。果膠(pectin)和褐藻酸有相似性, 而果膠寡糖轉運系統在細菌中廣泛存在。因此, 在降解褐藻酸的細菌中可能存在相似的轉運系統。通過生物信息學搜尋, Wargacki等[34]在燦爛弧菌 12B01 (Vibrio splendidus12B01)基因組序列(AAMR00000000)中發現一區域可能編碼相似的系統, 但用常規方法克隆這一區域比較困難。Wargacki等[34]構建了該細菌的fosmid文庫, 經功能篩選獲得一約36 kb片段, 該片段編碼褐藻酸寡糖轉運和分解的所有蛋白, 包括大腸桿菌本身也存在的KDGK和KDGPA編碼基因。逐個刪除基因后進行功能驗證, 最后闡明了該片段編碼基因的功能。為了更有效地轉運和代謝褐藻酸寡糖, Wargacki等[34]搜尋基因組序列, 在上述片段兩側發現一些輔助褐藻酸轉運和深度降解的基因, 擴增后與分離的片段組合在一起, 發現褐藻酸代謝效率得到顯著提升。最后, Wargacki等[34]將褐藻酸裂解酶、轉運、分解等基因通過同緣重組方式全部整合在大腸桿菌染色體上, 使大腸桿菌獲得了代謝褐藻酸的能力。
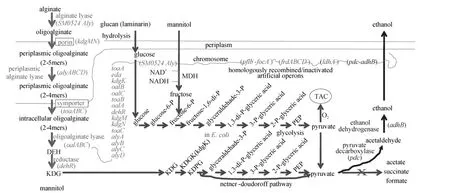
圖3 遺傳工程改良大腸桿菌發酵褐藻主要碳水化合物生產乙醇代謝通路
假交替單胞菌 SM0524(Pseudoalteromonassp. SM0524)來源褐藻酸裂解酶基因與大腸桿菌抗原 43 (antigen 43, Ag43)部分區域(信號肽、部分α結構域和β結構域)編碼序列融合, 整合到大腸桿菌染色體中,使大腸桿菌表達并完全分泌褐藻酸裂解酶, 使褐藻酸降解成褐藻酸寡糖。將來源燦爛弧菌12B01(Vibrio splendidus12B01)轉運、降解褐藻酸寡糖的操縱子連同其兩側輔助基因整合到大腸桿菌染色體上, 使大腸桿菌獲得轉運和進一步降解褐藻酸寡糖的能力。將來源運動發酵單胞菌(Zymomonas mobilis)的丙酮酸脫羧酶和乙醇脫氫酶吉亞尼整合到大腸桿菌染色體上, 使褐藻酸降解產物能發酵成乙醇。為減小醋酸等副產物合成, 通過同緣重組, 使大腸桿菌喪失醋酸、丁酸、甲酸等合成能力。組合這些遺傳工程改良措施, 使成熟的工業發酵大腸桿菌獲得發酵褐藻酸生產乙醇的能力(圖3)。因為大腸桿菌本身能發酵甘露醇和葡聚糖, 遺傳工程改良大腸桿菌能發酵所有褐藻碳水化合物生產乙醇。將甘露醇轉化成果糖的甘露醇脫氫酶具有NAD+利用偏好, 會導致洗淘氧化還原太失衡, 但引入的褐藻酸轉運和降解途徑能利用NADH, 使甘露醇發酵效能提高。
到這里, 經遺傳工程修飾的成熟的工業大腸桿菌就能在無氧條件下同步發酵褐藻酸、甘露醇和葡聚糖(海帶等褐藻全部碳水化合物)生產乙醇。為進一步提高乙醇生產效率, Wargacki等[34]又將運動發酵單胞菌(Zymomonasmobilis)丙酮酸脫羧酶(pyruvate decarboxylase, Pdc)和乙醇脫氫酶 B(alcohol dehydrogenase B, AdhB)基因[39]整合到大腸桿菌染色體上。為減少發酵副產品, 如乳酸等, 他們失活了大腸桿菌的相關基因。
優化條件下, 獲得的工程大腸桿菌在 25~30℃發酵褐藻模擬糖組分(5 褐藻酸∶8 甘露醇 ∶1葡萄糖)能獲得20 g/L或2.4%(V/V)的乙醇產率。當發酵海帶(Laminaria japonica, 現調整為Saccharina japonica)碳水化合物時產生約4.7%(V/V)乙醇。這一濃度已達到最近報道的用釀酒酵母發酵纖維氨化膨脹(ammonia fiber expansion, AFEX)處理的玉米秸稈木質纖維素獲得的乙醇濃度(40 g/L或5.1%,V/V)[40]。這相當于每單位重生物質產約0.281單位重乙醇, 或每單位重總糖(褐藻酸、甘露醇、葡聚糖)產約 0.41單位重乙醇, 達到理論產量的80%以上。另外, 83%的乙醇是在48 h內產生的, 產率是0.64 g/(L·h)。糖消耗比是0.5 mol 甘露醇 ∶1mol褐藻酸。大腸桿菌可以代謝甘露醇和葡萄糖, 但褐藻酸同步發酵增加了乙醇濃度。因此, 褐藻酸發酵有助于修復甘露醇發酵導致的氧化還原狀態失衡。發酵海帶碳水化合物仍有低濃度(2g/L)乳酸積累, 這可能是甲基乙二醛酸途徑(methylglyoxylate pathway)導致的現象[41]。
4 適應生物乙醇生產的褐藻(主要是海帶)育種策略
生物乙醇可整合到現有燃油系統, 添加量可達10%。如改良發動機, 添加量可高達 85%[42]。2007年, 我國海帶栽培面積約400 km2, 總產約80萬t/hm2(干重), 平均每公頃 20.5t/hm2。褐藻理論產量59t/hm2[34]。我國栽培海帶每公頃產量只有理論值的35%, 提高單位面積產量還有巨大空間。種間雜交結合系統選育培育的品種(如901)產量增加70%[43], 商業栽培的雜交海帶(如東方2號、東方3號)單位面積產量提高 50%~60%[44-45], 單位面積產量只有理論值的一半左右。
大幅度提高單位面積產量將越來越困難, 但大幅提高單位面積光能轉化率空間巨大。海帶是冷水性藻, 盡管在我國栽培多年, 其栽培海域水溫超過其自然群體海域水溫, 也形成了次生野生群體(栽培海帶在栽培海域形成的群體, 生長勢弱), 但我國的海帶栽培沒有利用夏季高溫季節的豐富光能。如果能培育耐高溫或喜高溫海帶, 改變栽培模式, 實現全年、多輪、跨夏季栽培, 單位面積產量肯定會顯著提高。另外, 我國采用倒掛式浮繩網栽培模式, 海帶最敏感的生長點接近海面, 藻體頂端接受的光能隨生長逐步減少。如果能培育耐強光品種, 或耐弱光,或即耐強光也適應弱光的品種, 單位面積產量也能顯著提高。目前, 我國只有遼寧、山東和福建(小部分)近海栽培海帶。增加栽培總面積是提高總產量的根本出路。不論是耐高溫, 還是耐低溫, 不論是抗強光, 還是耐弱光海帶品種, 都能有效增加海帶總栽培面積, 延長栽培季節, 提高單位面積光能轉化率,有利于形成褐藻乙醇產業。
過去, 海帶遺傳改良基本上圍繞產量提高和抗逆性, 沒有涉及生化組分改良(可比擬作物品質改良)。但一度提出高糖(或富糖, 指葡聚糖)和低(甘露)醇品種培育目標。現在工程大腸桿菌可發酵褐藻全部碳水化合物生產乙醇。適應生物乙醇生產海帶生物質只要增加產量、改善抗逆性、增加栽培面積、改變栽培模式就行。實現與養殖動物的協調發展, 結合水質改良和環境修復, 即可獲得褐藻生物質, 也可以產生環境效益和生態效益。大幅提高海帶總產量也將為就業、農民增收做出顯著貢獻。
我國有海帶栽培面積約400 km2, 略小于膠州灣面積(446 km2)。如果達到理論年產量, 即59t/hm2, 按每單位重褐藻生物質生產0.254單位重乙醇計算, 每公頃每年可生產乙醇1.9萬L。這樣, 一個膠州灣可年產7.6億L乙醇, 是2010年我國年燃油消耗量(約90億L)的1/118。將5%燃油替換成生物乙醇, 只需要用 6個膠州灣面積海域栽培海帶, 并達到理論產量。這不到我國海域面積(約300萬km2)的千分之一。最為關鍵的是, 栽培海帶不需淡水、不需土地、不使用化肥, 對解決當前人口、環境、能源等重大問題具有特殊意義。
5 結語
海帶是不可多得的適用生物乙醇生產的生物質。我國是最大規模栽培海帶的國家, 也是海帶生物學研究和遺傳育種強國。盡管在遺傳工程修飾成熟工業微生物發酵褐藻碳水化合物生產乙醇方面我國已落后他國, 但我國有豐富的褐藻生物質資源。重視源頭技術開發、倡導發酵褐藻碳水化合物生產乙醇, 有望使我國躋身發酵褐藻生物質生產乙醇國家前列。
[1] Alper H, Stephanopoulos G. Engineering for biofuels: Exploiting innate microbial capacity or importing biosynthetic potential[J].Nat Rev Microbiol, 2009, 7: 715-723.
[2] Rubin E M. Genomics of cellulosic biofuels[J]. Nature, 2008, 454: 841-845.
[3] Hellmann F, Verburg P H. Impact assessment of the European biofuel directive on land use and biodiversity[J]. J Environ Manage, 2010, 91: 1389-1396.
[4] Melillo J M, Reilly J M, Kicklighter D W, et al. Indirect emissions from biofuels: How important[J]. Science, 2009, 326: 1397-1399.
[5] Stephanopoulos G. Challenges in engineering microbes for biofuels production[J].Science, 2007, 315: 801-804.
[6] Roesijadi G, Jones S B, Snowden-Swan L J, et al. Macroalgae as a biomass feedstock: A preliminary analysis[M]. USA: Pacific Northwest National Laboratory. 2010.
[7] Somerville C, Youngs H, Taylor C, et al. Feedstocks for lignocellulosicbiofuels[J].Science, 2010, 329: 790-792.
[8] Waltz E. Biotech’s green gold[J].Nat Biotechnol, 2009, 27: 15-18.
[9] Mussatto S I, Teixeira J A. Lignocellulose as raw material in fermentation processes[M]. Méndez-Vilas A. Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology. Spain: Formatex Research Center. 2010.
[10] Wyman C E. What is (and is not) vital to advancing cellulosic ethanol[J]. Trends in Biotechnology, 2007, 25: 153-157.
[11] Carroll A, Somerville C. Cellulosic biofuels[J]. Annual Review of Plant Biology, 2009, 60: 165-182.
[12] Ragauskas A J, Williams C K, Davison B H, et al. The path forward for biofuels and biomaterials[J].Science, 2006, 311: 484-489.
[13] Balagurunathan B, Jonnalagadda S, Tan L, et al. Reconstruction and analysis of a genome-scale metabolic model forScheffersomyces stipitis[J]. Microbial Cell Factories, 2012, 11: 27-33.
[14] Jeffries T W, Grigoriev I, Grimwood J, et al. Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeastPichia stipitis[J]. Nat Biotechnol, 2007, 25: 319-326.
[15] K?tter P, Ciriacy M. Xylose fermentation bySaccharomyces cerevisiae[J].Appl Microbiol Biotechnol, 1993, 38: 776-783.
[16] Tantirungkij M, Nakashima N, Seki T, et al. Construction of xylose-assimilatingSaccharomyces cerevisi-ae[J]. Journal of Fermentation and Bioengineering, 1993, 75: 83-88.
[17] Ho N W Y, Chen Z, Brainard A P. Genetically engineeredSaccharomycesyeast capable of effective cofermenttion of glucose and xylose[J].Appl Environ Microbiol, 1998, 64: 1852-1859.
[18] Jin Y S, Ni H, Laplaza J M, et al. Optimal growth and ethanol production from xylose by recombinantSaccharomyces cerevisiaerequire moderate D-xylulokinaseactivity[J]. Appl Environ Microbiol, 2003, 69: 495-503.
[19] Toivari M H, Aristidou A, Ruohonen L, et al. Conversion of xylose to ethanol by recombinantSaccharomyces cerevisiae: importance of xylulokinase (XKS1) and oxygen availability[J]. Metab Eng, 2001, 3: 236-249.
[20] Verduyn C, van Kleef R, Frank J, et al. Properties of the NAD(P)H-dependent xylose reductase from the xylose-fermenting yeastPichia stipitis[J]. Biochem J, 1985, 226: 669-677.
[21] Rizzi M, Harwart K, Bui-Thanh N A, et al. A kinetic study of the NAD+-xylitol-dehydrogenase from the yeastPichia stipitis[J].J Ferment Bioeng, 1989, 67: 25-30.
[22] Galazka J M, Tian C, Beeson W T, et al. Cellodextrin transport in yeast for improved biofuel production [J].Science, 2010, 330: 84-86.
[23] Ha S J, Galazka J M, Kim S R, et al. EngineeredSaccharomyces cerevisiae capable of simultaneous cellobiose and xylose fermentation[J]. PANA, 2011, 108: 504-509.
[24] Kim H S, Lee C G, Lee E Y. Alginate lyase: structure, property, and application[J]. Biotechnology and Bioprocess Engineering, 2011, 16: 843-851.
[25] Adams J M, Gallagher J A, Donnison I S. Fermentation study onSaccharina latissimafor bioethanol production considering variable pre-treatments[J].J Appl Phycol, 2009, 21: 569-574.
[26] Horn S J, Aasen I M, ?stgaard K. Production of ethanol from mannitol byZymobacter palmae[J].Journal of Industrial Microbiology & Biotechnology, 2000(a), 24: 51-57.
[27] Horn S J, Aasen I M, ?stgaard K. Ethanol production from seaweed extract[J].Journal of Industrial Microbiology & Biotechnology, 2000(b), 25: 249-254.
[28] Ochiai A, Yamasaki M, Mikami B, et al. Crystallization and preliminary X-ray analysis of an exotype alginate lyase Atu3025 fromAgrobacterium tumefaciensstrain C58, a member of polysaccharide lyase family 15[J]. Acta Cryst F, 2006, 62: 486-488.
[29] Preiss J, Ashwell G. Alginic acid metabolism in bacteria. II. The enzymatic reduction of 4-deoxy-L-erythro-5-hexoseulose uronic acid to 2-keto-3-deoxy-D-gluconic acid[J]. J Biol Chem, 1962, 237: 317-321.
[30] Wong T Y, Preston L A, Schiller N L. Alginate lyase: Review of major sources and enzyme characteristics, structure-function analysis, biological roles, and applications[J]. Annu Rev Microbiol, 2000, 54: 289-340.
[31] Murata K, Kawai S, Mikami B, et al. Superchannel of bacteria: Biological significance and new horizons[J]. Biosci Biotechnol Biochem, 2008, 72: 265-277.
[32] Takase R, Ochiai A, Mikami B, et al. Molecular identification of unsaturated uronatereductase prerequisite for alginate metabolism inSphingomonassp. A1[J].Biochem Biophyicss Acta, 2010, 1804: 1925-1936.
[33] Takeda H, Yoneyama F, Kawai S, et al. Bioethanol production from marine biomass alginate by metabolically engineered bacteria[J]. Energy Environ Sci, 2011, 4: 2575-2581.
[34] Wargacki A J, Leonard E, Win M N, et al. An engineered microbial platform for direct biofuel production from brown macroalgae[J]. Science, 2012, 335: 308-313.
[35] Li J W, Dong S, Song J, et al. Purification and characterization of a bifunctional alginate lyase fromPseudoalteromonassp. SM0524[J]. Mar Drugs, 2011, 9: 109-123.
[36] Kj?rgaard K, Hasman H, Schembri M A, et al. Antigen 43-mediated autotransporter display, a versatile bacterial cell surface presentation system[J]. J Bacteriol, 2002, 184: 4197-4204.
[37] Hashimoto W, Kawai S, Murata K. Bacterial supersystem for alginate import/metabolism and its environmental and bioenergy applications[J]. Bioengineered Bugs, 2010, 1: 97-109.
[38] Hugouvieux-Cotte-Pattat N, Reverchon S. Two transporters, TogT and TogMNAB, are responsible for oligogalacturonide uptake inErwiniachrysanthemi3937 [J]. Molecular Microbiology, 2001, 41: 1125-1132.
[39] Ohta K, Beall D S, Mejia J P, et al. Genetic improvement ofEscherichia colifor ethanol production: chromosomal integration of Zymomona smobilis genes encoding pyruvate decarboxylase and alcoholdehydrogenaseII[J]. Appl Environ Microbiol, 1991, 57: 893-900.
[40] Lau M W, Dale B E. Cellulosic ethanol production from AFEX-treated corn stover usingSaccharomyces cerevisiae424A (LNH-ST)[J]. PNAS, 2009, 106: 1368-1373.
[41] Yomano L P, York S W, Shanmugam K T, et al. Deletion of methylglyoxal synthase gene (mgsA) increased sugar co-metabolism in ethanol-producingEscherichia coli[J]. Biotechnol Lett, 2009, 31: 1389-1398.
[42] Sun Y, Cheng J. Hydrolysis of lignocellulosic materials for ethanol production: A review[J]. Bioresource Technology, 2002, 83: 1-11.
[43] Zhang Q, Tang X, Cong Y, et al. Breeding of an eliteLaminariavariety 90-1 through inter-specific gametophyte crossing[J]. Journal of Applied Phycology, 2007, 19: 303-311.
[44] Li X, Liu J, Cong Y, et al. Breeding and trial cultivation of Dongfang No. 3, a hybrid ofLaminariagametophyte clones with a more than intraspecific but less than interspecific relationship[J]. Aquaculture, 2008, 280: 76-80.
[45] Li X, Cong Y, Yang G, et al. Trait evaluation and trial cultivation of Dongfang no.2, the hybrid of a male gametophyte clone ofLaminaria longissima(Laminarials, Phaeophyta) and a female one ofL. japonica[J]. Journal of Applied Phycology, 2007, 19: 139-151.
(本文編輯: 康亦兼)
Q178.53
A
1000-3096(2014)04-0088-08
10.11759/hykx20130307002
2013-03-07;
2013-08-26
中國海洋大學海洋生物多樣性與進化研究所開放課題
楊官品(1963-), 男, 湖北荊州人, 教授, 博士生導師, 主要從事海洋生物方面的研究, 電話: 0532-82031636, E-mail: yguanpin@mail.ouc.edu.cn

