凍融作用下寒溫帶針葉林土壤碳氮礦化過程研究
羅亞晨,呂瑜良,楊浩,何念鵬,李勝功,高文龍,3
1. 西南大學地理科學學院,重慶 400715;2. 中國科學院地理科學與資源研究所,生態系統觀測與模擬重點實驗室,北京 100101;3. 中國科學院大學,北京 10049
凍融作用下寒溫帶針葉林土壤碳氮礦化過程研究
羅亞晨1,2,呂瑜良1,楊浩2*,何念鵬2,李勝功2,高文龍2,3
1. 西南大學地理科學學院,重慶 400715;2. 中國科學院地理科學與資源研究所,生態系統觀測與模擬重點實驗室,北京 100101;3. 中國科學院大學,北京 10049
以大興安嶺落葉松林土壤為研究對象,設置8 ℃恒溫和-5~8 ℃凍融循環(1個凍融循環為在-5 ℃培養24 h,后在8 ℃培養24 h)2個處理,進行30 d的室內培養實驗,探討了寒溫帶針葉林土壤在凍融交替時期的碳氮礦化過程及其相互關系。結果表明,培養溫度和培養時間對土壤碳礦化速率和碳礦化累積量均有顯著影響。第1次和第5次凍融循環后,凍融處理土壤的碳礦化速率顯著高于恒溫培養下土壤的碳礦化速率;第7次和第15次凍融循環后,凍融土壤碳礦化累積量顯著低于恒溫土壤的碳礦化累積量。土壤氮礦化速率沒有受到培養溫度、培養時間以及二者交互作用的影響,但培養時間和培養溫度對土壤凈氮礦化累積量有顯著的影響。第5、7、15次凍融循環后,凍融處理的土壤無機氮凈礦化累積量低于恒溫培養的土壤無機氮凈礦化累積量。經過30 d的培養,恒溫處理下的土壤碳、氮礦化累積量(碳累積量:92.82 μg·g-1,氮累積量73.76 mg·kg-1)是凍融處理下(碳累積量:65.51 μg·g-1,氮累積量33.45 mg·kg-1)的1.42倍和2.21倍。土壤碳礦化累積量與土壤凈氮礦化累積量均為正相關關系,但在相同的碳釋放量下凍融循環處理土壤累積的無機氮較少。以上結果表明,凍融循環減少了大興安嶺寒溫帶落葉松林土壤碳排放和無機氮的累積,有利于土壤碳的固持和減少養分的流失。
北方森林;凍融循環;土壤碳釋放;銨態氮;硝態氮;微生物生物量
凍融現象是由于季節性或晝夜溫度的變化使土壤反復出現凍結-融化的過程,是高緯度地區和山區普遍存在的自然現象(伍星和沈珍瑤,2010)。凍融循環的頻率和強度主要取決于氣候氣溫和冬季積雪的厚度。在全球變化的背景下,變暖可能會降低凍融循環的強度、頻率和持續時間;而減少的積雪厚度可能會加強凍結的過程(Matzner和Borken,2008)。
凍融循環通過改變土壤的物理性質、水熱條件、微生物種類組成和活性,改變土壤的碳氮循環,進而影響土壤可利用碳氮的流失和植物對土壤養分的吸收(Schimel和Clein,1996;Schimel等,2004;Matzner和Borken,2008)。凍融循環對土壤碳氮礦化過程影響的研究是近年來生態學研究的熱點問題之一。凍融對土壤碳氮礦化的影響結果是不一致的,有正效應、負效應和沒有效應,主要取決于土壤本身的特性和凍融的溫度、頻率和持續時間。通常認為,在較低的凍結溫度下,凍融循環破壞了土壤團聚體的組成結構,促進了土壤可溶性有機碳(DOC)和可溶性有機氮(DON)的釋放、土壤膠體解吸附NH4+離子;使部分微生物細胞膜破裂釋放有機碳和有機氮;促使根系死亡(Fitzhugh等,2001;Herrmann和Witter,2002;Sharma等,2006)。這些微生物呼吸底物的增加使得土壤碳氮礦化速率增加。而在較高的凍結溫度下,凍融循環對碳氮礦化過程的影響取決于不同的土壤特性、植被類型和凍結溫度。例如,-5 ℃左右的凍結溫度降低了耕地土壤微生物的活性(Herrmann和Witter,2002;D?rsch等,2004),但是沒有改變高山和極地土壤的微生物活性(Lipson等,2000;Lipson等,2002;Grogan等,2004)。有可能是高山和極地土壤微生物適應了低溫環境,從而對-5 ℃的凍結溫度并不敏感。Neilsen等(2001)對糖槭林(Acer saccharum Marsh)和黃樺林(Betula alleghaniensis Britton)土壤培養實驗研究表明,相比于對照處理來說,-3 ℃的凍融過程輕微地促進了土壤CO2的排放,沒有明顯改變氮礦化,并且黃樺林土壤的CO2釋放量明顯高于糖戚林土壤。對挪威云杉林(picea abies L. Karst)土壤的研究表明,-8 ℃的凍融循環降低了土壤氮礦化量(Hentschel等,2008),增加了CO2排放(Goldberg等,2008)。此外,野外的雪移除實驗也表明,雪移除改變的凍融循環有的是通過影響土壤的物理結構促進了土壤無機氮的增加(Freppaz等,2008),有的是通過降低微生物的活性而抑制了無機氮的產生(Tan等,2014)。因此,對于較高凍結溫度的凍融循環過程對土壤碳氮礦化過程的影響沒有一致性的結論,仍然需要針對不同的土壤進行進一步的研究。
大多數關于凍融循環和土壤碳氮礦化的關系的研究僅僅分別關注了凍融對碳礦化和氮礦化的影響,而對于凍融作用下碳氮礦化關系的分析很少。氮礦化和碳礦化之間的關系很大程度上取決于分解底物的C∶N比和微生物碳利用效率(Murphy等,2003)。添加可利用的碳源或者氮源會改變碳氮礦化之間的關系(Song等,2011)。那么,凍融循環作用下土壤DOC和DON等土壤微生物可利用的碳氮底物的改變,是否會改變土壤碳氮礦化之間的關系,不得而知。本文采用室內培養實驗,以大興安嶺興安落葉松林土壤為研究對象,分析-5~8 ℃凍融和8 ℃恒溫條件下土壤碳氮礦化的變化過程以及碳氮礦化的相互關系,有利于深入理解秋末春初凍融作用下的土壤碳氮循環過程。
1 材料和方法
1.1 樣地概況
實驗樣地屬于內蒙古根河國家野外科學觀測研究站以東的開拉氣林場。該林場位于大興安嶺西北坡(50°49′~50°51′N,121°30′~121°31′E),海拔826 m,地勢平坦,坡度小于3°。該區域屬于寒溫帶半濕潤氣候,年均氣溫-5.4 ℃,年降水量450~550 mm,其中60%集中在6─8月。秋季日最高溫月平均值為10.6 ℃,日最低溫月平均值為-4.7 ℃;春季日最高溫月平均值為6.6 ℃,日最低溫月平均值為-11.1 ℃(劉麗和王曉紅,2008)。9月末到翌年5月初為降雪期,降雪厚度20~40 cm,降雪量占全年降水總量的12%。全年地表蒸發量800~1200 mm,年均日照2594 h,無霜期80 d。該區為大片連續多年凍土帶的南緣,土壤為發育于花崗巖殘積物上的暗棕壤,土層厚度30~40 cm,其中礦質層石礫較多。土壤主要理化性質如下:腐殖質含量10%~30%,全氮2.9~4.7 g·kg-1,全磷0.5~1.1 g·kg-1,pH值為4.5~6.5,土壤容重0.15~0.74 g·cm-3(Gao等,2013)。植被類型為杜香-落葉松林,林齡約為200年,主要物種為興安落葉松(Larix gmelini)、白樺(Betula platyphylla)、杜香(Ledum palustre)、杜鵑(Rhododendron simsii)、紅豆越橘(Vaccinium Vitisidaea)等。
1.2 樣品采集與處理
我們選擇了9個10 m×20 m的樣方,每個樣方間隔10 m。2013年10月,土壤秋季凍融之前進行樣品采集。在每個樣方內,去除地表凋落物后,用土鉆取0~10 cm土壤樣品,6點形成1個混合樣品。總計9個土壤樣品。取樣后過4 mm篩,手工挑除根系和雜質。放入凍干機中進行凍干,以便于保持微生物活性和室內培養過程中調節土壤含水量。
1.3 室內培養及測定
培養實驗設置-5~8 ℃凍融循環和8 ℃恒溫對照2個溫度處理。其中,-5~8 ℃凍融循環處理是先將樣品放入-5 ℃冰箱中凍結24 h,后將樣品放入8 ℃恒溫培養箱中融化24 h,如此為1個凍融循環。8 ℃對照處理設計為將樣品放入恒溫培養箱中8 ℃恒溫培養。土壤含水量統一調節為60%土壤飽和含水量,即含水量為35.5%。土壤飽和含水量采用簡易法(代景忠等,2012)測定,3次重復。
培養實驗開始前,稱取凍干的土壤樣品,用小噴壺將去離子水均勻噴至土上,將土壤含水量調節至60%土壤飽和含水量。隨后,在150 mL塑料圓瓶中裝入33 g左右(干重25 g左右)調節好含水量的土壤樣品,用于測定土壤碳礦化速率;另將250 g左右調節好含水量的土壤樣品裝于塑料方瓶內,用于分次測定土壤NH4+-N和NO3--N含量。所有瓶子蓋蓋(留有通氣孔)在8 ℃培養箱中預培養2 d后,測定土壤碳礦化速率和土壤NH4+-N和NO3--N含量。隨后,凍融循環處理的培養樣品放入-5 ℃的冰箱中,恒溫處理部分的培養樣品繼續留在8 ℃培養箱中培養。此后在30 d的培養期內,分別在第1、3、5、7和15次凍融循環完成后(即培養的第2、6、10、14和30天)測定土壤碳礦化速率和土壤NH4+-N和NO3--N含量。培養過程中,每隔5 d采用稱重法給培養樣品補水一次,將去離子水均勻噴灑在土壤表面。
土壤碳礦化速率采用土壤微生物呼吸速率測定系統進行測定,詳見代景忠等(2012)。土壤無機氮(NH4+-N,NO3--N)采用0.5 mol·L-1硫酸鉀(K2SO4)浸提,含量采用流動化學分析儀(Bran Luebbe,Germany)測定。土壤微生物生物量碳(MBC)采用氯仿熏蒸法(chloroform fumigation-extraction method,FE)測定。稱取10 g左右新鮮土樣放入50 ml的玻璃燒杯中。燒杯放入真空干燥器中,在真空干燥器底部放入少量用去離子水濕潤過的濾紙以保持濕度。另外,放置一個裝有30~50 mL氯仿的燒杯,燒杯中放入少量沸石以防止暴沸。真空干燥器密封后用真空泵抽至燒杯中的氯仿沸騰1~2 min,將活塞關閉,將干燥器放入一恒溫培養箱中,在25~28 ℃下暗室培養24 h。同時稱取10 g的同一份土樣,置于50 mL廣口塑料瓶中,加入100 mL 0.5 mol·L-1K2SO4,放在振蕩器上以180 r·min-1速度振蕩1 h,停止振蕩后靜置30 min,將樣品過濾至小塑料瓶中放入冰柜冷凍。熏蒸培養結束后取出真空干燥器,用真空泵反復抽去殘余氯仿,土樣同上提取保存提取液。浸提液采用TOC儀測定,土壤微生物生物量碳(MBC)計算公式如下:
MBC=(熏蒸后土壤提取液中的有機C-未熏蒸土壤提取液中的有機C)×2.2,單位mg·kg-1(林先貴等,2010)。
1.4 數據處理及統計分析
土壤碳礦化速率采用如下公式進行計算(代景忠等,2012):

式中:R為土壤微生物呼吸速率(μg·g-1·d-1,以C計),C為測試時間內CO2濃度變化的直線斜率,V是培養瓶和管線的總體積,m是培養瓶內土壤干重,α是CO2氣體質量轉化系數,β是時間轉化系數。
同時,我們對第一個凍融循環過程中土壤呼吸進行了詳細測定,在48 h中每隔20 min測量一次。經過測定發現,在一次凍融循環中,升溫過程和降溫過程各持續4個小時。一次凍融循環的全過程分為8~-5 ℃降溫(4 h)、-5 ℃恒溫(20 h)、-5~8 ℃升溫(4 h)和8 ℃恒溫(20 h)4個過程。據降溫和升溫過程中的土壤呼吸速率與土壤溫度進行擬合,兩者呈指數關系,分別表示為如下公式:
升溫:Y = 2.5987e0.0783X
降溫:Y = 1.5075e0.0747X
式中:Y為土壤呼吸速率(μg·g-1·d-1),X為土壤溫度。
我們假設-5 ℃恒溫(20 h)和8 ℃恒溫(20 h)過程中土壤呼吸速率呈線性變化。按照如下方法計算每個凍融循環過程中土壤呼吸累積量:利用第1、3、5、7、15凍融循環后實際測量的土壤呼吸速率,分別通過升溫和降溫公式計算出-5 ℃和8 ℃恒溫時的土壤呼吸速率,采用線性內插法計算土壤呼吸累積量。土壤無機氮凈礦化累積量(mg·kg-1·d-1,以N計)同樣采用線性內插法計算。
利用SPSS16.0統計軟件進行統計分析。采用單因變量多因素方差分析(Univariate ANOVAs)方法分析培養溫度、培養時間及其交互作用對大興安嶺寒溫帶針葉林0~10 cm表層土壤碳、氮礦化的影響,采用配對樣本T檢驗方法分析對比-5~8 ℃凍融處理和8 ℃恒溫處理土壤碳氮礦化的差異。利用SigmaPlot 10.0軟件進行繪圖。除特殊說明外,顯著性水平ɑ=0.05。
2 結果
2.1 凍融作用下土壤碳礦化的變化
培養溫度和培養時間對土壤碳礦化速率均具有顯著的影響(P=0.001和P=0.000,表1),且兩因素間存在顯著的交互效應(P=0.025,表1)。從培養溫度上看,總體來說,經過-5~8 ℃凍融循環處理后,土壤在融化階段的碳礦化速率要高于在8 ℃下恒溫培養的土壤,其中在第1次和第5次凍融循環后表現最為明顯(P=0.003和P=0.000,圖1a)。經過-5~8 ℃凍融循環處理的土壤,在融化階段總體上表現為隨著凍融循環次數的增加,土壤碳礦化速率降低,在5次凍融循環后,土壤碳礦化速率最低(圖1a)。在8 ℃恒溫培養條件下,隨著培養時間的增加,土壤碳礦化速率沒有明顯的降低或增加趨勢。
土壤碳礦化累積量受到培養溫度、培養時間以及二者交互作用影響極其顯著(P=0.000,表1)。隨著培養時間的增加,在第7次和第15次凍融循環后兩種處理間土壤碳礦化累積量表現出明顯差異(P=0.049和P=0.003,圖1b)。8 ℃恒溫培養條件下的土壤碳礦化累積量是-5~8 ℃凍融處理下的土壤的1.42倍(圖1b)。
2.2 凍融作用下土壤氮礦化的變化
土壤氮礦化速率沒有受到培養溫度、培養時間以及二者交互作用的顯著影響(P=0.281,P=0.236和P=0.186,表1)。在第5次和第15次凍融循環,-5~8 °C凍融處理的土壤氮礦化速率顯著低于8 °C恒溫土壤(P=0.000和P=0.001)。

表1 溫度、時間及其交互作用對不同培養條件下土壤碳氮礦化速率及碳氮礦化累積量影響的單因變量多因素方差分析Table 1 Results of Univariate ANOVAs of the effects of temperature and time on the Soil C and N mineralization rate and accumulated C and N mineralization

圖1 土壤碳礦化速率和土壤碳礦化累積量的動態變化Fig. 1 Dynamics of soil C mineralization rate and accumulated C mineralization
培養溫度和培養時間則對土壤無機氮的凈礦化累積量產生了極其顯著的影響(P=0.001和P=0.000,表1)。在8 ℃恒溫條件下培養2 d后,土壤氮礦化累積量為-2.04 mg·kg-1,說明在這一階段土壤中的微生物以對氮的固持為主(圖2b);經過6 d的恒溫培養,土壤無機氮礦化累積量增加到13.56 mg·kg-1,且在之后的培養過程中隨著時間的延長而逐漸增加,經過30 d的培養,土壤無機氮凈礦化累積量顯著增加(圖2b)。凍融循環處理的土壤,經過1次凍融循環后同樣出現氮固持現象,其土壤氮礦化累積量為-0.83 mg·kg-1(圖2b);隨培養時間的增加,土壤氮礦化累積量呈增加趨勢。對比8 ℃恒溫和-5~8 ℃凍融2種處理,凍融循環處理的土壤在5次、7次和15次循環后,其土壤氮礦化累積量顯著低于恒溫部分(P=0.004,P=0.001和P=0.000,圖2b),可見凍融交替會減少土壤中有效氮的累積。經過15次的凍融循環后,凍融處理土壤的凈氮礦化累積量為恒溫土壤的45.3%。
2.3 凍融作用下土壤微生物生物量碳的變化
土壤微生物生物量碳在凍融和恒溫培養條件下,培養前后沒有出現顯著差異(P=0.906和P=0.964)。-5~8 ℃凍融處理的土壤微生物生物量碳稍有降低,而8 ℃恒溫對照土壤的微生物生物量碳則稍有增加(圖3)。
2.4 凍融作用下土壤碳氮礦化的關系
8 ℃恒溫培養條件下的土壤碳礦化量與土壤氮礦化量呈正相關關系(圖4),即土壤釋放的CO2量越多,土壤中的無機氮含量也越高。經過-5~8 ℃凍融循環處理,土壤的碳礦化量與氮礦化量也同樣表現出正相關關系(圖4)。與8 ℃恒溫培養相比,在具有相同的土壤碳排放的情況下,經過凍融的土壤中無機氮的累積量更少。
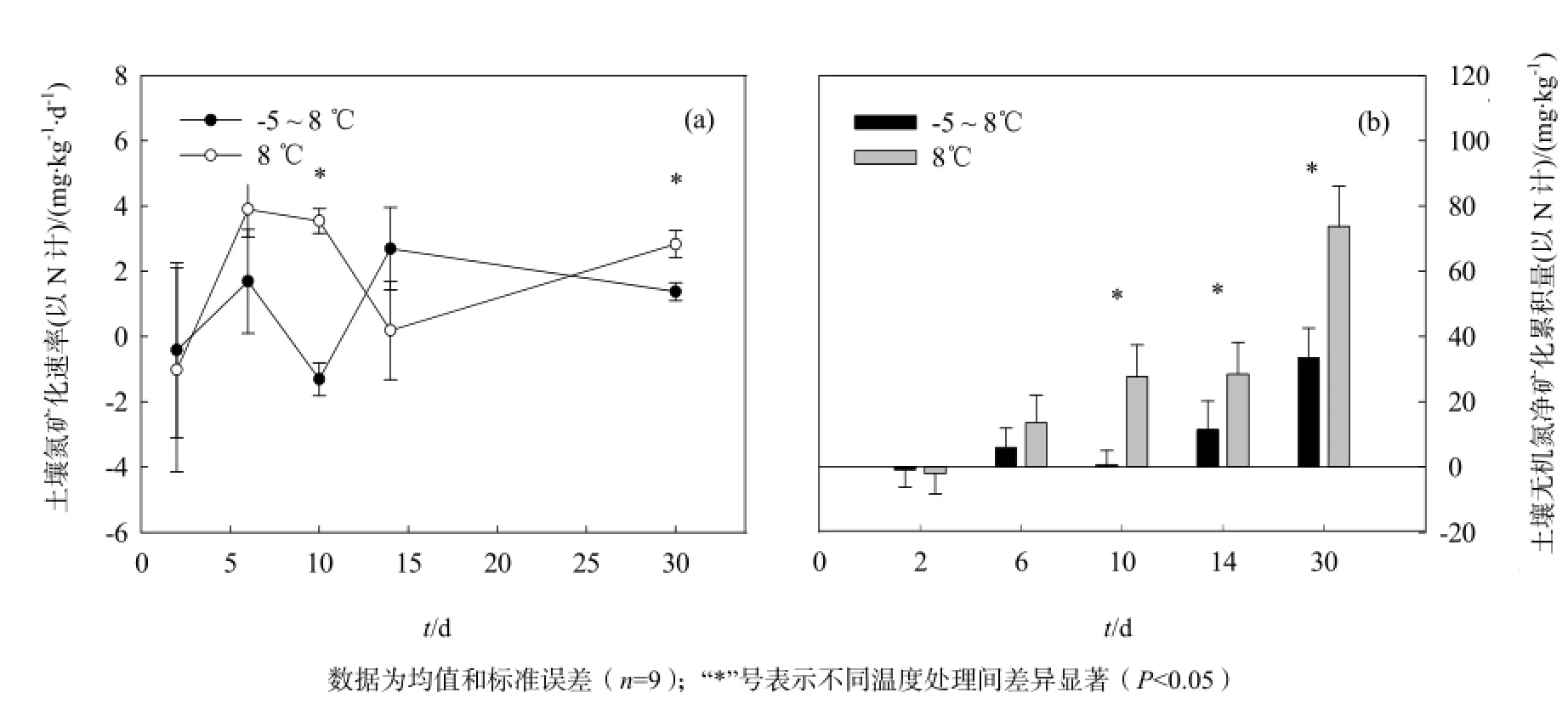
圖2 土壤氮礦化速率和氮礦化累積量的動態變化Fig. 2 Dynamics of Soil N mineralization rate and accumulated N mineralization

圖3 土壤微生物生物量碳的培養前后的變化Fig. 3 Dynamics of Soil MBC in the 30 d incubation

圖4 土壤碳礦化累積量和氮礦化累積量的關系Fig. 4 Relationship of accumulated C mineralization and accumulated N mineralization
3 討論
3.1 凍融對土壤碳礦化的影響
土壤碳礦化的過程是由微生物主導的。微生物可利用的底物和微生物生長過程都受到溫度的影響。凍結促使微生物活性降低,而融化促使微生物活性恢復或增加。我們的研究結果表明,相比于恒溫處理,1個凍融循環處理后,微生物呼吸顯著增加;隨著凍融循環次數的增加,凍融作用對微生物呼吸的刺激效果逐漸消失,2種處理土壤的碳礦化速率均逐漸降低(圖1)。我們的這一結果,與前人的研究結果是一致的(賈國晶等,2012)。在凍融初期,連續的凍融循環破壞了土壤團聚體結構,使大團聚體破碎成小團聚體,有利于被土壤團聚體吸附的小分子物質釋放(李忠佩和張桃林,2004),增加了土壤可利用碳氮。同時,盡管微生物在低溫下仍有活性,-5 ℃的凍結溫度也殺死了部分微生物。在融化階段,死亡微生物可以作為存活微生物的分解底物(Zhou等,2011;Neilsen等,2001)。微生物可利用底物的增加是凍融初期土壤碳礦化速率較高的主要原因。隨著凍融循環次數的增加,分解底物逐漸被耗盡,同時,微生物死亡的絕對數量也在減少,使得土壤碳礦化速率逐漸下降。因此,短期來看,凍融促進了碳礦化;而長期來看,由于受到分解底物的限制,兩者的碳礦化速率并無顯著差異。在土壤碳礦化的累積量上,溫度是主要決定因素。相比于恒溫處理,凍融循環過程中土壤微生物有一半左右的時間處于低溫低活性的狀態下。盡管融化的過程中微生物活性得以恢復,凍融處理土壤的總碳釋放量仍然低于恒溫對照。
3.2 凍融對土壤氮礦化的影響
目前關于凍融交替對土壤氮礦化的影響的研究表明,凍融循環有利于土壤中無機氮的增加(Grogan P等,2003),土壤微生物也是影響土壤氮礦化的重要因素。Marumoto等(1982)研究發現土壤中大部分礦化的N并不是直接來自土壤有機物質,而是由死亡微生物所釋放的。凍融過程中部分微生物死亡,使得細胞內物質滲出,成為土壤中礦質氮的直接來源。同時死亡的微生物為土壤中殘留微生物提供了有效碳源,刺激了殘留微生物的活性,有利于融化階段土壤氮礦化效率的提高(Herrmann A和Witter E,2002)。此外,凍融會改變土壤的物理結構,溫度的變化使得土壤交替收縮和膨脹,導致土壤晶格開放,釋放出固定的NH4+(Ferris J C,2000)。
我們的研究結果表明,經過10 d(5次凍融循環)的培養,2種培養條件下的土壤無機氮凈礦化累積量差異顯著,凍融處理土壤的氮礦化累積量明顯低于恒溫培養下的土壤,這主要是受到不同培養溫度的影響(圖2)。在-5 °C的溫度處理下,可能微生物沒有出現大量地死亡,一是影響了由死亡微生物所釋放的礦質氮,同時也影響了能夠增加無機氮產生的底物。而在低溫下,微生物的活性也有所降低,雖然凍融循環可能使得土壤氮礦化速率在短期內得到提高,但其氮礦化累積量仍要低于在8 ℃恒溫培養下的土壤。我們的研究結果與相似冬季溫度的其他地區研究結果相近。例如,Neilsen等(2001)對美國新罕布什爾州糖戚林和黃樺林的土壤進行凍融培養實驗研究,發現-3 ℃的凍融過程沒有明顯改變氮礦化,而在更低的溫度條件──-13 ℃下,凍融過程促進了氮礦化。
3.3 土壤碳氮礦化的關系
微生物氮礦化的過程,是微生物利用可利用的碳源分解底物獲取氮的過程。在分解有機物的同時釋放的無機氮一部分被微生物自身固持,一部分被釋放到土壤中。土壤碳礦化和氮礦化的關系大部分為正相關關系(Scott等,1998;Parfitt等,2003),即微生物釋放CO2的同時也釋放無機氮。而在可利用碳氮都十分匱乏的土壤中,如青藏高原的高山草甸(Song等,2011),微生物分解有機物釋放的無機氮首先被微生物利用,在滿足微生物需求后才釋放到土壤中,土壤碳礦化和氮礦化的關系為負相關關系。添加碳源或者氮源,或者改變土壤溫度和濕度,都可以使土壤碳氮礦化的關系發生改變(Gao等,2009;Song等,2011)。在凍融條件下,土壤可利用性碳氮源由于土壤物理(團聚體破碎、解吸附等)和生物(溫度對微生物和酶的刺激作用)性質的改變而變化,這可能會影響土壤碳氮礦化的關系。我們的研究結果表明,大興安嶺落葉松土壤的碳氮礦化之間是正相關關系,凍融并沒有轉變這種正相關關系(圖4)。但是,在恒溫培養和凍融條件下,正相關關系的斜率不同。在相同的碳釋放量下,相比于恒溫培養,凍融循環減少了土壤無機氮的累積。可能的原因,一是凍融增加了微生物的呼吸;二是凍融促進了微生物氮固持,增加了微生物的氮利用效率;三是微生物種群可能發生了改變。具體原因還需要對凍融過程中土壤總氮礦化的過程、微生物種類的變化以及添加碳源或氮源后土壤碳氮礦化關系的改變等做進一步的細致研究。
4 結論
(1)相比于8 ℃恒溫培養,短期的-5~8 ℃凍融循環增加了大興安嶺寒溫帶針葉林土壤碳礦化速率。但是,長期來看,-5~8 ℃凍融循環下土壤碳釋放累積量較8 ℃恒溫培養低。
(2)相比于8 ℃恒溫培養,凍融循環處理的土壤在5次、7次和15次循環后,其土壤氮礦化累積量顯著低于8 ℃恒溫培養。凍融交替會減少土壤中的無機氮累積。
(3)8 ℃恒溫培養和-5~8 ℃凍融循環處理的土壤,其碳礦化量與土壤氮礦化量均呈正相關關系。但在相同的土壤碳排放的情況下,凍融不利于的土壤中有效氮的累積。
DORSCH P, PALOJARVIA A, MOMMERTZ S. 2004. Overwinter greenhouse gas fluxes in two contrasting agricultural habitats[J]. Nutrient Cycling in Agroecosystems, 70: 117-133.
FITZHUGH R D, DRISCOLL C T, GROFFMAN P M, et al. 2001. Effects of soil freezing disturbance on soil solution nitrogen, phosphorus, and carbon chemistry in a northern hardwood ecosystem[J]. Biogeochemistry, 56: 215-238.
FREPPAZ M, CELI L, MARCHELLI M, et al. 2008. Snow removal and its influence on temperature and N dynamics in alpine soils (Vallée d'Aoste, northwest Italy)[J]. Journal of Plant Nutrition and Soil Science, 171: 672-680.
GAO J Q, OUYANG H, XU X L, et al. 2009. Effects of temperature and water saturation on CO2production and nitrogen mineralization in alpine wetland soils[J]. Pedosphere, 19: 71-77.
GAO W L, CHENG SH L, FANG H J, et al. 2013. Effects of simulated atmospheric nitrogen deposition on inorganic nitrogen content and acidification in a cold-temperate coniferous forest soil[J]. Acta Ecologica Sinica, 33: 114-121.
GOLDBERG S D, MUHR J, BORKEN W, et al. 2008. Fluxes of climate-relevant trace gases between a Norway spruce forest soil and atmosphere during repeated freeze-thaw cycles in mesocosms[J]. Journal of Plant Nutrition and Soil Science, 171: 729-739.
GROGAN P, MICHELSEN A, AMBUS P, et al. 2004. Freeze-thaw regime effects on carbon and nitrogen dynamics in sub-arctic heath tundra mesocosms[J]. Soil Biology and Biochemistry, 36: 641-654.
HENTSCHEL K, BORKEN W, MATZNER E. 2008. Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil[J]. Journal of Plant Nutrition and Soil Science-Zeitschrift Fur Pflanzenernahrung Und Bodenkunde, 171: 699-706.
HERRMANN A, WITTER E. 2002. Sources of C and N contributing to the flush in mineralization upon freeze-thaw cycles in soils[J]. Soil Biology & Biochemistry, 34: 1495-1505.
LIPSON DA, SCHADT CW, SCHMIDT SK. 2002. Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt[J]. Microbial Ecology, 43: 307-314.
LIPSON DA, SCHMIDT SK, MONSON RK. 2000. Carbon availability and temperature control the post-snowmelt decline in alpine soil microbial biomass[J]. Soil Biology & Biochemistry, 32: 441-448.
MATZNER E, BORKEN W. 2008. Do freeze-thaw events enhance C and N losses from soils of different ecosystems? A review[J]. European Journal of Soil Science, 59: 274-284.
MURPHY DV, RECOUS S, STOCKDALE EA, et al. 2003. Gross nitrogen fluxes in soil: theory, measurement and application of15N pool dilution techniques[J]. In: Advances in Agronomy, 79: 69-118.
EILSON C B, GROFFMAN P M, HAMBURG S P, et al. 2001. Freezing effects on carbon and nitrogen cycling in northern hardwood forest soils[J]. Soil Science Society of America Journal, 65: 1723-1730.
PARFITT R L, SCOTT N A, ROSS D J, et al. 2003. Land-use change effects on soil C and N transformations in soils of high N status: comparisons under indigenous forest, pasture and pine plantation[J]. Biogeochemistry, 66: 203-221.
SCHIMEL J P, BILBROUGH C, WELKER J A. 2004. Increased snow depth affects microbial activity and nitrogen mineralization in two Arctic tundra communities[J]. Soil Biology & Biochemistry, 36: 217-227.
SCHIMEL J P, CLEIN J S. 1996. Microbial response to freeze-thaw cycles in tundra and taiga soils[J]. Soil Biology & Biochemistry, 28: 1061-1066.
SCOTT N A, PARFITT R L, ROSS D J, et al. 1998. Carbon and nitrogen transformations in New Zealand plantation forest soils from sites with different N status[J]. Canadian Journal of Forest Research-Revue Canadienne De Recherche Forestiere, 28: 967-976.
SHARMA S, SZELE Z, SCHILLING R, et al. 2006. Influence ofFreeze-Thaw Stress on the Structure and Function of Microbial Communities and Denitrifying Populations in Soil[J]. Applied and Environmental Microbiology, 72: 2148-2154.
SONG M H, JIANG J, XU X L, et al. 2011. Correlation between CO2efflux and net nitrogen mineralization and its response to external C or N supply in an alpine meadow soil[J]. Pedosphere, 21: 666-675.
TAN B, WU F Z, YANG W Q, et al. 2014. Snow removal alters soil microbial biomass and enzyme activity in a Tibetan alpine forest[J]. Applied Soil Ecology, 76: 34-41.
ZHOU W M, CHEN H, ZHOU L, et al. 2011. Effect of freezing-thawing on nitrogen mineralization in vegetation soils of four landscape zones [J]. Annals of Forest Science, 68: 943-951.
代景忠, 衛智軍, 何念鵬, 等. 2012. 封育對羊草草地土壤碳礦化激發效應和溫度敏感性的影響[J]. 植物生態學報, 36 (12): 1226-1236.
賈國晶, 周永斌, 代力民, 等. 2012. 凍融對長白山森林土壤碳氮礦化的影響[J]. 生態環境學報, 21(4): 624-628.
李忠佩, 張桃林. 2004. 可溶性有機碳的含量動態及其與土壤有機碳礦化的關系[J]. 土壤學報, 41(4): 544-552.
林先貴, 王一明, 尹睿, 等. 2010. 土壤微生物研究原理與方法[M]. 北京:高等教育出版社: 74-76.
劉麗, 王曉紅. 2008. 根河市近47年來氣溫變化特征[J]. 現代農業科技, 21: 332, 334.
伍星, 沈珍瑤. 2010. 凍融作用對土壤溫室氣體產生與排放的影響[J]. 生態學雜志, 29: 1432-1439.
Soil Carbon and Nitrogen Mineralization in A Larix gmelinii Forest during Freeze-thaw Cycles
LUO Yachen1,2, LV Yuliang1, YANG Hao2*, HE Nianpeng2, LI Shenggong2, GAO Wenlong2,3
1. School of Geographical Sciences, Southwest University, Chongqing 400715, China; 2. Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographical Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China
To investigate the mineralization of soil carbon (C) and nitrogen (N) of cold-temperate coniferous forest soil and their relationships during freeze-thaw cycles, we collected Larix gmelinii forest soil in the Daxinganling region and conducted a 30d laboratory incubation experiment with two treatments of control (constant 8 ℃) and freeze-thaw (each cycle: -5 ℃ in 24 h and then 8 ℃ in 24 h). Our results showed that incubation temperature and time had significant effects on soil C mineralization rates and C mineralization accumulated. After the 1stand 5thfreeze-thaw cycles the soil C mineralization rates were higher in the freeze-thaw treatment than in the control. The amounts of C mineralization accumulated in the freeze-thaw treatment were lower than those in the control after the 7thand 15thfreeze-thaw cycles. Incubation temperature and time had no effect on soil N mineralization rates while the N mineralization accumulated was significantly affected by both two factors. After the 5th, 7th, and 15thfreeze-thaw cycles the amounts of net N mineralization accumulated were higher in the control than in the freeze-thaw treatment. After 30d incubation the amounts of C and N mineralization accumulated were 1.42 and 2.21 times higher respectively in the control (C accumulated:92.82 μg·g-1, N accumulated 73.76 mg·kg-1) as against the freeze-thaw treatment (C accumulated:65.51 μg·g-1, N accumulated 33.45 mg·kg-1). Net N mineralization accumulated was positively correlated with C mineralization accumulated in both control and freeze-thaw treatments. But with the same carbon emission, N mineralization accumulated was less in the freeze-thaw treatment compared with control. Consequently, freeze-thaw cycles can decrease C emission and inorganic N accumulation of the cold-temperate coniferous forest soil in the Daxinganling region, which might improve soil C storage and decrease nutrient loss.
boreal forest; freeze-thaw cycles; soil carbon emission; NH4+; NO3-; microbial biomsss
S718.5
A
1674-5906(2014)11-1769-07
羅亞晨,呂瑜良,楊浩,何念鵬,李勝功,高文龍. 凍融作用下寒溫帶針葉林土壤碳氮礦化過程研究[J]. 生態環境學報, 2014, 23(11): 1769-1775.
LUO Yachen, LV Yuliang, YANG Hao, HE Nianpeng, LI Shenggong, GAO Wenlong. Soil Carbon and Nitrogen Mineralization in A Larix gmelinii Forest during Freeze-thaw Cycles [J]. Ecology and Environmental Sciences, 2014, 23(11): 1769-1775.
國家自然科學基金項目(31130009;31100336)
羅亞晨(1990年生),女,碩士研究生,從事土地利用與土壤環境研究。Email:xrldxrk1007@163.com
*通信作者:E-mail:yangh@igsnrr.ac.cn
2014-09-18

