黃芪用于阻斷宮頸癌前病變機制的研究
朱建楠,朱 艷
宮頸癌是僅次于乳腺癌在世界范圍內最常見的女性癌癥[1]。全球每年女性癌癥新發(fā)病例中9%為宮頸癌,8%的女性癌癥患者死于該病[2]。目前,已經證實70%宮頸癌的發(fā)生與兩種高危型人乳頭瘤病毒 (human papillomavirus,HPV)——HPV16和HPV18持續(xù)感染有關[3]。在臨床上對于感染HPV的女性尚缺乏有效的干預治療。黃芪是多年生草本植物,可增強機體免疫力、保護肝臟、抗衰老和抗菌,可用于癌癥的治療[4]。但對于宮頸癌前病變細胞的作用尚缺乏研究報道。本研究以宮頸永生化上皮細胞 (H8)作為宮頸癌前病變的體外實驗研究模型,研究不同濃度黃芪注射液抑制增殖和誘導凋亡的機制。
1 材料與方法
1.1 細胞株 H8購自上海拜力生物科技有限公司,用含10%胎牛血清的DMEM/HIGH培養(yǎng)液置于37℃、5%二氧化碳(CO2)的恒溫培箱中培養(yǎng),用0.25%乙二胺四乙酸(EDTA)胰酶消化傳代,取對數生長期細胞進行實驗。
1.2 藥物 黃芪注射液購自神威藥業(yè)集團有限公司,生產批號:12120342,10 ml/支 (相當于原藥材20 g)。
1.3 主要試劑 DMEM/HIGH培養(yǎng)基 (賽默飛世爾生物化學制品有限公司),Bioind優(yōu)級胎牛血清 (上海創(chuàng)未生物技術有限公司),Bcl-2、Bax抗體 (北京博奧森生物技術有限公司),p53抗體 (美國Proteintech Group公司);流式試劑盒(南京凱基生物科技發(fā)展有限公司)。
1.4 儀器 Olympus-LX70倒置顯微鏡;HEARcel 1150培養(yǎng)箱;超凈工作臺;中國DNM-9602G酶標分析儀;美國BD公司FACSCalibur流式細胞儀;美國Bio-Rad伯樂043BR119 12半干轉印儀;美國Bio-Rad伯樂041BR24044電泳槽;曝光顯影系統(tǒng)。
1.5 四甲基偶氮唑鹽微量酶反應比色法 (MTT法)檢測黃芪注射液對H8的影響 取對數生長期的H8用0.25%胰酶消化后制成單細胞懸液,調整細胞濃度,將細胞懸液接種于96孔板,100 μl/孔,共5組,每組設5個復孔。24 h后,藥物處理組分別換以含黃芪終濃度100、200、500、1 000 g/L的培養(yǎng)液孵育,空白對照組以DMEM培養(yǎng)液,藥物處理24、48、72 h后,每孔加入5 g/L的MTT 20 μl,繼續(xù)培養(yǎng)4 h,離心棄孔內上清液,每孔加入二甲基亞砜 (DMSO)150 μl,振蕩混勻10 min,使結晶溶解;用自動酶標讀數儀在波長為490 nm時測定每孔的光密度值 (即OD值)。細胞抑制率 (%)=(1-實驗組OD值/對照組OD值)×100%。
1.6 Annexin V-FITC/PI法檢測細胞凋亡率 取對數生長期的H8接種于6孔板,設實驗組和空白對照組,實驗組收集不同濃度的黃芪注射液處理48 h后的H8,用磷酸鹽緩沖液(PBS)洗滌細胞3次 (離心半徑13.5 cm,2 000 r/min,5 min),收集細胞于流式管中;加入500 μl的Buffer懸浮細胞;加入Annexin V-FITC和Propidium lodide各5 μl,室溫、避光反應5~15 min,流式細胞儀激發(fā)波長 (EX)=488 nm,發(fā)射波長 (EM)=530 nm測試細胞凋亡。
1.7 Western blotting法檢測Bcl-2、Bax及p53的表達 將H8接種于25 cm培養(yǎng)瓶,細胞貼壁后換液,加入黃芪注射液,使其終濃度分別為100、200、500、1 000 g/L。未加藥物的為空白對照組。常規(guī)收集經不同濃度藥物處理48 h的細胞,提取蛋白質后,加入20 μl上樣緩沖液。煮沸5 min后,在SDS-聚丙烯酰胺凝膠 (SDS-PAGE)上進行電泳。每孔加入20 μl樣品,加適量1×電泳緩沖液,接好正負電極。開始設為90 V恒壓,觀察marker的移動情況,電泳至分離膠底部時,終止電泳,轉移到聚偏氟乙烯 (PVDF)膜上,封閉1 h以上,分別加入1∶400稀釋的兔抗人Bcl-2、Bax單克隆抗體和1∶1 000稀釋的兔抗人p53單克隆抗體。搖床上4℃雜交過夜。取出PVDF膜,用TBST洗3次,5 min/次。再放入裝有1∶5 000稀釋的羊抗兔IgG-HRP的15 ml離心管中,搖床上雜交1 h。取出PVDF膜,用TBST洗3次,5 min/次。倒掉洗膜液,吸去多余液體,鋪于玻璃板上。將ECL試劑盒內的detection reagent 1與detection reagent 2等體積混合后,均勻滴在PVDF膜上,反應1~2 min。上機檢測。
1.8 統(tǒng)計學方法 采用SPSS 17.0統(tǒng)計軟件進行統(tǒng)計學處理,計量資料以 ()表示,多組間比較采用單因素方差分析、析因分析,以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 黃芪注射液對H8體外的增殖抑制作用 MTT法檢測結果顯示,不同濃度的黃芪注射液對H8都有一定的抑制作用,且呈時間和濃度的依賴性,各組細胞抑制率比較差異有統(tǒng)計學意義 (F組間=4.782,F時間=5.539,P<0.05,見圖1)。
2.2 黃芪注射液對H8凋亡的影響 Annexin V-FITC/PI法檢測結果顯示,4種濃度的黃芪注射液均可導致細胞的凋亡。經黃芪注射液干預48 h,凋亡率分別為空白對照組 (4.492±1.084)%、100 g/L組 (18.054±1.108)%、200 g/L組(29.368±1.115)%、500 g/L組 (37.090±2.652)%、1 000 g/L組 (54.614±3.052)%,各組間比較差異有統(tǒng)計學意義 (F=3.782,P<0.05,見圖2)。
2.3 Western blotting檢測Bcl-2、Bax、p53的表達 不同濃度的黃芪注射液 (100、200、500、1 000 g/L)干預48 h后,Bcl-2在空白對照組的表達量最高,在實驗組隨著藥物濃度的增加Bcl-2的表達量逐漸減少。Bax、p53在對照組的表達量最低,在實驗組隨著藥物濃度的增加Bax、p53的表達量逐漸增加 (見圖3)。
3 討論
宮頸癌近幾年的發(fā)病逐漸呈現了年輕化的趨勢,嚴重影響了女性的健康,其發(fā)病是由宮頸癌前病變逐漸衍變而來的。因此,控制癌前病變階段的發(fā)展成為預防宮頸癌的關鍵。
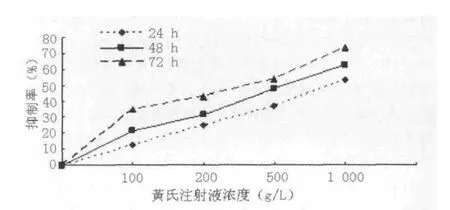
圖1 黃芪注射液對H8的抑制率Figure 1 Inhibition rate on H8 cells with astragalus membranaceus injection
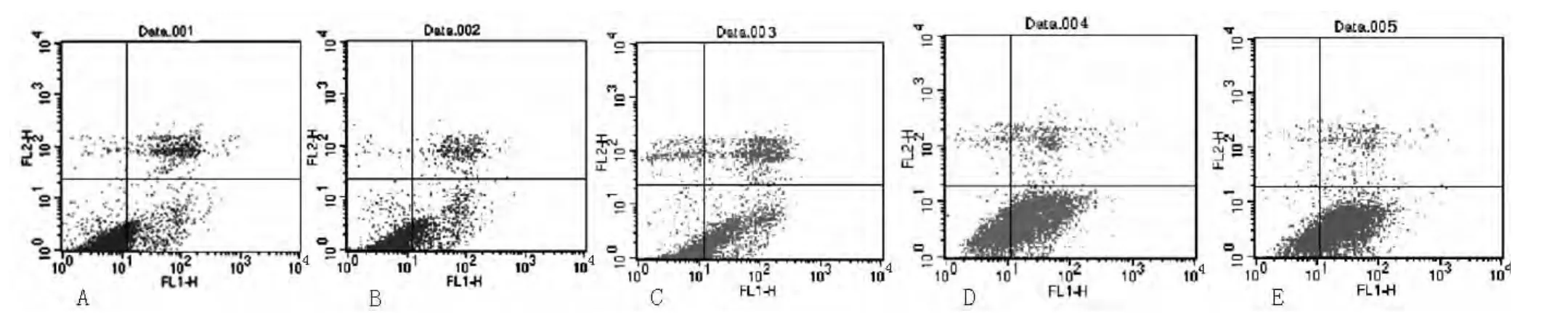
圖2 H8經黃芪注射液處理48 h的流式圖Figure 2 FCM showed effect of astragalus membranaceus injection on apoptosis of H8 cells after 48 h

圖3 Western blotting法檢測Bcl-2、Bax、p53的表達Figure 3 Expression of apoptosis related protein Bcl-2,Bax and p53 detected by western blotting
經大量研究證明,宮頸癌的發(fā)生與高危型HPV的持續(xù)、慢性感染密切相關,其中以HPV16/18型最多見[5]。H8是用含HPV16 E6/E7基因的rAV轉染胎兒宮頸上皮細胞獲得的,該細胞可以在體外無限傳代,但其本身不具有致瘤性。所以該細胞系可以作為宮頸癌前病變的體外研究模型[6-7]。
黃芪在傳統(tǒng)醫(yī)學中的應用已有數千年的歷史,相關研究一直受到人們的廣泛關注[8-9]。國內外研究表明,黃芪及其提取物的有效成分通過抑制某些腫瘤細胞 (宮頸癌、結腸癌、肺腺癌、子宮內膜癌、肝癌、乳腺癌、胃癌)的增殖和誘導腫瘤細胞的凋亡而具有一定的抗癌作用[10]。本實驗通過MTT法檢測,結果顯示黃芪注射液能夠明顯抑制H8的體外增殖,并且呈現時間劑量依賴關系。這與樊占兵等[11]的實驗結果相似。Annexin V-FITC/PI法檢測細胞凋亡表明,H8經不同濃度的黃芪注射液處理48 h后,發(fā)生了不同程度的凋亡且隨著藥物濃度的增加凋亡率逐漸增高。因此表明黃芪注射液可以誘導H8的凋亡。所以可以推測黃芪注射液對H8的體外增殖抑制作用可能與其誘導細胞凋亡有關。Western blotting法檢測Bcl-2、Bax、p53表達量表明,隨著藥物濃度的增加Bcl-2的表達量逐漸減少,Bax、p53的表達量逐漸增加,可以推測黃芪注射液誘導H8的凋亡與Bcl-2的表達量逐漸減少,Bax、p53的表達量逐漸增加有關[12]。這與徐經安等[13]的實驗結果相似。但是不同的細胞株對黃芪注射液的敏感度有所不同,這可能與不同細胞株之間的分子生物學差異有關系。
本研究結果可以為臨床上感染高危型HPV和宮頸癌前病變的治療提供一定的理論依據以及為中藥防治宮頸癌提供相關的實驗基礎。同時表明黃芪可以通過抑制細胞生長以及誘發(fā)凋亡作為一種防癌藥物在臨床中得以應用。但是具體是黃芪中的哪種有效成分具有防癌作用還有待于進一步研究和探討。
1 Ell K,Vourlekis B,Xie B,et al.Cancer treatment adherenceamong low-income women with breast or gynecologic cancer:A randomized controlled trial of patient navigation [J].Cancer,2009,115(19):4606-4015.
2 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
3 譚訓清.HPV與CIN、宮頸癌的關系探討 [J].中國現代醫(yī)學雜志,2012,22(5):107-109.
4 顧恪波,孫桂芝.黃芪及其提取物抗惡性腫瘤的研究進展 [J].遼寧中醫(yī)雜志,2012,39(7):1431-1432.
5 Jin XW,Sikon A,Yen-Lieberman B.Cervical cancer creening:Less testing,smarter testing [J].Cleve Clin J Med,2011,78(11):737-747.
6 汪廷樂,宋萌.人永生化細胞系模型建立的方法[J].上海口腔醫(yī)學,2010,19(2):212-215.
7 潘鎦鎦,萬小潔,章圣輝,等.鴉膽子油乳對宮頸永生化細胞體外增殖和凋亡的作用[J].中國婦幼保健,2013,28(5):834-837.
8 仝欣.黃芪主要活性成分的藥理作用 [J].時珍國醫(yī)國藥,2011,22(5):1246-1249.
9 張國用.中藥黃芪的藥理作用及其臨床應用研究[J].實用心腦肺血管病雜志,2012,20(6):1059.
10 王曉莉,蘇志紅,李妍芹,等.黃芪對體外培養(yǎng)人宮頸癌Hela細胞的抑制作用 [J].西北國防醫(yī)學雜志,2010,31(4):270-272.
11 樊占兵,李明,魏雙江,等.黃芪注射液對結腸癌SW480細胞的生長抑制作用 [J].中國醫(yī)藥導報,2011,8(18):33-34.
12 耿國軍,姜杰,杜好信,等.黃芪對肺腺癌細胞凋亡及Bcl-2、Bax表達的影響 [J].現代腫瘤醫(yī)學,2011,19(6):1080-1083.
13 徐經安,胡平.黃芪注射液聯合順鉑對Hela細胞生長的影響[J].新鄉(xiāng)醫(yī)學院學報,2013,30(3):172-174.

