大鼠神經干細胞的體外分離培養(yǎng)及分化研究
徐 鵬,宋斾文,章仁杰,劉 超,申才良
大鼠神經干細胞的體外分離培養(yǎng)及分化研究
徐 鵬1,宋斾文1,章仁杰1,劉 超2,申才良1
目的建立新生SD大鼠神經干細胞(NSCs)的分離培養(yǎng)、體外分化、鑒定及體外長期培養(yǎng)的方法,并探討血清濃度對NSCs分化的影響。方法取新生SD大鼠大腦組織,用無血清培養(yǎng)技術培養(yǎng)NSCs。采用免疫熒光技術對NSCs進行鑒定,檢測其巢蛋白(Nestin)表達。用含有不同胎牛血清(FBS)濃度(2%、5%、10%)的DMEM/F-12培養(yǎng)基誘導NSCs分化,分別用神經元特異性微管相關蛋白2(MAP-2)抗體、神經膠質細胞特異性膠質纖維酸性蛋白(GFAP)抗體行免疫熒光染色鑒定分化細胞。通過Western blot法檢測不同F(xiàn)BS濃度的分化條件下MAP-2與GFAP的表達情況。結果獲得大量未分化且懸浮生長的NSCs球,并能分化為神經元和神經膠質細胞。隨著血清濃度的增加,各組MAP-2的表達逐漸增加(P<0.05),GFAP的表達逐漸減少(P<0.05)。結論應用無血清培養(yǎng)技術可成功在體外培養(yǎng)出具有增殖、自我更新及多潛能分化能力的新生大鼠NSCs,可于含有不同F(xiàn)BS濃度(2%、5%、10%)的分化條件下進一步分化為神經元及神經膠質細胞,含低濃度血清的條件培養(yǎng)基促進NSCs向神經元方向分化,而高濃度血清則有利于NSCs向神經膠質細胞方向分化。
大鼠;神經干細胞;細胞培養(yǎng);免疫印跡
干細胞是一類可自我復制,同時又具有分化成多種組織細胞潛能的多能細胞。應用干細胞的多向分化潛能,尤其是神經干細胞(neural stem cells,NSCs)這一分布于神經系統(tǒng)的、具有自我更新和多分化潛能的細胞,能生成多種神經細胞,特別是神經元細胞,可有效地修復損傷的脊髓組織,重新建立神經間的連接,治療脊髓損傷(spinal cord injury,SCI)。早在1992年Reynolds et al[1]及Richards et al[2]從成年大鼠紋狀體及海馬中分離出了NSCs,隨后又在成年哺乳動物大腦紋狀體的室管膜下和海馬的顆粒層發(fā)現(xiàn)了NSCs聚集區(qū)。該實驗采用無血清培養(yǎng)法進行大鼠NSCs體外分離培養(yǎng),動態(tài)觀察其在體外增殖、分化等一系列細胞形態(tài)學變化,同時研究血清濃度對NSCs分化的影響,為細胞移植治療SCI的過程中如何進一步改善有利于NSCs神經生發(fā)的微環(huán)境提供依據。
1 材料與方法
1.1 實驗動物24h內新生SD大鼠幼鼠購于安徽醫(yī)科大學實驗動物中心,雌雄不限,共10只。
1.2 主要試劑DMEM/F12培養(yǎng)基購于美國Gibco公司;B-27購于美國Invitrogen公司;表皮生長因子(epidermal growth factor,EGF)和堿性成纖維細胞生長因子(basic fibrob last growth factor,bFGF)購于美國PeproTech公司;小鼠抗大鼠巢蛋白(Nestin)單克隆抗體、兔抗大鼠膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體、小鼠抗微管相關蛋白2(microtubule-associated protein 2,MAP-2)抗體、FITC標記的山羊抗小鼠IgG購于美國Santa Cruz公司;TRITC標記山羊抗兔IgG、Triton X-100購于北京中杉金橋;南美胎牛血清購于美國HyClone公司;多聚賴氨酸(Poly-L-Lysine)購于美國Sigma公司;即用型正常山羊血清購于武漢博士德公司;青鏈霉素溶液(100×)、Hoechst 33342、胰蛋白酶細胞消化液、免疫染色一抗稀釋液、免疫熒光染色二抗稀釋液、抗熒光淬滅封片液(強)購于碧云天公司;BCA蛋白定量試劑盒、ECL顯影液試劑盒購于美國Pierce公司。
1.3 方法
1.3.1 NSCs原代培養(yǎng) 取新生24h內的SD大鼠幼鼠,頸椎脫臼法處死,經75%乙醇溶液浸泡5 min。在無菌條件下斷頭,剪開頭皮及顱骨,分離出大腦半球,預冷的無菌生理鹽水漂洗3次后用顯微鑷剝除腦膜及血塊[3]。將組織塊移入另一干凈無菌培養(yǎng)皿中,加入1 ml生理鹽水,然后用眼科剪將腦組織切碎,形成約1 mm3組織小塊,加入1 ml 0.25%胰蛋白酶細胞消化液,置于37℃細胞培養(yǎng)箱中消化10 min,移液槍輕輕吹打混勻細胞至不見組織碎片,經200目篩網過濾形成單細胞懸液,以600 r/min離心5 min后棄上清液,加入2 ml無血清培養(yǎng)基(DMEM/F-12+2%B-27+20 ng/ml EGF+20 ng/ml bFGF+青霉素100 U/ml+鏈霉素0.1 mg/ml)再次600 r/min離心5 min,棄上清液,加入無血清培養(yǎng)基重懸,計數,以105/ml接種于培養(yǎng)瓶中,置37℃、5%CO2培養(yǎng)箱中培養(yǎng),每3 d半量換液1次,約1周傳代1次。
1.3.2 NSCs傳代培養(yǎng) 培養(yǎng)2~3 d后,逐漸有細胞球形成,呈懸浮生長,1周后,600 r/min離心5 min后吸棄舊培養(yǎng)基,加入新鮮培養(yǎng)基,用吸管輕柔吹打細胞球成為小細胞球和單細胞懸液,按量將細胞懸液分別接種到新培養(yǎng)瓶中,1×105個細胞/瓶,每7 d傳代1次,每3 d離心更換半量培養(yǎng)基1次,培養(yǎng)條件不變。
1.3.3 NSCs分化 取第2代培養(yǎng)7 d的細胞球,經600 r/min離心5 min后,吸棄舊的無血清培養(yǎng)基,分別加入去除EGF、bFGF且含有不同F(xiàn)BS濃度(2%、5%、10%)的新鮮培養(yǎng)基(DMEM/F-12+2% B-27+青霉素100 U/ml+鏈霉素0.1 mg/ml)重懸后,接種于放有0.1 mg/ml多聚賴氨酸包被處理蓋玻片的6孔板中,置于37℃、5%CO2細胞培養(yǎng)箱中繼續(xù)培養(yǎng),每3 d半量換液,7 d后行免疫熒光染色鑒定。
1.3.4 NSCs及分化后的免疫熒光鑒定 第2代培養(yǎng)7 d的細胞球,接種于有0.1 mg/ml多聚賴氨酸包被處理蓋玻片的6孔板中,置于37℃培養(yǎng)箱6h,用0.01 mol/L的PBS洗3次,每次5 min,4%多聚甲醛常溫下固定20 min,吸去多余殘液后用0.01 mol/L的PBS洗3次,每次5 min,后在含0.1%TritonX-100的PBS液中孵育20 min,PBS液漂洗3次,每次5 min,加入正常山羊血清工作液后置于37℃培養(yǎng)箱內孵育1h,加入Nestin一抗(1∶50),4℃條件下孵育過夜,次日常溫下放置2h,PBS液漂洗3次,每次5 min,加入FITC標記的山羊抗小鼠IgG(1∶100),37℃細胞培養(yǎng)箱內避光孵育1h,PBS漂洗3次,每次5 min,最后加入終濃度為10 μg/ml Hoechst溶液避光狀態(tài)下行細胞核染色5 min,PBS漂洗3次晾干后,抗熒光淬滅封片液封片,熒光顯微鏡觀察及照相。
細胞球貼壁培養(yǎng)7 d后,取神經膠質細胞和神經元的特異性標志物GFAP、MAP-2行免疫熒光染色。重復以上步驟,MAP-2、GFAP一抗(1∶50)混合稀釋后加入各培養(yǎng)孔內,添加二抗FITC標記的山羊抗小鼠IgG(1∶100)及TRITC標記山羊抗兔IgG(1∶100),熒光顯微鏡觀察及照相。
1.3.5 Western blot檢測NSCs分化前后Nestin、MAP-2、GFAP蛋白的表達 提取NSCs分化前及不同分化條件下分化后細胞總蛋白,使用BCA法測定蛋白濃度,根據蛋白濃度選擇上樣量,依次行電泳、轉膜、封閉,加一抗于4℃孵育過夜,次日洗膜,加入相應二抗,室溫孵育2h,充分洗滌后ECL化學發(fā)光顯影并行膠片顯影定影處理。所使用抗體及稀釋度:Nestin(鼠單抗,1∶500稀釋),MAP-2(鼠單抗,1∶200稀釋),GFAP(兔多抗,1∶500稀釋),β-actin(鼠單抗,1∶1 000稀釋),二抗(山羊抗小鼠,1∶5 000稀釋;山羊抗兔,1∶5 000稀釋)。膠片掃描后采用Image J軟件分析各組條帶的灰度值。
1.4 統(tǒng)計學處理應用SPSS 11.0統(tǒng)計軟件進行分析,計量資料以±s表示,組間差異比較采用單因素方差分析,組間比較采用LSD法,檢驗水平α=0.05。
2 結果
2.1 原代細胞培養(yǎng)原代細胞接種后,在顯微鏡下觀察為懸浮的單個圓形細胞,邊界清楚,折光性強。接種2~3 d后,部分細胞死亡,單個細胞減少,大多數細胞分裂成小的細胞球,由單個細胞增殖形成。隨著時間的推移,細胞球的大小及數量明顯增大、增多,到第7天時培養(yǎng)瓶內生長出數十個甚至上百個細胞的集落,多呈球形、桑葚狀,折光性強,未見到明顯的細胞突起,部分細胞球因體積過大出現(xiàn)細胞球中心顏色暗淡、透光性較差。見圖1。
2.2 NSCs鑒定培養(yǎng)的細胞球貼壁6h后,于顯微鏡下觀察,部分細胞球外周細胞已伸出小突起,部分形態(tài)上已發(fā)生改變,行NSCs特異性Nestin抗體免疫熒光染色,結果顯示原代培養(yǎng)形成的細胞球中大部分細胞表達Nestin陽性。見圖1、2。
2.3 NSCs分化鑒定培養(yǎng)過程中,觀察到NSCs球逐漸貼壁,6h后已有部分細胞分化為具有1~2個短狀突起的神經元樣細胞,部分分化為具有多個長突起并呈梭樣排列的神經膠質樣細胞并隨著培養(yǎng)時間的延長,突起逐漸變長、增多,與相鄰的細胞構成網狀結構,至分化培養(yǎng)第7天,顯微鏡下可見各細胞球分化后向四周放射狀生長,排列緊密,各細胞間覆蓋。免疫熒光染色結果可見GFAP陽性的神經膠質細胞及MAP-2陽性的神經元細胞。提示所培養(yǎng)原代細胞具有多分化潛能,為NSCs,可分化為神經元及神經膠質細胞。見圖1、2。

圖1 NSCs原代培養(yǎng)及分化
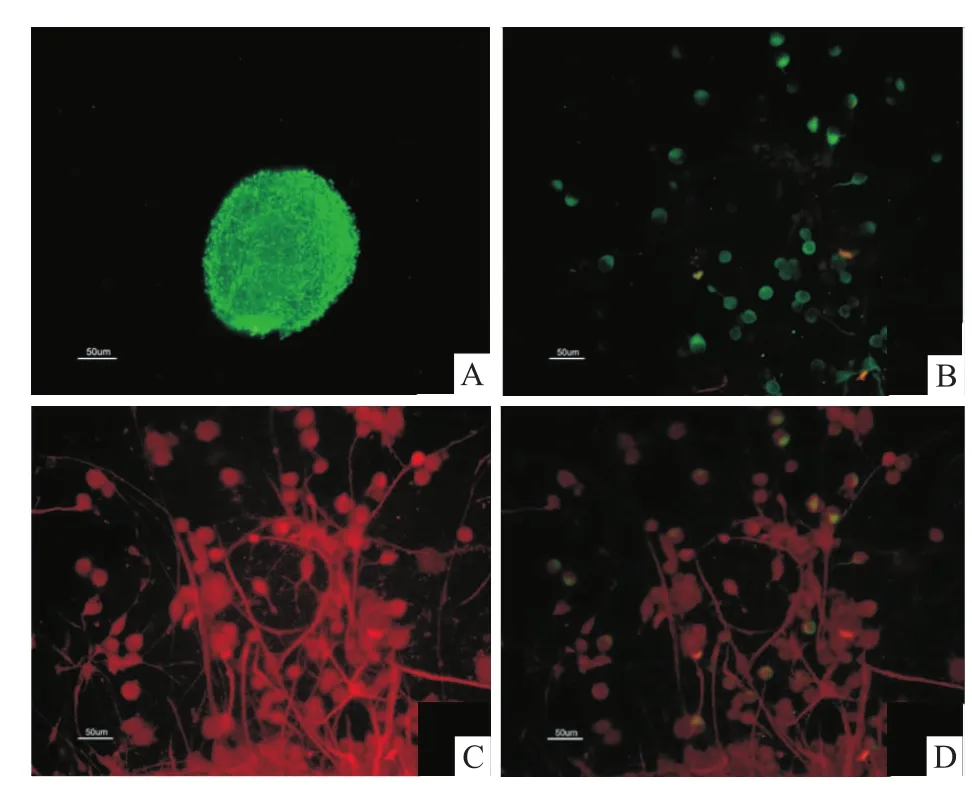
圖2 NSCs及分化后的免疫熒光鑒定
2.4 NSCs分化前后Nestin、MAP-2、GFAP蛋白的表達NSCs組Nestin蛋白明顯表達,2%FBS、5% FBS、10%FBS 3組未檢測出Nestin蛋白的表達。各組間MAP-2蛋白表達差異有統(tǒng)計學意義(F=80.440,P<0.05),兩兩比較顯示,NSCs組MAP-2蛋白的表達顯著低于2%FBS組、5%FBS組、10% FBS組(P<0.05);與5%FBS組和10%FBS組相比較,2%FBS組的MAP-2表達顯著增加(P< 0.05);5%FBS組的MAP-2表達較10%FBS組明顯增加(P<0.05)。各組間GFAP蛋白表達差異有統(tǒng)計學意義(F=580.018,P<0.05),兩兩比較顯示,NSCs組GFAP蛋白的表達顯著低于2%FBS組、5%FBS組、10%FBS組(P<0.05);與5%FBS組和10%FBS組相比較,2%FBS組的GFAP表達顯著減少(P<0.05);10%FBS組的GFAP表達較5%FBS組明顯增加(P<0.05)。見圖3。
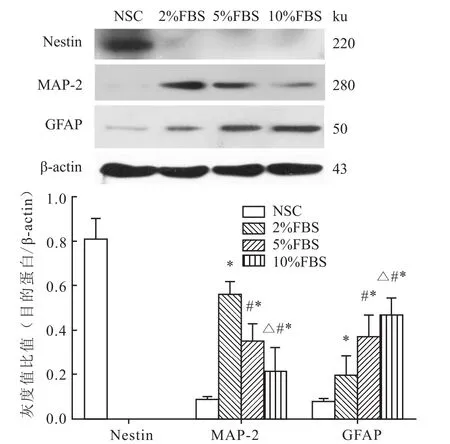
圖3 Western blot檢測NSCs分化前后各組Nestin、MAP-2、GFAP蛋白的表達水平
3 討論
在NSCs治療SCI的相關研究中,移植外源性NSCs一直是主要的研究手段,此類方法多是通過促進移植到SCI部位的NSCs有效地向神經元分化,促進其神經生發(fā),從而形成彼此間的神經通路,促進脊髓重建及神經修復的作用[4]。NSCs在移植到SCI區(qū)域后可分化為神經元、星型膠質細胞及少突膠質細胞,橋接脊髓斷端并重建脊髓傳導通路,改善損傷平面以下的運動及感覺功能[5-6]。有研究[7-8]表明,將NSCs體外分化為膠質細胞后移植,可促進脊髓區(qū)空洞的修復,而將NSCs誘導分化為少突膠質細胞后移植到SCI區(qū)域,可有效促進損傷區(qū)脫髓鞘神經的髓鞘化,但是有實驗研究[9]顯示:移植到脊髓中的NSCs最終絕大部分分化成為星型膠質細胞形成瘢痕,神經生發(fā)的比例較低,進一步阻礙了SCI區(qū)域神經通路的建立。由此可見,如何正確處理NSCs體內移植后的分化問題是解決NSCs治療SCI的關鍵。
Nestin是一種中間絲蛋白,又稱之為細胞骨架蛋白,該蛋白在多潛能的神經外胚層細胞表達,但Nestin并非只在NSCs中表達,肌肉和胰島細胞中也有相應的表達,因此并不能將其作為高特異性的表面標志物來單獨鑒定NSCs[10]。一旦神經前體細胞朝向終末方向分化成神經元和膠質細胞時,Nestin停止表達,神經元和神經膠質細胞分別表達其特異性蛋白:MAP-2、GFAP。
在本實驗過程中,采用了去除bFGF、EGF且含有不同F(xiàn)BS濃度(2%、5%、10%)的DMEM/F-12培養(yǎng)基誘導NSCs分化,免疫熒光染色示Nestin表達(+)的細胞球貼壁分化后含有GFAP表達(+)的神經膠質細胞及MAP-2表達(+)的神經元。這間接顯示了之前聚集形成的細胞球是由能夠自主分化形成神經膠質細胞及神經元的NSCs組成,同時在NSCs的分化過程中,隨著血清濃度的增加,MAP-2蛋白表達量逐漸減少,GFAP蛋白表達量逐漸增多。這也直接表明血清濃度的高低決定NSCs的分化情況,低濃度血清的條件培養(yǎng)基促進NSCs更多地向神經元方向分化,而高濃度血清則有利于NSCs向神經膠質細胞方向分化。
目前在NSCs的原代培養(yǎng)及增殖分化方面的研究已經取得一定進展,在本次體外實驗中,可以通過調整條件培養(yǎng)基中血清含量的高低來影響NSCs分化的結果,以提高神經元所占分化后細胞中的比例,但對于體內實驗中NSCs的具體定位、遷移分化過程及其規(guī)律仍缺乏全面的認識。如何更好地解決NSCs移植后的定向分化問題仍是提高NSCs移植療效所必須面對的難題。
[1] Reynolds B A,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255(5052):1707-10.
[2] Richards L J,Kilpatrick T J,Bartlett P F.De novo generation of neuronal cells from the adult mouse brain[J].Proc Natl Acad Sci U S A,1992,89(18):8591-5.
[3] 劉 萍,涂 彧.表皮生長因子在新生大鼠神經干細胞培養(yǎng)中的作用[J].蘇州大學學報(醫(yī)學版),2010,30(2):310-2.
[4] Kan E M,Ling E A,Lu J.Stem cell therapy for spinal cord injury[J].Curr Med Chem,2010,17(36):4492-510.
[5] Tarasenko Y I,Gao J,Nie L,et al.Human fetal neural stem cells grafted into contusion-injured rat spinal cords improve behavior[J].J Neurosci Res,2007,85(1):47-57.
[6] Du C,Yang D,Zhang P,et al.Single neural progenitor cells derived from EGFP expressing mice is useful after spinal cord injury in mice[J].Artif Cells Blood Substit Immobil Biotechnol,2007,35(4):405-14.
[7] Nakamura M,Okada S,Toyama Y,et al.Role of IL-6 in spinal cord injury in a mouse model[J].Clin Rev Allergy Immunol,2005,28(3):197-204.
[8] Gao J,Coggeshall R E,Tarasenko Y I,et al.Human neural stem cell-derived cholinergic neurons innervate muscle in motoneuron deficient adult rats[J].Neuroscience,2005,131(2):257-62.
[9] Pluchino S,Cusimano M,Bacigaluppi M,et al.Remodelling the injured CNS through the establishment of atypical ectopic perivascular neural stem cell niches[J].Arch Ital Biol,2010,148(2):173-83.
[10]張 蕾,李曉莉.神經干細胞的分離培養(yǎng)和鑒定及體外長期培養(yǎng)[J].中國現(xiàn)代醫(yī)學雜志,2012,22(20):52-5.
Isolation,cultivation in vitro and differentiation of rat neural stem cells
Xu Peng,Song Peiwen,Zhang Renjie,et al
(Dept of Orthopedics,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo establish the isolation,differentiation,identification and long-term cultivation in vitro of the neural stem cells(NSCs)from neonatal SD rats,and to investigate the effect of the serum concentration on the differentiation of NSCs.MethodsBrain tissue was isolated from neonatal SD rats and NSCs were cultured in serum free medium.To identify NSCs and detect Nestin expression in NSCs by immunofluorescence.In the condition of DMEM/F-12 containing different concentrations(2%,5%,10%)of FBS to induct the differentiation of NSCs,to identify the differentiated cells with the antibodies of neuron specific microtubule-associated protein 2(MAP-2)and glial cell specific glial fibrillary acidic protein(GFAP)by immunofluorescence.In the differentiation conditionscontaining different concentrations of FBS,to detect the expression of MAP-2 and GFAP by Western blot.ResultsA mass of undifferentiated neurospheres were obtained and cultured in suspension,those NSCs could differentiate into neurons and astrocytes.With increasing serum concentrations,the expression of MAP-2 in each group gradually increased(P<0.05),and the expression of GFAP gradually decreased(P<0.05).ConclusionWe successfully obtain the fetal rat NSCs in vitro,whichhave the capacities of proliferation,self-renew and pluripotentiality with the application of serum free cultivation.In the differentiation conditions containing different concentrations(2%,5%,10%)of FBS,NSCs differentiate into neurons and glial cells,the conditioned medium containing low concentration of serum promote the differentiation of NSCs into neurons,thehigh concentration of serum is conducive to the differentiation of NSCs into neural glial cells.
rat;neural stem cell;cell culture;Western blot
R 651.2
A
1000-1492(2014)04-0443-05
2014-02-17接收
1安徽醫(yī)科大學第一附屬醫(yī)院骨科,合肥 230022
2安徽醫(yī)科大學基礎醫(yī)學院組織學與胚胎學教研室,組織工程干細胞研究所,合肥 230032
徐 鵬,男,碩士研究生;申才良,男,副教授,主任醫(yī)師,碩士生導師,責任作者,E-mail:shencailiang1616@163.com

