α-1,3-葡聚糖的精制、鑒定及其系列寡糖的制備與序列表征
張洪濤,范尊曉,朱 莉,趙小亮,詹曉北,*
(1.江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇 無錫 214122;2.江蘇瑞光生物科技有限公司,江蘇 無錫 214000;3.中國海洋大學醫藥學院,海洋藥物教育部重點實驗室,山東 青島 266003)
α-1,3-葡聚糖的精制、鑒定及其系列寡糖的制備與序列表征
張洪濤1,范尊曉1,朱 莉2,趙小亮3,詹曉北1,*
(1.江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇 無錫 214122;2.江蘇瑞光生物科技有限公司,江蘇 無錫 214000;3.中國海洋大學醫藥學院,海洋藥物教育部重點實驗室,山東 青島 266003)
目的:提取α-1,3-葡聚糖并獲得系列α-1,3-葡聚寡糖。方法:以香菇子實體粗提粉為原材料,依次經生理鹽水(0.9% NaCl)和水溶解提取,然后用質量分數5% NaOH和質量分數0.05% NaBH4溶解,調節pH值至中性再分離提取的分級沉淀策略,獲得了依次命名為LFⅠ、LFⅡ、LFⅣ、PⅢ和PⅣ的5個不同組分,再利用紅外光譜(infrared spectroscopy,IR)和核磁共振(nuclear magnetic resonance,NMR)對PⅣ結構進行鑒定,然后利用酸解法對PⅣ進行寡聚化,并利用常壓色譜Bio-Gel P4柱進行分離,同時對每個組分利用基質輔助激光解吸-電離質譜(matrix assisted laser desorption ionization mass spectrometry,MALDI-MS)或電噴霧離子化質譜法(electrospray ionization mass spectrometry,ESI-MS)進行表征。結果:結構分析表明PⅣ為線性α-1,3-葡聚糖,10 mmol/L三氟乙酸(trifluoroacetic acid,TFA)中,100 ℃處理2 h為較佳的水解條件,經過Bio-Gel P4柱分離獲得的各個組分被依次鑒定為α-1,3-2~α-1,3-13糖。結論:實現α-1,3-葡聚糖的分級精制與結構鑒定,成功獲得結構確定的系列α-1,3-葡聚寡糖。
α-1,3-葡聚糖;結構鑒定;核磁共振;α-1,3-葡聚寡糖;基質輔助激光解吸-電離質譜
α-1,3-葡聚糖是存在于多種微生物細胞壁的多糖[1-3],一方面其衍生物具有抗腫瘤等生物活性[4],另一方面在致病菌入侵機體過程中具有重要作用,如α-1,3-葡聚糖通過阻斷Dectin-1識別致病菌,加速了致病菌入侵機體[5];同樣α-1,3-葡聚糖促進了致病菌侵入稻谷植株,含有α-1,3-葡聚糖水解酶的轉基因稻谷能明顯增強其對Magnaporthe oryzae的抗性[6]。此外,α-1,3-葡聚糖誘導曲霉菌的分生孢子聚合[7]。在加強功能因子的構效、量效關系及其作用機理的研究已經成為尋找與發現新型功能糖的主流趨勢下,如何探尋α-1,3-葡聚糖的功效機制成為成功對α-1,3-葡聚糖進行“構-效”關系研究的核心。
多糖在生物體內的活性體現在與功能蛋白受體相互識別、相互作用的過程中[8-9],多糖通過與功能靶標蛋白結合來激活機體內相應細胞信號途徑,進而實現其功能。因此篩選獲得能夠識別α-1,3-葡聚糖的功能蛋白成為闡明α-1,3-葡聚糖功效機制的關鍵。
根據蛋白序列、識別糖鏈的特異性以及結構的不同,目前將糖-蛋白識別模型(carbohydrate-binding modules,CBMs)歸為69 個不同類型(www.cazy. org)。根據結構和功能的相似性又將CBMs分為3 個大類型:1)A-型(表面識別類型),糖鏈主要與靶標CBMs蛋白的表面部位識別;2)B-型(糖鏈識別型),該型CBMs主要通過與聚合度大于3的寡糖識別;3)C-型(小糖識別類型),該類型CBMs主要與低聚合度的寡糖進行識別[10]。這表明:糖鏈與靶標蛋白受體結合時,主要是通過糖鏈中的活性中心——寡糖片段與受體蛋白真正相結合[11]。因此,從多糖的活性中心——寡糖的角度篩選功能蛋白成為一條有效的捷徑。
由于沒有商業化的α-1,3-葡聚糖或α-1,3-葡聚寡糖可以購買,本研究根據香菇中可以提取α-1,3-葡聚糖的報道[12],主要關注于:1)首先利用香菇子實體粗提多糖進行分級提取獲得α-1,3-葡聚糖并利用紅外光譜(infrared spectroscopy,IR)和核磁共振(nuclear magnetic resonance,NMR)對提取的多糖結構進行了鑒定與驗證;2)利用酸解技術對獲得的α-1,3-葡聚糖進行寡聚化并進行凝膠色譜分離,同時對獲得組分進行電噴霧質譜(electrospray ionization mass spectrometry,ESI-MS)和基質輔助激光解吸-電離質譜(matrix assisted laser desorption ionization mass spectrometry,MALDI-MS)分析,最終獲得了聚合度從α-1,3-2~α-1,3-13糖的系列寡糖。本研究為進一步基于糖芯片技術篩選獲得能夠識別α-1,3-葡聚寡糖的功能蛋白配體奠定了寡糖資源物質基礎。
1 材料與方法
1.1 材料與試劑
香菇子實體粗提多糖粉 杭州眾芝康菇生物技術有限公司;Dextran多糖水解混合物 Imperial College London;高效薄層層析(high performance thin layer chromatography,HPTLC)板 德國Meker公司。
1.2 儀器與設備
Nicolet Nexus 470 FT-IR紅外光譜儀 美國Nicolet公司;Micromass Q-Tof Mass Spectrometer 英國Waters公司;Micromass Tof Spec 2E-TOF 英國Waters公司;JNM-ECP600核磁共振波譜儀 日本理光公司;ICS-5000離子色譜儀(脈沖安培檢測器) 美國Dionex公司。
1.3 方法
1.3.1 α-1,3-葡聚糖的分級拆分
α-1,3-葡聚糖的提取參照Zhang Pingyi等[12]的方法。香菇子實體粗提多糖粉依次經質量分數0.9%NaCl、水、5%NaOH/0.05%NaBH4溶解、調節pH值至中性后得到上清液LFⅠ、LFⅡ、LFⅢ和沉淀PⅢ、PⅣ,具體流程見圖1。
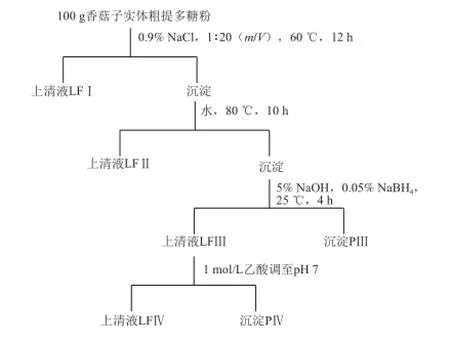
圖1 1α-1,3-葡聚糖的提取流程Fig.1 Flowchart for the extraction of α-1,3-glucan from shiitake
1.3.2 PⅣ多糖的單糖組成分析
精確稱取0.100 0 g葡萄糖、木糖、巖藻糖、氨基葡萄糖、鼠李糖、阿拉伯糖、氨基半乳糖、半乳糖、甘露糖、果糖、核糖,分別以體積分數80%的乙腈-水溶液定容至10 mL。再分別移取1.00 mL置于同一容量瓶中,搖勻,定容至10 mL,得到單糖標準溶液。
用熱凝膠多糖(β-1,3-glucan,單糖組成僅為葡萄糖)作為對照,稱取熱凝膠和PⅣ多糖各15 mg,分別加入2 mol/L CF3COOH 2 mL,封管后在100 ℃下反應8 h,水解產物加入甲醇,用氮吹儀吹干,反復3 次(用于除去CF3COOH)。然后用ICS-5000離子色譜儀進行色譜分析。采用CarboPac PA20(3 mm×150 mm,5 μm)色譜柱,梯度洗脫,流動相:A去離子水,B 250 mmol/L NaOH,C 1 mol/L CH3COONa,0~21 min:V(A)∶V(B)∶V(C)=97.4∶2.6∶0;21~21.1 min:V(A)∶V(B)∶V(C)=92.4∶2.6∶5.0;21.1~30 min:V(A)∶V(B)∶V(C)=77.4∶2.6∶20;30~30.1 min:V(A)∶V(B)∶V(C)=20∶80∶0;30~50 min:V(A)∶V(B)∶V(C)=20∶80∶0。流速為0.5 mL/min。
1.3.3 多糖PⅣ的紅外光譜分析
采用KBr圓盤法處理[13]:在紅外燈照射下,取少許多糖和3~4 勺KBr(多糖-KBr質量比約為1∶50)于研缽中研細,取適量壓成透光薄片上樣,使用Nicolet Nexus 470 FT-IR紅外光譜儀在4 000~500 cm-1范圍內進行檢測分析。
1.3.4 多糖PⅣ的核磁共振分析
NMR分析樣品準備[14]:將50 mg多糖PⅣ在P2O5真空干燥箱中充分干燥后溶解于0.5 mL D2O中,真空冷凍干燥,重復3 次,最后將樣品用0.5 mL D2O溶解轉移至核磁管中,丙酮作為內參,在25 ℃下進行一維1H-NMR分析,采用MestReNova軟件進行數據輔助解析。
1.3.5 α-1,3-葡聚糖(多糖PⅣ)水解與常壓色譜分離
Dextran水解產物用Bio-Gel P4(1.6 cm×90 cm,90~180 μm)凝膠柱子進行凝膠色譜分離,用于評估Bio-Gel P4柱子的分離效果。α-1,3-葡聚糖在10 mmol/L三氟乙酸(trifluoroacetic acid,TFA)中(按照1 mg多糖∶200 μL 10 mmol/L TFA)100 ℃處理2 h,取出后立即放置冰上,等待降為室溫后,加入2 mL的甲醇,用氮氣吹干,反復3 次用于除去TFA。定容于1 mL的水中,用Bio-Gel P4凝膠柱進行色譜分離。
對于分離峰形獨立良好的寡糖組分,根據出峰時間與峰形直接歸類收集,對于分離效果不是很理想的大片段寡糖,先用MALDI-MS分析分子質量,然后再進行歸類收集。獲得的從2糖到13糖組分分別單獨收集并冷凍干燥,對每一組分,分別取出約2 μg寡糖用HPTLC板來進行分析,展開劑采用正丙醇-水(8∶3,V/V)。Orcinal做染色劑,在105 ℃下處理90 s用于顯色[15]。
1.3.6 寡糖序列質譜表征
寡糖分子質量分析[16]:ESI-MS主要用于小分子物質的分析,用ESI-MS分析大分子質量的寡糖時,則會使其裂解成大量的碎片,無法獲得大分子寡糖的分子質量,而MALDI-MS則不會破壞分子結構,因而可以用于大分子寡糖的分析,由于MALDI-MS需要基質輔助才能完成分子質量的分析,基質分子質量較小,小分子質量寡糖用MALDI-MS進行分析時則很容易被基質峰掩蓋掉。因此,在本實驗對于聚合度低于4的寡糖,用負離子ESI-MS方法測定寡糖分子質量,儀器為Micromass Q-Tof Mass Spectrometer,氮氣作為去溶劑化和霧化氣體,流速分別為250 L/h和15 L/h。源溫度為80 ℃,去溶劑溫度為150 ℃。毛細管電壓為3 kV,寡糖溶解在甲醇-水(1∶1,V/V)溶液中,寡糖濃度為5~10 pmol/μL,每次取5 μL注射入進樣口用于分析,乙腈:1 mmol/L碳酸氫銨(1∶1,V/V)作為流動相,由注射器進樣泵控制流速為10 μL/min,主要產生[M-H]-的離子碎片峰。對于聚合度高于4的寡糖,其分子質量用Waters的Micromass Tof Spec 2E-TOF儀器進行表征,寡糖首先溶解于水中,濃度為10~20 pmol/μL,取0.25 μL樣品和2-(4-羥基苯唑)苯甲酸一起加到樣品板上,室溫下等樣品板上的液體全部揮發后,樣品和助劑的混合物用乙醇重新結晶。對于中性糖,MLADI源主要產生[M+Na]+的離子碎片峰。
2 結果與分析
2.1 PⅣ的提取與結構鑒定
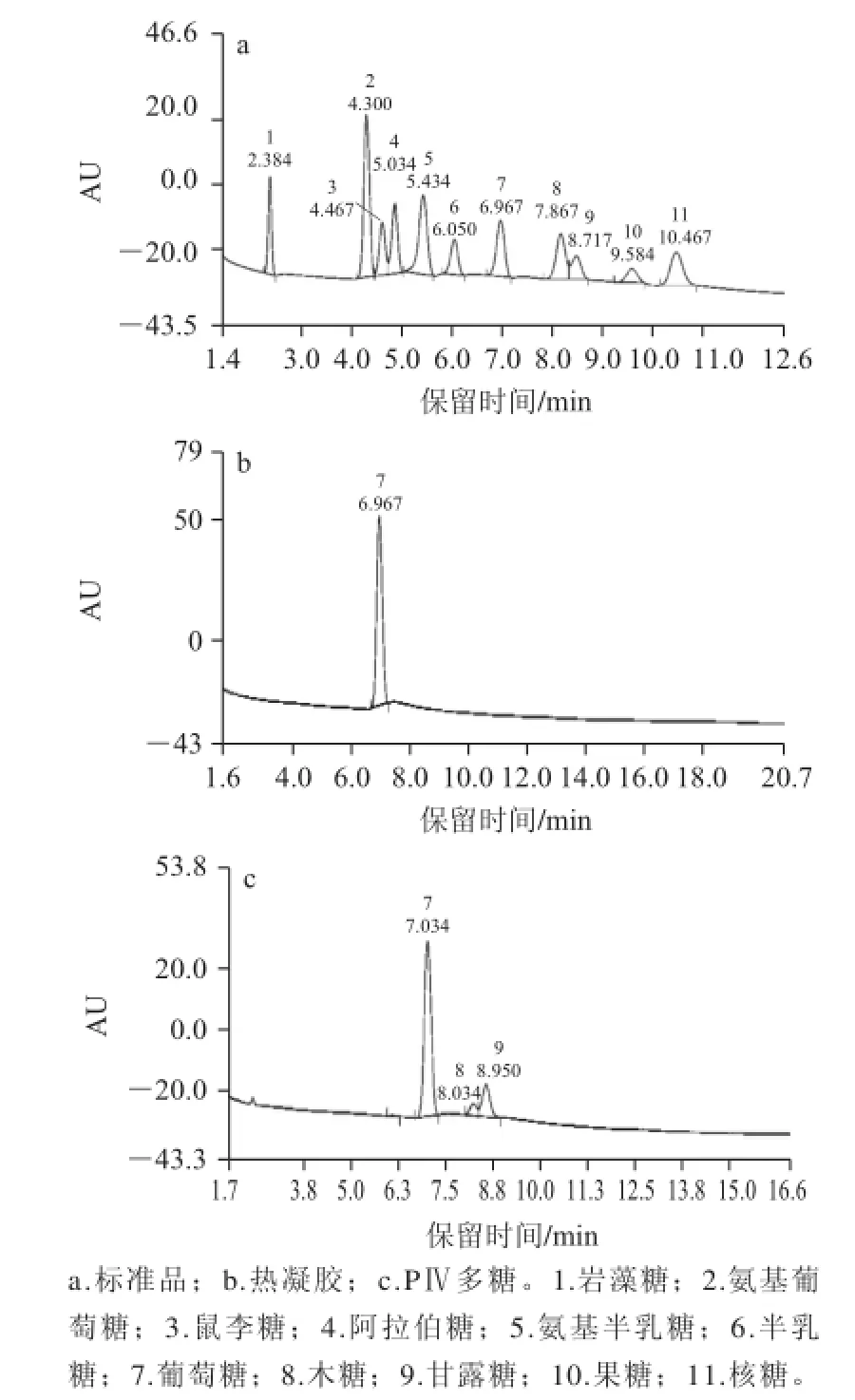
圖2 多糖PⅣ的單糖組成HPLC圖Fig.2 HPLC profile of monosaccharides compositions in polysaccharide PⅣ
從香菇子實體中提取α-1,3-葡聚糖已有相關報道[4]。由于所使用的材料是香菇粗提多糖,而α-1,3-葡聚糖是水不溶性多糖,在粗提過程中有可能造成α-1,3-葡聚糖的丟失,因此有必要對提取的多糖結構進行鑒定與驗證。PⅣ的單糖組成分析結果如圖2所示。因為熱凝膠的單糖組成為葡萄糖,本實驗將熱凝膠作為對照來進行分析,結果如圖2b所示,通過與單糖標準品的出峰時間進行比對,可以判斷熱凝膠的單糖組成為葡萄糖。PⅣ的單糖組成分析結果如圖2c所示,PⅣ組分中的單糖組成主要為葡萄糖,也含有少量的木糖與甘露糖。該分析結果與Zhang Pingyi等[4]的結果相一致,木糖與甘露糖應該是少量來自于LFⅣ的組分。單糖組成分析表明:PⅣ的單糖組成主要為葡萄糖。
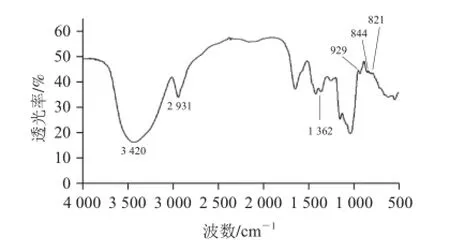
圖3 多糖PⅣ的紅外光譜Fig.3 Infrared spectrum of PⅣ
由圖3可知,在2 931 cm-1和1 362 cm-1處有兩組吸收峰,該吸收峰分別代表了糖類化合物C—H伸縮振動和變角振動,而在3 420 cm-1處吸收峰則代表了糖類化合物O—H伸縮振動[17],為多糖特征吸收峰[18]。950~1 250 cm-1范圍內有強吸收峰,表示其為呋喃單體。無810 cm-1和875 cm-1處吸收峰則表示不含甘露糖[18]。847 cm-1為α-D-Glc呋喃構型的特征吸收峰[17],在890 cm-1處有吸收峰則表示分子中有β-D-Glc的C—H差相異構吸收峰,在圖3中只觀察到844 cm-1處有吸收峰,而890 cm-1處沒有觀察到吸收峰,表明PⅣ不含β-D-Glc單元,PⅣ的葡萄糖單元均為α-D-Glc呋喃構型。在822 cm-1處有吸收峰表示該多糖為α-(1→3)-鍵型[19]。有研究表明926、844、822 cm-1為α-(1→3)-D-葡聚糖的特征吸收峰[12],本實驗可明顯地在929、844、821 cm-1處觀察到吸收峰,說明PⅣ為α-(1→3)-D-葡聚糖。
為進一步確定PⅣ的鍵型,對PⅣ進行了1H-NMR分析。H1化學位移在4.4~4.9范圍之內為β-型,而在4.9~5.9范圍之內為a-型[20]。PⅣ的1H-NMR分析圖譜如圖4a所示,PⅣ的H1化學位移為5.11,在5.0~5.5之間,該結果進一步表明多糖PⅣ為α-型多糖。在13C-NMR譜圖中,異頭碳信號在90~110范圍之內,非異頭碳信號在60~85范圍之內。通過α鍵型連接的多糖其異頭碳(C1)信號在97~101左右,通過β鍵型連接的多糖其異頭碳(C1)信號在103~105左右[21]。PⅣ的13C-NMR分析圖譜如圖4b所示,從圖中可以看出C1的化學位移為101.61,這進一步表明PⅣ為α-型多糖。83.3是葡萄糖單元通過α-(1→3)連接的C-3化學位移信號[22],在圖4b中可以觀察到83.92的化學位移信號,這表明PⅣ多糖中含有α-(1→3)-D-葡聚糖。
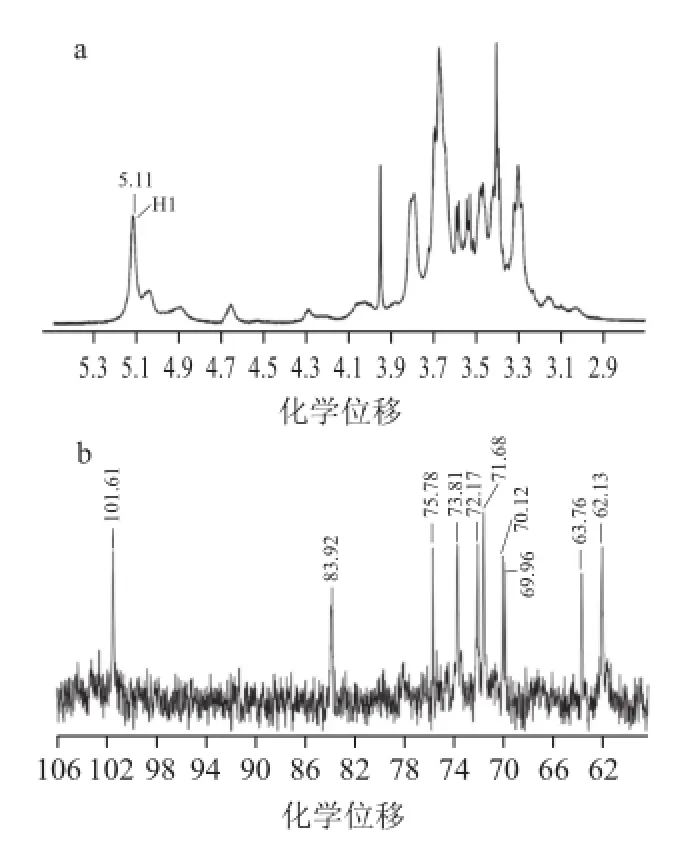
圖4 PⅣ的1H-NMR(a)和13C-NMR(b)圖譜Fig.4 1H-NMR (a) and1133C-NMR (b) of PⅣ
2.2 α-1,3-葡聚糖水解混合物的分離與寡糖結構質譜表征
α-1,3-葡聚寡糖混合物的分離選用Bio-Gel P4凝膠柱來進行。但是在進行分離前需要對水解混合物進行脫鹽,在用G10脫鹽過程中,由于葡萄糖極容易與鹽混合為一個峰,從而造成多糖水解產物脫鹽后的Bio-Gel P4圖譜中1糖峰位置的缺失,因此需要確定葡萄糖經Bio-Gel P4柱的出峰時間,此外也要評估Bio-Gel P4柱的分離效果。Dextran是α-1,6-葡聚糖,Dextran的水解產物是包含了從1糖到不同聚合度寡塘的混合物。因此首先用Dextran水解產物對Bio-Gel P4柱效進行了評估,同時確定葡萄糖單糖的出峰時間,分離效果圖如圖5a所示,1糖到10糖所在的出峰位置與出峰時間并且各個峰形相對獨立,這表明Bio-Gel P4柱對Dextran水解產物具有較好的分離效果。
α-1,3-葡聚糖水解混合物的Bio-Gel P4凝膠色譜分離譜圖如圖5b所示。最后一個峰的位置與圖5a中的1糖相對應,這表明最后一個峰所含主要組分為葡萄糖。在多糖寡聚化時,除用酶解外,用硫酸和鹽酸對多糖進行寡聚化也是主流的寡聚化方法,用硫酸寡聚化的條件下,一般通過形成硫酸鋇來除去硫酸根離子,由于硫酸鋇會對多糖和寡糖產生吸附,提高了產品的成本;鹽酸作為水解酸時,酸解結束后需要通過G10柱等進行脫鹽,增加了工序與成本。但是使用三氟乙酸酸解結束后,只需要用氮氣吹干即可,大大降低了成本與損耗。鑒于結構為線性α-1,6-葡聚糖的Dextran水解產物,其經過Bio-Gel P4柱分離后依次出現α-1,6-2糖、α-1,6-3糖等不同聚合度的寡糖,因此根據分離譜圖上峰形良好的組分依據峰形進行收集,每個獨立峰形歸為一個組分,依次命名為F2~F10,對于剩余不能根據峰形確定的組分則是在對每一樣品收集管進行MALDI-MS分析后根據分析的結果將聚合度分布相同的收集管進行合并得到F11~F13。
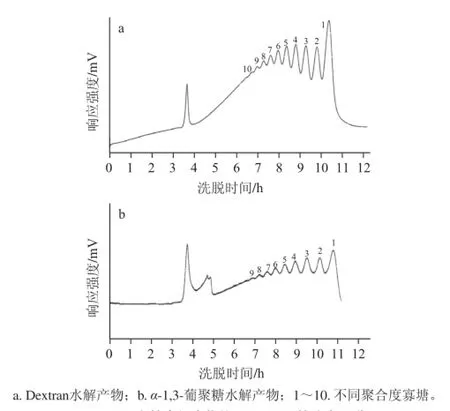
圖5 多糖水解產物的Bio-Gel P4柱分離圖譜Fig.5 Separation profile of gluco-oligosaccharides from hydrolysates
12 個寡糖片段(F2~F13)的純度分析初步用HPTLC來進行,結果如圖6所示,每個寡糖片段主要成分含量占很大比重。為了對所收集的每個片段的結構進行表征,本實驗采用MALDI-MS來進行:由于PⅣ為線性α-1,3-葡聚寡糖,因此,只要知道獲得寡糖的聚合度,就可以得到寡糖的結構。不同寡糖組分的MALDI-MS結果如表1所示,在每個寡糖組分中,其所含主要寡糖的聚合度與預期大小完全一致。此外,結果同時表明在10 mmol/L TFA中,100 ℃處理2 h為較好的α-1,3-葡聚糖水解條件。
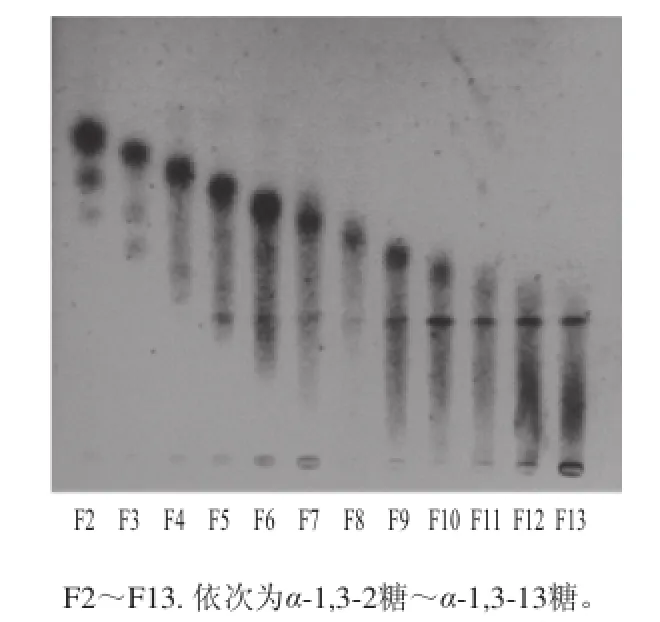
圖6 12個寡糖片段的HPTLC分析Fig.6 HPTLC profile of oligosaccharides F2 through F13
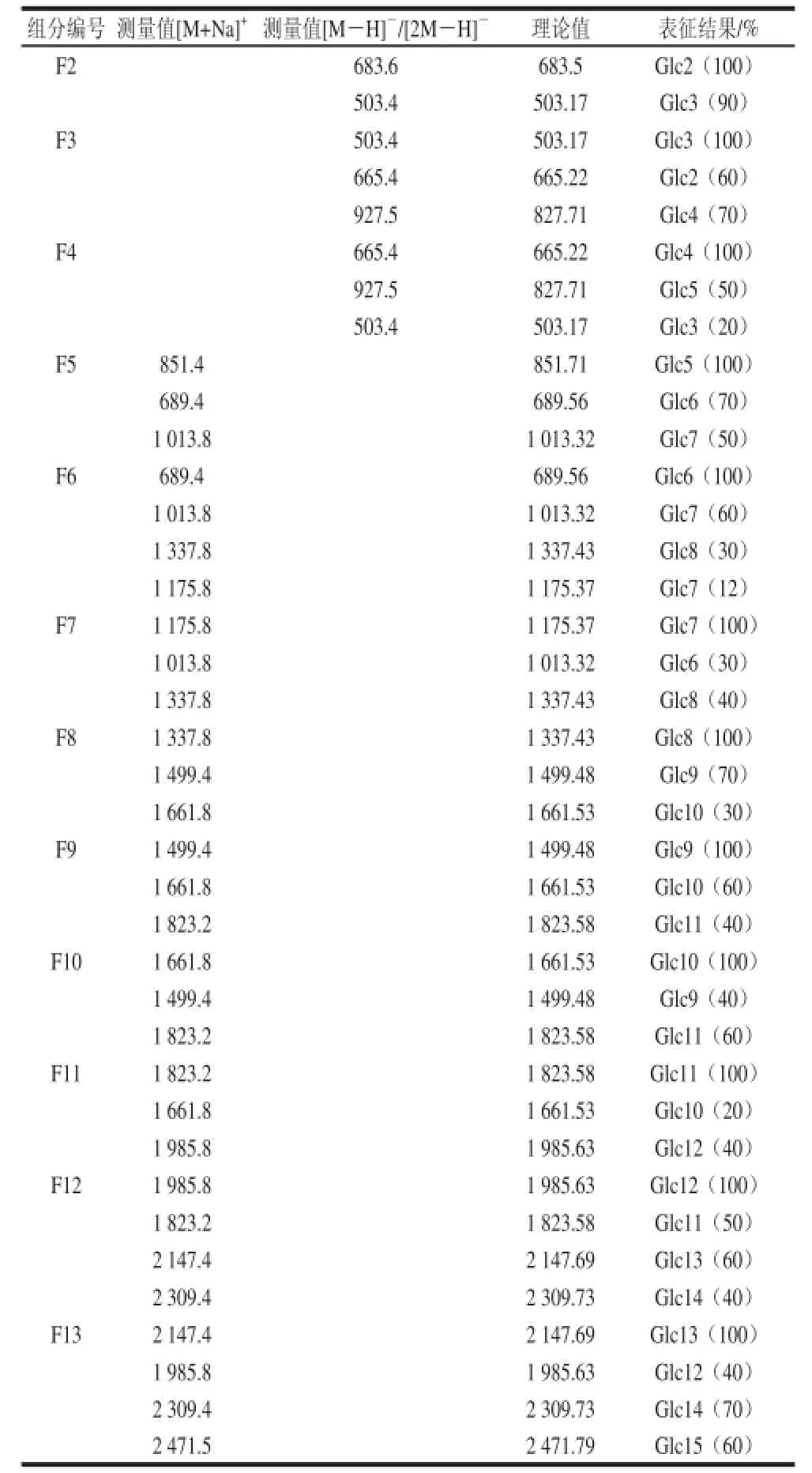
表1 Bio-Gel P4柱分離獲得寡糖組分的MALDI-MS和ESI-MSTable1 MALDI-MS and ESI-MS analysis of oligosaccharides present in Bio-Gel P4 fraction
3 結 論
基于IR圖譜和1H-NMR對分離獲得的PⅣ組分進行分析,結合已經報道的α-1,3-葡聚糖數據,將PⅣ鑒定為線性α-1,3-葡聚糖。在10 mmol/L TFA中,100 ℃處理2 h為較好的α-1,3-葡聚糖水解條件。然后通過色譜分離與MALDI-MS或ESI-MS分析成功獲得了聚合度從2到13的系列線性α-1,3-葡聚寡糖。系列線性α-1,3-葡聚寡糖的成功獲得為進一步基于糖芯片技術獲得與α-1,3-葡聚寡糖具有特異作用關系的功能蛋白奠定寡糖基礎。
目前在對寡糖進行分離時,利用常規的凝膠色譜只能實現低聚糖的有效分離(聚合度<7)。對聚合度相對較大的寡糖,雖然可以采用高效液相色譜(配RI檢測器)進行分析,但是分離的靈敏度相對較低,并且不能使用梯度洗脫法來進行更為有效的分離。為解決梯度洗脫問題,科研工作者建立了柱前衍生,柱后脫衍生的方法:通過將寡糖衍生化獲得熒光基團來實現在紫外檢測器檢測情況下的有效分析,但隨之而來的問題是分離獲得的寡糖如何高效除去衍生化熒光基團問題。在今后工作中,如何獲得有效的柱前衍生和柱后脫衍生方法是亟待解決的問題。
[1] WIATER A, PADUCH R, PLESZCZY?SKA M, et al. α-(1→3)-D-Glucans from fruiting bodies of selected macromycetes fungi and the biological activity of their carboxymethylated products[J]. Biotechnology Letters, 2011, 33(4): 787-795.
[2] HENRY C, LATGE J P, BEAUVAIS A. α-1,3-Glucans are dispensable in Aspergillus fumigatus[J]. Eukaryot Cell, 2012, 11(1): 26-29.
[3] FOOTE J B, KEARNEY J F. Generation of B cell memory to the bacterial polysaccharide α-1,3 dextran[J]. Journal of Immunology, 2009, 183(10): 6359-6368.
[4] ZHANG Pingyi, ZHANG Lina, CHENG Shuyao, et al. Chemical structure and molecular weight of α-(1→3)-D-glucan from Lentinus endodes[J]. Bioscience Biotechnology and Biochemistry, 1999, 63(7): 1197-1202.
[5] RAPPLEYE C A, EISSENBERG L G, GOLDMAN W E. Histoplasma capsulatum α-(1,3)-glucan blocks innate immune recognition by the β-glucan receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(4): 1366-1370.
[6] FUJIKAWA T, SAKAGUCHI A, NISHIZAWA Y, et al. Surface α-1,3-glucan facilitates fungal stealth infection by interfering with innate immunity in plants[J]. PLoS Pathogens, 2012, 8(8): e1002882. doi: 10.1371/journal.ppat.1002882.
[7] FONTAINE T, BEAUVAIS A, LOUSSERT C, et al. Cell wall α-3 glucans induce the aggregation of germinating conidia of Aspergillus fumigatus[J]. Fungal Genetics and Biology, 2010, 47(8): 707-712.
[8] XIA Yu, VETVICKA V, YAN Jun, et al. The β-glucan-binding lectin site of mouse CR3 (CD11b/CD18) and its function in generating a primed state of the receptor that mediates cytotoxic activation in response to iC3b-opsonized target cells[J]. Journal of Immunology, 1999, 162(4): 2281-2290.
[9] ALBEITUNI S H, YAN Jun. The effects of β-glucans on dendritic cells and implications for cancer therapy[J]. Anticancer Agents Medicinal Chemistry, 2013, 13(5): 689-698.
[10] SHOSEYOV O, SHANI Z, LEVY I. Carbohydrate binding modules: biochemical properties and novel applications[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 283-295.
[11] PALMA A S, FEIZI T, ZHANG Yibing, et al. Ligands for the β-glucan receptor, Dectin-1, assigned using ‘designer’ microarrays of oligosaccharide probes (neoglycolipids) generated from glucan polysaccharides[J]. Journal of Biological Chemistry, 2006, 281(9): 5771-5779.
[12] ZHANG Pingyi, ZHANG Lina, CHENG Shuyao. Solution properties of an α-(1→3)-d-glucan from Lentinus edodes and its sulfated derivatives[J]. Carbogydrate research, 2002, 337(2): 155-160.
[13] 劉美琴, 李建中. 香菇菌絲體多糖的分離鑒定與免疫功能研究[J].生物化學與生物物理學報: 英文版, 1999, 31(1): 46-50.
[14] KOGELBERG H, PISKAREV V E, ZHANG Yibing, et al. Determination by electrospray mass spectrometry and1H-NMR spectroscopy of primary structures of variously fucosylated neutral oligosaccharides based on the iso-lacto-N-octaose core[J]. European Journal of Biochemistry, 2004, 271(6): 1172-1186.
[15] LIU Yan, FEIZI T, CAMPANERO-RHODES M A, et al. Neoglycolipid probes prepared via oxime ligation for microarray analysis of oligosaccharide-protein interactions[J]. Chemistry & Biology, 2007, 14(7): 847-859.
[16] PALMA A S, CHILDS RA, ZHANG Yibing, et al. Neoglycolipidbased “designer” oligosaccharide microarrays to define β-glucan ligands for Dectin-1[J]. Methods in Molecular Biology, 2012, 808: 337-358.
[17] 于廣利, 王瑩, 趙峽, 等. 一種堿溶性灰樹花菌絲體多糖GFM2A的制備和結構表征[J]. 高等學校化學學報, 2007, 28(1): 87-91.
[18] 孫玉軍, 陳彥, 王洵, 等. 蜜環菌胞外多糖的分離純化及其性質研究[J].安徽大學學報: 自然科學版, 2005, 29(5): 87-91.
[19] SEYMOUR F R, JULIAN R L, JEANES A, et al. Structural analysis of insoluble D-glucans by fourier-transform, infrared differencespectrometry: correlation between structures of dextrans from strains of Leuconostoc mesenteroides and of D-glucans from strains of Streptococcus mutans[J]. Carbohydrate Research, 1980, 86(2): 227-246.
[20] GONZAGA M L C, RICARDO N M, HEATLEY F, et al. Isolation and characterization of polysaccharides from Agaricus blazei Murill[J]. Carbohydrate Polymers, 2005, 60(1): 43-49.
[21] BUBB W A. NMR spectroscopy in the study of carbohydrates: characterizing the structural complexity[J]. Concepts in Magnetic Resonance Part A, 2003, 19(1): 1-19.
[22] BHANJA S K, ROUT D, PATRA P, et al. Water-insoluble glucans from the edible fungus Ramaria botrytis[J]. Bioactive Carbohydrates and Dietary Fibre, 2014, 3(2): 52-58.
Structural Identification of α-1,3-Glucan Refined from Mushroom, and Preparation and Characterization of Its Oligomerization Products
ZHANG Hong-tao1, FAN Zun-xiao1, ZHU Li2, ZHAO Xiao-liang3, ZHAN Xiao-bei1,*
(1. Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China; 2. Jiangsu Rayguang Biotech Co. Ltd., Wuxi 214000, China; 3. Key Laboratory of Marine Drugs, Ministry of Education, School of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, China)
Purpose: To refine α-1,3-glucan and acquire a series of α-1,3-gluco-oligosaccharides. Methods: Crude polysaccharides from Lentinula edodes fruit bodies was extracted sequentially with 0.9% NaCl, water, and 5% NaOH/0.05% NaBH4, and then fractional preciptitation was conducted by adjustment of the pH to neutrality with 1 mol/L acetic acid . Five fractions were acquired as LFⅠ, LFⅡ, LFⅣ, PⅢ and PⅣ. The structural identification of PⅣ was carried out using HPLC, IR and NMR methods, and then PⅣ was hydrolyzed with 10 mmol/L TFA and separated with FPLC using Bio-Gel P4 column for obtaining a series of oligosaccharides. Each fraction of PⅣ was characterized by matrix-assisted laser desorption/ionization mass spectrometry (MALDI-MS) and electrospray ionization mass spectrometry (ESI-MS). Results: PⅣ was a linear α-1,3-glucan, and 12 kinds of α-1,3-gluco-oligosaccharides were acquired. Conclusion: A library of α-1,3-gluco-oligosaccharides had been established.
α-1,3-glucan; structural identification; nuclear magnetic resonance (NMR); α-1,3-gluco-oligosaccharide; matrix assisted laser desorption ionization mass spectrometry (MALDI-MS)
O629.1
A
1002-6630(2014)23-0001-06
10.7506/spkx1002-6630-201423001
2014-08-13
國家自然科學基金青年科學基金項目(31201384);國家自然科學基金面上項目(3117164);國家博士后特別資助項目(2014T70472);國家博士后基金項目(2012M20996);江蘇博士后基金和江蘇省資助博士后基金項目(1301011B);國家留學基金委國家建設高水平大學公派研究生項目(2008679005);111引智計劃項目(111-2-06);中央高校基本科研業務費專項資金項目(JUSRP1007)
張洪濤(1979—),男,講師,博士,研究方向為功能寡糖的篩選與生物合成。E-mail:htzhang@jiangnan.edu.cn
*通信作者:詹曉北(1962—),男,教授,博士,研究方向為高黏度發酵技術、微生物多糖生物合成、功能性寡糖制備、生物反應器和傳統發酵食品。E-mail:xbzhan@yahoo.com

