不同糖代謝狀態人群血漿可溶性CD36水平及相關因素研究
陳蕊華,蔣曉真,周龍珠,顧 哲,顧佩莉,周 斌,朱震宏,徐凌燕,鄒宇峰
慢性低水平炎性反應狀態是2型糖尿病(T2DM)的一種伴隨狀態及特征,其與糖尿病的全身性、慢性并發癥的發生發展密切相關。胰島素抵抗會使巨噬細胞上的清道夫受體CD36蛋白高表達,而慢性低水平炎性反應可促使巨噬細胞活化,導致其表面的CD36釋放入血形成可溶性CD36(soluble CD36,sCD36),有研究顯示sCD36可能與胰島素抵抗、糖尿病、動脈硬化密切相關[1]。本研究旨在比較不同糖代謝狀態人群血漿sCD36水平的差異,并探討其影響因素。
1 資料與方法
1.1 入選與排除標準 2011年3月—2012年1月選取上海市浦東新區川沙、合慶及機場鎮3個社區居民,采取社區招募方法,隨機抽樣獲取400例居民作為初篩對象,通過問卷調查和入排標準進行篩選。入選標準:(1)浦東新區上述3個社區長住居民(居住時間≥5年),年齡30~80歲;(2)否認既往糖尿病病史。排除標準:(1)各種腫瘤、結締組織病者;(2)近期外傷史,急、慢性感染,血液病,肝、腎疾病,甲狀腺疾病、皮質醇增多癥、肢端肥大癥等內分泌疾病者;(3)3個月內曾使用糖皮質激素等影響糖代謝的藥物及其他影響血管內皮功能的藥物者。
1.2 臨床資料 經過入排標準篩選、知情同意和問卷調查后獲得234例受試者,其中男83例,年齡38~75歲;女151例,年齡39~73歲。
1.3 研究方法 234例受試者均空腹8~10 h后行75 g葡萄糖耐量試驗,檢測空腹血糖(FPG)和口服葡萄糖后2 h血糖(2 hPG)。根據世界衛生組織(WHO)1999年糖尿病診斷標準, FPG<6.1 mmol/L且2 hPG< 7.8 mmol/L為糖耐量正常(NGT)組; FPG 6.1~<7.0 mmol/L且2 hPG< 7.8 mmol/L為空腹血糖受損(IFG),FPG<6.1 mmol/L且7.8≤2 hPG<11.1 mmol/L為糖耐量受損(IGT),均歸入糖調節受損(IGR)組;FPG≥7.0 mmol/L和/或2 hPG≥11.1 mmol/L,既往未行降糖治療者歸入新診斷糖尿病(NDM)組。234例受試者中,NGT組121例(男31例,女90例),年齡(53±8)歲;IGR組69例(男25例,女44例),年齡(56±9)歲;NDM組44例(男27例,女17例),年齡(53±8)歲。
1.4 觀察指標
1.4.1 一般資料 由專人記錄受試者的既往史、個人史。測定受試者體質量、身高、臀圍及腰圍,計算體質指數(BMI)和腰臀比(WHR)。
1.4.2 實驗室檢查 檢測收縮壓(SBP)、舒張壓(DBP),檢測FPG(采用GOD-POD測定法),三酰甘
油(TG)、總膽固醇(TC)(采用酶試劑測定法),高密度脂蛋白膽醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)(均采用相酶比色法),丙氨酸氨基轉移酶(ALT)、血肌酐(Scr)(采用酶法),尿素氮(BUN)(采用urease-GLDH法),血尿酸(UA)(采用F-DAOS法);以上檢測均使用瑞士羅氏公司Cobas 8000 C701 C502全自動生化儀及配套試劑。空腹胰島素(FINS,采用電化學發光法,瑞士羅氏公司Cobas 6000分析儀 e601模塊化免疫分析系統及配套試劑),糖化血紅蛋白(HbA1c,采用離子交換高速液體色層分析法,日本TOSOH株式會社 HLC-723G7糖化分析儀及配套試劑)。穩態模型評估法計算胰島素抵抗指數(HOMA-IR,HOMA-IR=FINS×FPG/22.5)。血清超敏C反應蛋白(hs-CRP)、血漿sCD36采用雙抗體夾心ABC-ELISA法(上海藍基生物科技有限公司)進行檢測。批內變異系數<8%,批間變異系數<15%。
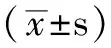
2 結果
2.1 臨床資料比較 NDM組男性比例高于其他兩組(P<0.05),3組年齡間差異無統計學意義(P=0.39)。IGR組與NDM組高血壓病史發生率高于NGT組,BMI、WHR、SBP、DBP高于NGT組(P<0.05,見表1)。
2.2 實驗室檢查指標比較 3組sCD36、hs-CRP、HOMA-IR、HbA1c、FPG、2 hPG、Scr、TG、LDL-C逐漸升高(P<0.05),HDL-C逐漸降低(P<0.05);NDM組的FINS高于NGT組和IGR組(P<0.05)。3組ALT、BUN、TC水平間差異無統計學意義(P>0.05,見表2)。
2.3 sCD36與其他指標的相關性及多元回歸分析 將sCD36與其他指標進行相關分析顯示,sCD36與WHR、FPG、2 hPG、HbA1c、hs-CRP及lg(TG)呈正相關(P<0.05),與性別呈負相關(男=1,女=2)(P<0.01,見表3)。以sCD36為因變量,校正年齡后將上述與sCD36相關的指標為自變量行多元逐步回歸分析,結果顯示FPG、男性、hs-CRP是sCD36水平的獨立影響因素(R2=0.139,P<0.05,見表4)。

表1 3組臨床資料比較Table 1 Comparison of clinical characteristics in three groups
注:與NGT組比較,*P<0.05;與IGR組比較,△P<0.05;▲為χ2值;BMI=體質指數,WHR=腰臀比,SBP=收縮壓,DBP=舒張壓;1 mm Hg=0.133 kPa
注:與NGT組比較,*P<0.05;與IGR組比較,△P<0.05;▲為Z值;hs-CRP=超敏C反應蛋白,FINS=空腹胰島素,HOMA-IR=胰島素抵抗指數,HbA1c=糖化血紅蛋白,FPG=空腹血糖,2 hPG=口服葡萄糖后2 h血糖,ALT=丙氨酸氨基轉移酶,Scr=血肌酐,BUN=尿素氮,UA=血尿酸,TG=三酰甘油,TC=總膽固醇,HDL-C=高密度脂蛋白膽固醇,LDL-C=低密度脂蛋白膽固醇
表4 sCD36影響因素的多元回歸分析結果
Table4 Multivariate regression analysis on influencing factors for sCD36

非標準化系數b SE標準化偏回歸系數t值P值常數2 9870 5095 8630 000FPG0 1710 0530 2043 2050 002性別(男=1,女=2)-0 5230 191-0 175-2 7440 007hs-CRP0 1500 0630 1562 4000 017
注:R2=0.139
3 討論
CD36是一類分布廣泛、生物作用多樣的多配體受體,被認為是氧化修飾型低密度脂蛋白(ox-LDL)的主要結合區域。單核-巨噬細胞表面表達的CD36是識別、內吞ox-LDL的主要清道夫受體,參與泡沫細胞與動脈粥樣硬化的形成。血漿sCD36作為CD36在血中的一種可溶性成分,近年來開始受到學者的關注。多項研究發現,sCD36水平的升高可能與胰島素抵抗、糖尿病、動脈硬化、動脈斑塊的穩定性密切相關[2-4]。Glintborg等[5]研究顯示,多囊卵巢綜合征患者的sCD36水平較正常人顯著升高,提示胰島素抵抗與sCD36升高相關;Handberg等[4]大樣本的橫斷面調查提示IGR人群的比例隨著sCD36四分位數間距的上升而升高,間接提示了IGR人群中sCD36水平可能較糖耐量正常人群更高。本研究結果顯示,IGR組和NDM組的血漿sCD36、hs-CRP水平較糖耐量正常人群顯著升高,與既往研究結果相符,提示sCD36水平升高與糖代謝異常相關。而相關性分析及多元回歸分析提示hs-CRP與sCD36水平相關,hs-CRP是sCD36的獨立影響因素之一,提示慢性低水平炎癥刺激可能是導致sCD36升高的重要原因。這與Handberg等[6]的研究結果相似。
T2DM發病的核心機制為胰島素抵抗及胰島功能減退,胰島素抵抗被認為是與糖尿病相伴隨的動脈粥樣硬化發生的關鍵病理生理機制之一。Handberg等[6]認為,sCD36可能與胰島素抵抗及肥胖導致的低水平炎癥有關。本研究顯示,血漿sCD36的水平升高與男性、WHR、FPG、2 hPG、HbA1c、hs-CRP、TG相關,但與BMI及HOMA-IR并無直線相關性,這一結果與既往研究[5]不符。考慮國外研究中肥胖患者的BMI較高(BMI>30 kg/m2),而本研究中IGR組和NDM組的BMI接近參考范圍,這可能是導致結果無統計學差異的主要原因。而sCD36與HOMA-IR并無直線相關性,這可能與計算胰島素抵抗的公式并非金標準有關,正常血糖高胰島素鉗夾技術可能更有效準確地評估sCD36與胰島素抵抗之間的聯系。但本研究中sCD36與WHR呈正相關,提示中心性肥胖與sCD36水平相關,由于腹部脂肪的堆積是導致全身低水平炎性反應和糖尿病的重要原因[7],也是引起胰島素抵抗的一大因素,因此sCD36與WHR的相關性也從側面提示其水平升高與肥胖、胰島素抵抗及炎性反應有關。
Handberg等[4]研究發現,男性的sCD36水平較女性更高;但國內也有研究認為絕經后T2DM婦女的sCD36水平顯著高于男性[8]。本研究多元回歸分析結果顯示,sCD36升高的影響因子是FPG、男性、hs-CRP水平,提示男性群體可能是導致sCD36升高的重要因素。而本研究中NGT組的女性比例較IGR組和NDM組均顯著升高,可能會得出NGT組的sCD36水平較另兩組更低的結果,導致結果偏移。故有必要在擴大樣本量的同時加強性別的配比,這樣可能更有助于了解sCD36與糖代謝的相關性,以及在中國人群中不同性別群體sCD36水平的差異。
綜上所述,sCD36在糖調節異常階段已開始逐漸升高,其升高與慢性低水平的炎性反應及糖尿病的發生密切相關。sCD36可能是慢性炎癥和糖尿病的一種風險標志物,其在炎癥和糖尿病發病中所發揮的生物學效應和其中的病理生理機制值得進一步研究。
1 Handberg A,Levin K,H?jlund K,et al.Identification of the oxidized low-density lipoprotein scavenger receptor cd36 in plasma a novel marker of insulin resistance[J].Circulation,2006,114(11):1169-1176.
2 Handberg A,Skjelland M,Michelsen AE,et al.Soluble CD36 in plasma is increased in patients with symptomatic atherosclerotic carotid plaques and is related to plaque instability[J].Stroke,2008,39(11):3092-3095.
3 Handberg A,Norberg M,Stenlund H,et al.Soluble CD36 (sCD36) clusters with markers of insulin resistance,and high sCD36 is associated with increased type 2 diabetes risk[J].Journal of Clinical Endocrinology & Metabolism,2010,95(4):1939-1946.
4 Handberg A,H?jlund K,Gastaldelli A,et al.Plasma sCD36 is associated with markers of atherosclerosis,insulin resistance and fatty liver in a nondiabetic healthy population[J].Journal of Internal Medicine,2012,271(3):294-304.
5 Glintborg D,H?jlund K,Andersen M,et al.Soluble CD36 and risk markers of insulin resistance and atherosclerosis are elevated in polycystic ovary syndrome and significantly reduced during pioglitazone treatment[J].Diabetes Care,2008,31(2):328-334.
6 Handberg A,Lopez-Bermejo A,Bassols J,et al.Circulating soluble CD36 is associated with glucose metabolism and interleukin-6 in glucose-intolerant men[J].Diabetes & Vascular Disease Research:Official Journal of the International Society of Diabetes and Vascular Disease,2009,6(1):15-20.
7 Van Greevenbroek MM,Schalkwijk CG,Stehouwer CD.Obesity-associated low-grade inflammation in type 2 diabetes mellitus:causes and consequences[J].The Netherlands Journal of Medicine,2013,71(4):174-187.
8 張曉菲,龐翠軍,肖常青.不同性別2型糖尿病患者分泌型CD36水平變化及頸動脈內膜中層厚度的影響因素研究[J].中國全科醫學,2012,15(2):179-181.
來自本文更多的信息:
B類清道夫受體(SR)CD36是一類功能復雜的蛋白質,其廣泛表達于體內的眾多細胞表面,被認為可能與炎性反應、脂代謝、糖尿病及動脈硬化的發生有關。胰島素抵抗會使巨噬細胞上的CD36蛋白高表達,而慢性低水平炎性反應促使巨噬細胞活化。活化后的CD36膜外可溶性氨基酸肽鏈斷裂后釋放至血漿中,形成了可溶性CD36(sCD36)。血漿sCD36水平與糖尿病及炎性反應的關系目前尚不明確,本研究旨在通過分析不同糖代謝人群體內的炎性反應和sCD36水平來了解sCD36的水平變化及其影響因素,以了解sCD36是否是炎性反應和糖代謝異常的一個風險標志物。

