戊四氮誘導大鼠癲癇模型中前腦磷酸化DARPP-32與嗜酸損傷神經元的相關性研究
王偉文,廖曉陽,楊正輝,林 航,王慶松,吳俞憲,劉 榆
Dazzi等[1]研究報道,在重復系統給予亞驚厥劑量戊四氮(PTZ)誘發的癲癇模型中,位于前腦皮質、伏隔核及紋狀體等區域的細胞外多巴胺神經遞質水平明顯升高,并且這種內源性多巴胺神經遞質的升高與中樞神經元的興奮毒性有關[2]。DARPP-32(dopamine and adenosine 3′5′-monophosphate-regulated phospho-protein,Mr 32 kD)是多巴胺下游作用的一個重要分子靶點,主要分布于含有D1受體的神經元上,磷酸化DARPP-32(p-DARPP-32)在多巴胺調解包括N-甲基-D-天冬氨酸(NMDA)、γ-氨基丁酸(GABA)等各類興奮或抑制性神經遞質生物學效應方面扮演著中心角色[3-4]。那么,p-DARPP-32在PTZ誘發的癲癇模型中是否介入了癲癇所致的神經元損傷是本研究所探討的問題。本實驗應用免疫酶組織化學及蘇木素-伊紅染色法研究PTZ誘導的全面性癲癇大發作后DARPP-32在大鼠前腦的磷酸化表達分布情況及其時程變化與嗜酸損傷神經元時程變化之間的可能聯系,以探討p-DARPP-32在實驗性大鼠癲癇模型中存在的神經元損傷所扮演的角色。
1 材料與方法
1.1 實驗動物 健康成年雄性SD(Sprague-Dawley)大鼠35只, 體質量210~230 g(第四軍醫大學實驗動物中心提供),置于溫暖(20 ℃)、安靜環境中飼養48 h。
1.2 實驗分組與模型制備
1.2.1 實驗分組 采用隨機數字表法將大鼠分為5個實驗組(n=5)和1個對照組(n=10):(1) A組:PTZ 1 h,大鼠在PTZ誘發癲癇發作1 h后被處死,后幾組按相應的時間處死;(2) B組:PTZ 6 h;(3) C組:PTZ 24 h;(4)D組:PTZ 48 h;(5)E組:PTZ 72 h;(6)對照組大鼠接受同樣體積和次數的0.9%氯化鈉溶液腹腔注射,而后在與上述各組相應的時間點被處死,每個時間點2只大鼠。
本文創新點
盡管實驗動物癲癇模型中將嗜酸神經元作為觀察腦神經元凋亡、壞死指標的文獻報道很多,但在重復系統給予亞驚厥劑量的戊四氮(PTZ)誘導癲癇持續狀態模型中有關嗜酸神經元數量在前腦時程變化的文獻報道較少。DARPP-32是多巴胺下游作用的一個重要分子靶點,磷酸化DARPP-32(p-DARPP-32)在多巴胺調解包括N-甲基-D-天冬氨酸(NMDA)、γ-氨基丁酸(GABA)等各類興奮或抑制性神經遞質生物學效應方面扮演著核心角色。而有關DARPP-32在癲癇動物模型中前腦的磷酸化表達更是少有報道,本研究即通過對PTZ誘導的癲癇持續狀態模型中p-DARPP-32在大鼠前腦的表達分布及時程變化狀況來推測DARPP-32可能參與了癲癇模型病理生理的調控。通過對該癲癇模型中p-DARPP-32時程變化與嗜酸損傷神經元時程變化之間存在的同步正相關分析以間接證明p-DARPP-32在該模型所致的神經元損傷中發揮著作用。
1.2.2 模型制備 各實驗組大鼠均接受重復低劑量PTZ腹腔注射以最終達到全身性癲癇持續狀態(SE)。重復PTZ腹腔注射方案:首劑給予20 mg/kg PTZ,然后每間隔10 min腹腔注射10 mg/kg PTZ直至SE發作。SE發作的特征是:大鼠出現連續的跌倒強直發作期(10~15 s),而后反復出現幾分鐘的頭和肢體的陣攣性發作[5]。大鼠在SE發作后被放回溫暖(20 ℃)、安靜環境中飼養,分別在相應的時間被處死[6]。
1.3 切片制備 大鼠經1%戊巴比妥鈉(40 mg/kg)腹腔注射深度系統麻醉后,予以左心室至升主動脈插管,含40 g/L多聚甲醛的0.1 mol/L磷酸緩沖液(PBS,pH 7.4)灌流固定,冷凍切片機上行全腦組織連續冠狀切片,30 μm厚的組織切片被收集用于以后的免疫組織化學染色分析。
1.4 免疫組織化學染色 各實驗組全腦系列切片行免疫組織化學染色(ABC法),首先一抗(兔抗p-DARPP-32, Cell Signaling, 1∶150) 4 ℃孵育48 h;其次二抗(驢抗兔生物素標記的IgG,Check, 1∶400)室溫孵育4 h;最后ABC復合物(Vector, 1∶400)室溫下孵育2 h,二氨基聯苯胺(DAB)棕色顯色,切片經晾干、脫水、透明后封片。在Olympus BX-60顯微鏡下分析觀察結果,并采集圖像。對照實驗中用正常兔血清替代一抗,余染色步驟同前。半定量分析位于大鼠皮質、海馬和紋狀體區域SE發作后不同時段的p-DARPP-32陽性神經元數量,每只大鼠每個區域挑選6~8張切片(雙側)用以計數。
1.5 蘇木素-伊紅染色 各實驗組經全腦系列切片后進行常規蘇木素-伊紅染色,顯示嗜酸損傷神經元在大鼠皮質、海馬及紋狀體區域的分布數量。
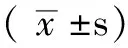
2 結果
2.1 不同組大鼠皮質、海馬和紋狀體p-DARPP-32陽性神經元數量比較 不同組大鼠皮質、海馬和紋狀體p-DARPP-32陽性神經元數量比較,差異均有統計學意義(P<0.05);其中與對照組比較,A組、B組、C組、D組、E組大鼠皮質、海馬和紋狀體p-DARPP-32陽性神經元數量均升高,差異有統計學意義(P<0.05);A組與B組比較,差異均無統計學意義(P>0.05);C組較A組和B組均降低,差異有統計學意義(P<0.05);D組和E組較C組均降低,差異有統計學意義(P<0.05);D組與E組比較,差異均無統計學意義(P>0.05,見表1)。
2.2 p-DARPP-32陽性神經元在大鼠前腦的表達分布 PTZ誘發SE發作1 h后,p-DARPP-32陽性神經元在大鼠前腦存在著廣泛的分布。在皮質,p-DARPP-32陽性神經元主要分布于Ⅱ、Ⅲ和Ⅴ層,主要表達在胞質、胞核上;在海馬,p-DARPP-32陽性神經元在CA2、CA3區呈密集分布,而在CA1、CA4及齒狀回亞區也有散在的表達,且p-DARPP-32主要表達在胞質及胞核上;在紋狀體,p-DARPP-32陽性神經元主要分布在中間棘神經元的胞質和胞核中(見圖1)。
2.3 不同組大鼠皮質、海馬和紋狀體嗜酸損傷神經元數量比較 不同組大鼠皮質、海馬和紋狀體嗜酸損傷神經元數量比較,差異均有統計學意義(P<0.05);其中與對照組比較,A組、B組、C組、D組、E組大鼠皮質、海馬和紋狀體嗜酸損傷神經元數量均升高,差異有統計學意義(P<0.05);B組較A組升高,差異均有統計學意義(P<0.05);C組較B組均升高,差異有統計學意義(P<0.05);C組、D組、E組比較,差異均無統計學意義(P>0.05,見表2)。
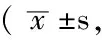
Table1 Comparison of the number of p-DARPP-32 positive neurons in cortex, hippocampus and corpus striatum of different groups

組別只數皮質海馬紋狀體對照組10194±54350±91430±134A組5420±106?1074±345?890±296?B組5397±113?1030±373?880±314?C組5330±74?△▲792±243?△▲673±217?△▲D組5277±77?☆670±191?☆500±157?☆E組5260±58?☆654±172?☆492±147?☆F值10093311477178952P值<0001<0001<0001
注:與對照組比較,*P<0.05;與A組比較,△P<0.05;與B組比較,▲P<0.05;與C組比較,☆P<0.05

注:a(免疫組織化學,×40)、a′(免疫組織化學,×400)皮質,b(免疫組織化學,×40)、b′(免疫組織化學,×400)海馬, c(免疫組織化學,×40)、c′(免疫組織化學,×400)紋狀體
圖1 PTZ誘導SE發作1 h后,p-DARPP-32陽性神經元在皮質、海馬及紋狀體區域的分布
Figure1 Distribution of p-DARPP-32 positive neurons in cortex, hippocampus and corpus striatum one hour after the onset of SE induced by PTZ
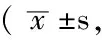
Table2 Comparison of the number of acidophilic neurons in cortex, hippocampus and corpus striatum of different groups

組別只數皮質海馬紋狀體對照組10060±041020±004134±037A組5280±138?048±009?580±201?B組5461±200?△178±048?△1344±483?△C組5870±283?▲389±087?▲1780±681?▲D組51074±431?397±084?2000±502?E組5922±378?401±113?1970±511?F值203628648593298800P值<0001<0001<0001
注:與對照組比較,*P<0.05;與A組比較,△P<0.05;與B組比較,▲P<0.05
2.4 光鏡下損傷神經元的病理特征 PTZ誘導SE發作后,嗜酸損傷神經元在包括皮質、海馬及紋狀體在內的前腦區域均可觀察到。嗜酸損傷神經元均顯示出細胞核固縮及胞體形狀不規則,胞質、胞核呈伊紅著色,部分區域尚有炎性細胞浸潤(見圖2)。
3 討論
本研究結果顯示,PTZ誘導SE發作后p-DARPP-32在大鼠前腦皮質、海馬及紋狀體均存在著明顯表達,且主要表達在神經元的胞質、胞核上,其總體分布與DARPP-32在前腦的分布相重疊[7]。且p-DARPP-32的表達存在著一個時程變化,即發作1 h、6 h后p-DARPP-32在前腦神經元的表達達到了高峰,24 h后開始逐漸下降。同樣,嗜酸損傷神經元數量也存在著時程變化,即SE發作后嗜酸損傷神經元數量在相同時點開始逐漸升高,其上升趨勢在發作24 h后才逐漸停止。SE發作24 h內p-DARPP-32與嗜酸損傷神經元數量同步增長;24 h后p-DARPP-32表達的水平下降時,嗜酸神經元數目的增加也趨于平緩。
癲癇是一種因大腦半球局部神經元電活動過度活躍所致的以臨床發作為特征的病理狀況。而癲癇持續狀態則常導致廣泛性的腦神經元損傷。具體的損傷機制尚不清楚,部分原因可能與神經元細胞內的鈣超載,最終導致細胞毒性損傷有關[8]。Fujikawa[9]應用蘇木素-伊紅染色法來評價癲癇所致的急性神經元損傷,認為陽性嗜酸損傷神經元在光鏡水平上可作為評價不可逆損傷神經元的標準。并且,光鏡水平下腦的嗜酸細胞已經被證明與電鏡下的細胞壞死密切關聯[10]。文獻中所描述的嗜酸損傷神經元在光鏡下顯示為細胞核的固縮及胞核、胞質伊紅著色,本實驗中所觀察到的嗜酸損傷神經元特征基本與之一致。SE發作1 h后,嗜酸神經元數量在大鼠前腦開始逐漸升高,直至發作24 h后其上升趨勢才逐漸停止。癲癇發作后腦神經元出現凋亡、壞死在以往的文獻中多有報道[8],但缺乏嗜酸損傷神經元發生、發展變化時程的報告,尤其在PTZ誘導的SE模型中。

注:a對照組皮質,a′ C組皮質、b對照組海馬,b′ C組海馬,c對照組紋狀體,c′ C組紋狀體
圖2 PTZ誘導SE發作后嗜酸損傷神經元在大鼠前腦區域的鏡下特征(蘇木素-伊紅染色,×400)
Figure2 Pathological features of acidophilic neurons in rat forebrain by light microscopy
以往PTZ誘導的癲癇模型中已有報道,位于前腦皮質、紋狀體等區域的細胞外多巴胺神經遞質水平明顯升高,且多巴胺水平的增加與所給PTZ劑量呈正性線性相關[1,7]。而DARPP-32是多巴胺下游作用的一個重要分子靶點,該模型中多巴胺神經遞質可能通過激活D1/DARPP-32/PPI信息鏈導致DARPP-32磷酸化[11]。這從理論上解釋PTZ誘導的癲癇模型中DARPP-32存在著磷酸化變化。
另外,有趣的是嗜酸損傷神經元數量逐漸增高的這一時程變化與p-DARPP-32表達的時程變化有一定的相關性。SE發作后24 h內呈正相關,24 h后p-DARPP-32表達的水平開始下降,可能是DARPP-32的磷酸化表達已經達到頂峰,并開始衰減。而嗜酸損傷神經元數目的增加趨于平緩可能與p-DARPP-32的衰減有關,而本身存在的嗜酸損傷神經元數目在一段時間內不會減少或消失。Dazzi等[1]研究報道,在重復系統給予亞驚厥劑量PTZ誘發的癲癇模型中,位于前腦皮質、伏隔核及紋狀體等區域的細胞外多巴胺神經遞質水平明顯升高,并且這種內源性多巴胺神經遞質的升高與中樞神經元的興奮毒性有關[2]。DARPP-32是多巴胺下游作用的一個重要分子靶點,主要分布于含有D1受體的神經元上,p-DARPP-32在多巴胺調解包括NMDA、GABA等各類興奮或抑制性神經遞質生物學效應方面扮演著中心角色[3-4]。SE發作后細胞外多巴胺遞質水平的升高可能最終通過激活多巴胺/D1/DARPP-32/PP-1信息鏈而使大鼠前腦神經元上的DARPP-32磷酸化,繼而通過調節NMDA受體、α-氨基-3-羥基-5-甲基-4-異惡唑丙酸受體(AMPA受體)及左型Ca2+通道磷酸化的活性或提高這些離子通道介導的Ca2+內流,使細胞內Ca2+水平升高,而異常的Ca2+內流在神經元興奮毒方面起著重要作用[11-13]。上述理論預示了SE發作后p-DARPP-32表達與嗜酸損傷神經元在大鼠前腦同步變化可能存在因果關系。因此,后期對模型中同步多巴胺水平的變化監測及p-DARPP-32和凋亡神經元的定量分析將進一步闡明本研究結果。
綜上所述,在重復系統給予亞驚厥劑量PTZ誘發的癲癇模型中,本實驗通過對p-DARPP-32在大鼠前腦的表達分布及其時程變化與嗜酸損傷神經元數量時程變化的關系研究結果提示,SE發作后p-DARPP-32與嗜酸損傷神經元數量的時程變化有著一定的同步相關性,即SE發作后同步上升,24 h后p-DARPP-32表達的水平下降,而嗜酸損傷神經元數量的增加也趨于平緩。癲癇發作后,多巴胺激活D1/PKA/DARPP-32/PP-1信息鏈可能是導致大鼠前腦神經元廣泛性損傷的重要原因之一,而p-DARPP-32在多巴胺發揮生理作用方面扮演著重要角色。
1 Dazzi L, Serra M, Porceddu ML, et al.Enhancement of basal and pentylenetetrazol(PTZ)-stimulated dopamine release in the brain of freely moving rats by PTZ-induced kindling[J].Synapse, 1997, 26(4):351-358.
2 Filloux F, Townsend JJ.Pre- and postsynaptic neurotoxic effects of dopamine demonstrated by intrastriatal injection[J].Exp Neurol, 1993, 119(1):79-88.
3 Greengard P,Nairn AC,Girault JA,et al.The DARPP-32/protein phosphatase-1 cascade:a model for signal integration[J].Brain Research Reviews,1998, 26(2/3):274-284.
4 Flores-Hernandez J,Hernandez S, Snyder GL, et al.D1 dopamine receptor activation reduces GABA(A) receptor currents in neostriatal neurons through a PKA/DARPP-32/PP1 signaling cascade[J].J Neurophysiol,2000, 83(5):2996-3004.
5 Nehlig A,Pereira de Vasconcelos A.The model of pentylentetrazol-induced status epilepticus in the immature rat:short- and long-term effects[J].Epilepsy Research, 1996, 26(1):93-103.
6 Gubits RM, Hazelton JL, Simantov R.Variations in c-fos gene expression during rat brain development[J].Brain Res, 1988,427(2):197-201.
7 Wang WW, Cao R, Chen LW, et al.Differetial expression of NMDA and AMPA receptor subunits in DARPP-32-containing neurons of the cerebral cortex, hippocampus and neostriatum of rats[J].Brain Research, 2004, 998(2):174-183.
8 Fujikawa DG, Zhao S, Ke X,et al.Mild as well as severe insults produce necrotic, not apoptotic, cells:evidence from 60-min seizures[J].Neurosci Lett, 2010, 469(3):333-337.
9 Fujikawa DG.The temporal evolution of neuronal damage from pilocarpine-induced status epilepticus[J].Brain Res, 1996, 725(1):11-22.
10 Ingvar M, Morgan PF, Auer RN.The nature and timing of excitotoxic neuronal necrosis in the cerebral cortex, hippocampus and thalamus due to flurothyl-induced status epilepticus[J].Aeta Neuropathol, 1988, 75(4):362-369.
11 Snyder GL, Fienberg AA, Huganir RL, et al.A dopamine/D1 receptor/protein kinase A/dopamine- and cAMP regulated phosphoprotein(Mr 32 kDa)/protein phosphatase-1 pathway regulates dephosphorylation of the NMDA receptor[J].J Neurosci,1998,18(24):10297-10303.
12 Sharopov S, Moser J, Chen R, et al.Dopaminergic modulation of low-Mg2+-induced epileptiform activity in the intact hippocampus of the newborn mouse in vitro[J].J Neurosci Res,2012,90(10):2020-2033.
13 Rocha L, Alonso-Vanegas M, Villeda-Hernández J, et al.Dopamine abnormalities in the neocortex of patients with temporal lobe epilepsy[J].Neurobiol Dis,2012,45(1):499-507.

