豬肉源大腸桿菌對抗生素及消毒劑的耐藥性
何雪梅,郭莉娟,吳國艷,程 琳,李 蓓,羅 燕,鄒立扣,*,卿玲杉
(1.四川農業大學資源環境學院,四川 成都 611130;2.四川農業大學都江堰校區微生物學實驗室,四川 都江堰 611830;3.河北聯合大學生命科學學院,河北 石家莊 050018)
豬肉源大腸桿菌對抗生素及消毒劑的耐藥性
何雪梅1,2,郭莉娟1,2,吳國艷1,2,程 琳2,李 蓓2,羅 燕2,鄒立扣1,2,*,卿玲杉3
(1.四川農業大學資源環境學院,四川 成都 611130;2.四川農業大學都江堰校區微生物學實驗室,四川 都江堰 611830;3.河北聯合大學生命科學學院,河北 石家莊 050018)
從四川省各市縣收集豬肉樣品130份,選擇性培養基分離大腸桿菌后VITEK進行鑒定,采用K-B法藥敏實驗測試大腸桿菌對10種藥敏紙片的耐藥性。瓊脂稀釋法測定大腸桿菌對3種季銨鹽消毒劑的MIC值,PCR擴增10種季銨鹽類消毒劑耐藥基因。結果表明:130份豬肉樣品中分離大腸桿菌96株,分離率為73.85%,其中73株對抗生素產生耐藥性,耐藥率分別為:TET(64.58%)、AMP(37.50%)、S(32.29%)、K(21.88%)、KF(20.83%)、CIP(18.75%)、CN(9.38%)、SAM(6.25%)、CAZ(2.08%)、CRO(2.08%),共產生了28種耐藥譜,TET是最主要的譜型;96株大腸桿菌對季銨鹽消毒劑BC、DDAC、CTAB的MIC分別為:16~64 μg/mL、8~32 μg/mL、64~256 μg/mL;QACs耐藥基因檢出率分別為ydgE/F(81.25%)、mdfA(50%)、sugE(c)(45.83%)、emrE(36.46%)、 qacEΔ1(19.79%)、qacF(17.71%)、qacE(14.58%)、sugE(p)(3.13%),qacG-未檢出。共檢出42種消毒劑耐藥基因組合(1.04%~12.50%)。sugE(c)、qacF基因與氨基糖苷類及AMP耐藥相關,qacEΔ1基因與AMP耐藥相關。四川省肉源大腸桿菌污染情況較嚴重,菌株對抗生素的耐藥率及多重耐藥相對較低,對季銨鹽類消毒劑MIC 較高,消毒劑耐藥基因檢出率較高,應引起足夠重視,加強對 其檢測。
豬肉;大腸桿菌;耐藥;抗生素;消毒劑
近年來,食品安全已成為我國重大社會問題之一,而由病原微生物引起的食源性疾病嚴重威脅著人類身體健康,是食品安全問題產生的主要原因[1-3]。肉類是高營養、高水分的食品,最適于細菌的生長繁殖[4],對人類健康構成威脅。四川省是我國豬肉產量和消費量最多的省份[4],近年研究顯示我國豬肉中大腸桿菌污染較嚴重[5-6]。大腸桿菌是腸桿菌科細菌的代表菌種,為條件性致病菌,是食品衛生監測的重要指示菌,由其引起的食物中毒病例在食物中毒中居于前列。為了防治肉源性病原微生物的危害,畜禽生產過程中常使用抗菌藥物,抗菌藥物的不合理使用導致病原微生物產生耐藥性,耐藥菌群易通過食物鏈傳播給人類[7],導致常用抗生素失效[8-9]。畜禽養殖及肉食品加工過程中,為了防止病原微生物的危害,常常使用季銨鹽類(quaternary ammonium compounds,QACs)消毒劑對養殖加工環境消毒,早在1952年,Chaplin[10]就發現了大腸桿菌對QACs的耐受現象,近年來,有學者研究發現,大腸桿菌對常用的QACs耐藥率較高[11-12],有些耐藥菌株同時表現出對QACs與抗生素的抗性,帶來了公共安全風險[13]。
本實驗從四川省豬肉源中分析菌株污染情況,測定菌株抗生素和消毒劑耐藥表型,檢測消毒劑耐藥基因型,探究消毒劑耐藥基因型與消毒劑及抗生素耐藥的關系,為畜牧生產中養殖廠消毒劑、抗生素的選擇和合理使用提供依據,為抗生素及消毒劑耐藥性防控提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
2010年7~9月,采集成都、廣漢、德陽等四川省地級市超市冷鮮豬肉或農貿市場的新鮮豬肉共130份。
1.1.2 培養基與試劑
緩沖蛋白胨水(buffer peptone water,BPW)、伊紅美藍培養基 (Eosin methylene blue agar,EMB)、蛋白胨大豆瓊脂培養基(triptic soy agar,TSA)、蛋白胨大豆肉湯培養基(triptic soy broth,TSB)、蛋白胨水培養基(吲哚實驗)、氧化酶實驗試紙 杭州微生物試劑有限公司;雙倍麥康凱肉湯培養基 上海寶曼生物科技有限公司;水解酪蛋白(Mueller-Hinton,MH)液、固體(Muller Hinton agar,MHA)培養基 廣州環凱生物技術有限公司。
瓊脂糖、聚合酶鏈反應(polymerase chain reaction,PCR)試劑、Marker DL2000 天根生物技術(北京)有限公司;季銨鹽類消毒劑:苯扎氯銨(benzalkonium chloride,BC)、溴化十六烷基三甲銨(cetyltrimethylammonium bromide,CTAB)、雙十烷基二甲基氯化銨(N,N-didecyl-N,N-dimethylammonium chloride,DDAC) 成都貝斯特試劑有限公司。
1.2 藥敏紙片
β-內酰胺類主要包括以下種類:頭孢類:頭孢曲松(ceftriaxone,CRO,30 μg/片)、頭孢他啶(ceftazidime,CAZ,30 μg/片)、頭孢噻吩(ceftofur,KF);青霉素類:氨芐西林(ampicillin,AMP,10 μg/片);β-內酰胺/β-內酰胺酶抑制劑復合物:氨芐西林/舒巴坦(ampicillin/sulbactam,SAM,10 μg/片);氨基糖苷類:慶大霉素(gentamicin,CN,10 μg/片)、卡那霉素(kanamycin,K,30 μg/片)、鏈霉素(streptomycin,S,10 μg/片);四環素類:四環素(tetracycline,TET,30 μg/片);氟喹諾酮類:環丙沙星(ciprofl oxacin,CIP,5 μg/片)。藥敏紙片均購自杭州微生物試劑有限公司。
1.3 儀器與設備
顯微鏡 德國Leica公司;凝膠成像系統、PCR儀、電泳儀 美國Bio-Rad公司;5804R高速冷凍離心機、單通量可調微量移液器 德國Eppendorf公司;小型渦旋振蕩器 德國IKA公司;水浴鍋 上海佑柯儀器設備有限公司;恒溫培養箱 哈爾濱東聯電子技術開發有限公司;FA2004電子天平 上海舜宇恒平科學儀器有限公司;MIT-60P型多點接種儀 日本佐久間公司。
1.4 引物的合成
季銨鹽類消毒劑耐藥基因的10對引物是根據GenBank公布的有關序列設計,由生工生物工程(上海)股份有限公司合成,如表1所示。
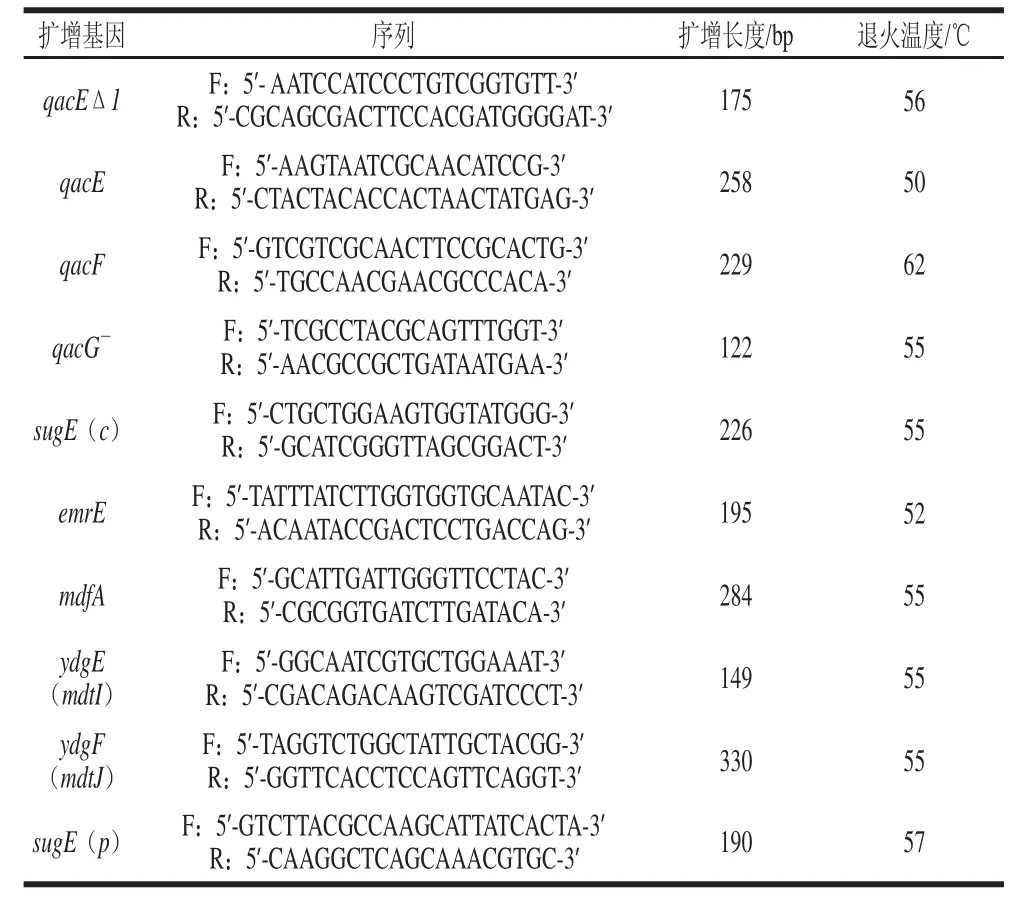
表1 季銨鹽類消毒劑耐藥基因引物及序列Table 1 QACs resistance genes and primers
1.5 方法
1.5.1 樣品的采集和處理
四川省各采集點隨機購買冷鮮肉或新鮮豬肉1份,每份50 g左右,無菌袋封好后放置于帶冰袋的有蓋的泡沫箱中,密封好泡沫箱后運回實驗室,4 ℃保存,96 h內處理。
1.5.2 菌株的分離、純化及鑒定
取各樣品25 g加入225 mL BPW,在無菌塑料袋里充分振蕩,取50 mL各樣品的洗液到無菌三角燒瓶,加入50 mL雙倍麥康凱肉湯培養基,充分混勻后于35 ℃培養24 h;接種環挑取以上肉湯培養物劃線到EMB瓊脂平板上35 ℃培養24 h;選擇生長良好的紫黑色有金屬光澤的菌落劃線到TSA瓊脂平板;吲哚和氧化酶實驗后,用含有20%甘油的TSB保存于-60~-80 ℃冰箱,采用VITEK微生物鑒定系統進行鑒定,菌株貯存于含15%甘油的TSB培養基中,-80 ℃保存備用。
1.5.3 藥敏實驗
采用紙片瓊脂擴散法(K-B法)[14],根據美國臨床和實驗室標準協會推薦方法進行操作。挑取待試菌純培養物單菌落,TSA劃線后37 ℃培養16~18 h;棉簽刮取菌落,使菌液濃度為0.5麥氏比濁;用無菌棉簽蘸取菌液涂布于MHA瓊脂平板上,60°旋轉涂布,工作臺靜置5 min;鑷子滅菌后分別夾取藥敏紙片,按一定間隔貼在平板的不同區域, 兩紙片間距不小于3 cm,紙片距邊緣不小于1.5 cm;37 ℃恒溫培養16~18 h;用游標卡尺量取各種抗生素紙片周圍抑菌環直徑。
1.5.4 大腸桿菌消毒劑最小抑菌濃度(minimum inhibitory concentration,MIC)的測定
將待測菌株及標準菌株E. coli ATCC10536劃線接種于TSA培養基,37 ℃培養16~18 h,按照1.5.3節的方法制備菌懸液后再進行10倍稀釋;用二倍稀釋法分別配制含有BC、DDAC、CTAB的MHA培養基,質量濃度依次為0.125、0.25,…,1 024 μg/mL;用MIT-60P型細菌多點接種儀將菌液接種到含消毒劑的MHA平板表面,每個樣的接種量為1 μL左右,每點菌數約為104CFU[15],接種后37 ℃ 培養過夜;平板置于暗色、無反光物體表面上判斷實驗終點,以抑制細菌生長的最低消毒劑質量濃度為大腸桿菌MIC值。
1.5.5 消毒劑耐藥基因檢測
煮沸法制備模板,無菌棉簽刮取大腸桿菌菌落,置于1.5 mL Eppendorf離心管里,加無菌水700 μL,振蕩混勻后沸水浴10 min,13 000 r/min離心2 min,將上清儲存在-20 ℃中。PCR擴增體系:PCR mix 12.5 μL,上下游引物各0.5 μL,模板2.5 μL,無菌去離子水9 μL,總體積25 μL。擴增循環條件:95 ℃預變性5 min,95 ℃變性1 min、退火(退火溫度如表1所示)30 s、72 ℃延伸30 s,共進行30個循環;最后72 ℃延伸10 min;擴增產物經1.0%瓊脂糖凝膠電泳后用凝膠成像系統觀察并保存。
2 結果與分析
2.1 豬肉中大腸桿菌污染情況
自1986年美國大腸桿菌O157∶H7首次爆發以來,各國對大腸桿菌重視程度越來越高,是食品衛生和流行病學領域最重要研究對象之一,2006—2009年,只帥等[16]采自陜西省西安市及楊凌示范區超市及農貿市場樣品,發現豬肉中大腸桿菌檢出率為88%(30/34)。2010年,史秋梅等[17]從河北省不同地區集貿市場和超市采樣,發現豬肉中大腸桿菌陽性檢出率為23.8%(5/21)。本實驗采集四川省地級市超市冷鮮豬肉或農貿市場的新鮮豬肉共130份,從不同樣品中分離大腸桿菌96株,分離率為73.85%,可見,四川省豬肉中大腸桿菌污染較為嚴重。
2.2 豬肉中大腸桿菌抗生素耐藥性
2.2.1 耐藥率
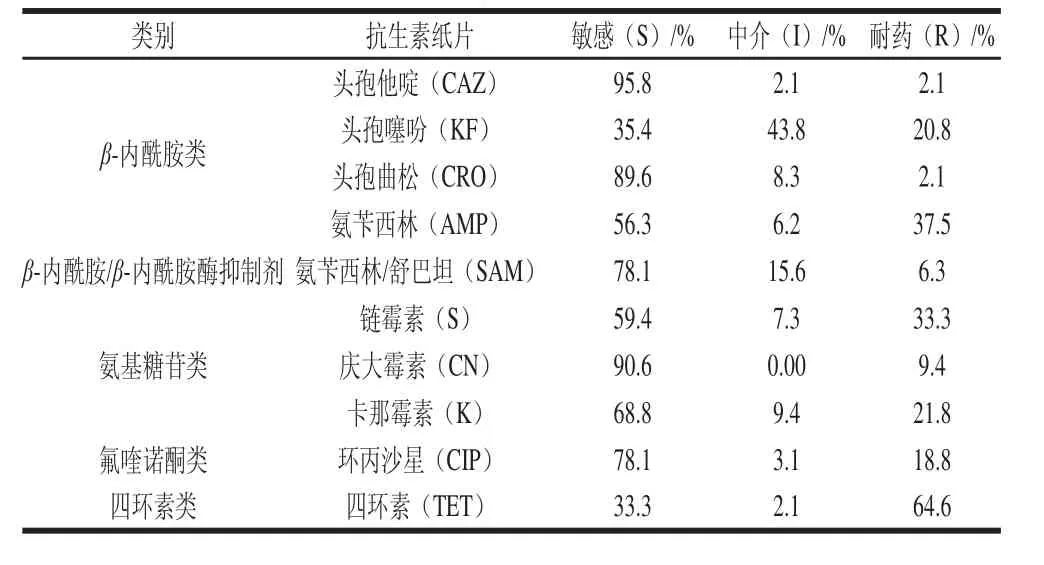
表2 96株大腸桿菌對10種抗生素的耐藥率Table 2 Drug-resistance frequency of 96E. coli isolates against 10 antibiotics
由表2可知,96株大腸桿菌對抗生素的耐藥率分別為TET(64.6%)、AMP(37.5%)、S(33.3%)、K(21.8%)、KF(20.8%)、CIP(18.8%)、CN(9.4%)、SAM(6.3%)、CAZ(2.1%)、CRO(2.1%)。大腸桿菌對TET耐藥率最高(64.6%),對KF中介率較高(43.8%),存在耐藥率上升趨勢,敏感率最高兩種抗生素分別是CAZ(95.8%),CN(90.6%)。從抗生素類別來看,耐藥率大小依次為:四環素類(64.6%)>β-內酰胺類(2.1%~37.5%)>氨基糖苷類(9.4%-33.3%)>氟喹諾酮類(18.8%)>β-內酰胺/β-內酰胺酶抑制劑(6.3%)。
2.2.2 耐藥譜
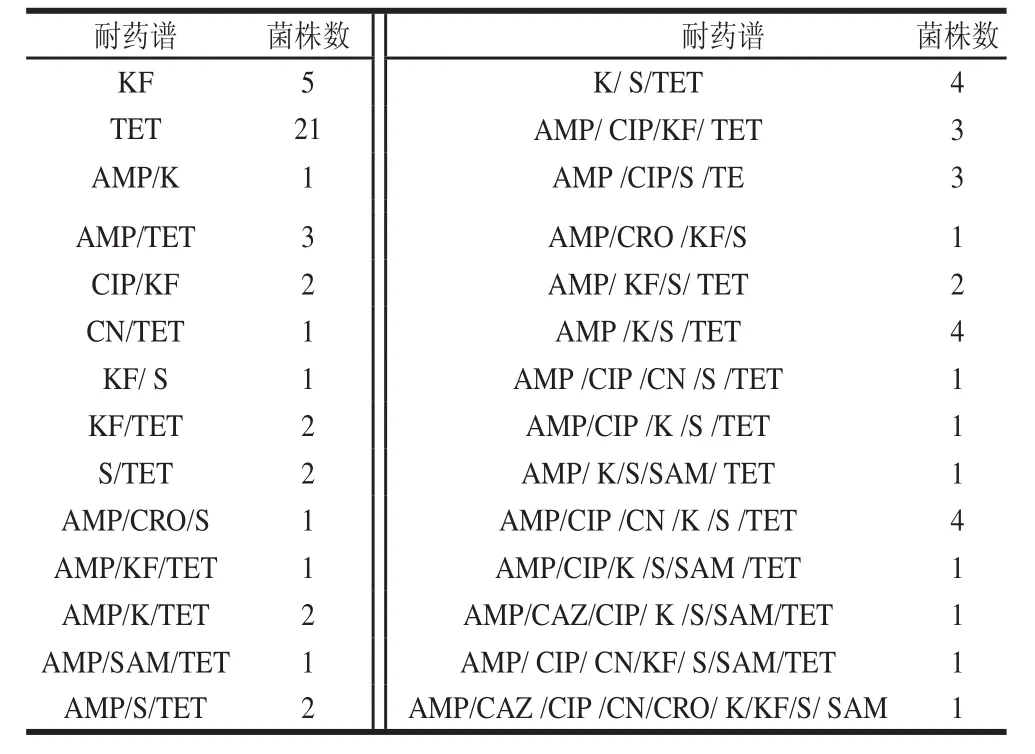
表3 大腸桿菌耐藥譜Table 3 Drug resistance profiles of E. coli isolates
由表3可知,97株大腸桿菌中73株產生了耐藥性,大腸桿菌對10種抗生素產生了28種耐藥譜,其中26株(26.78%)耐1種抗生素,12株耐2種抗生素,35株(36.46%)耐3種及3種以上抗生素。只帥等[16]發現748株大腸桿菌中多重(n≥3)耐藥大腸桿菌分離率為73.9%,何嘉儀等[18]發現28株大腸桿菌中耐6種藥物以上的占供試菌株的70%以上,本次實驗多重(n≥3)耐藥率為36.46%,與鄒立扣等[19]2012年的報道相比,大腸桿菌多重耐藥相對較輕。
2.3 大腸桿菌消毒劑耐藥性
2.3.1 大腸桿菌消毒劑耐藥表型
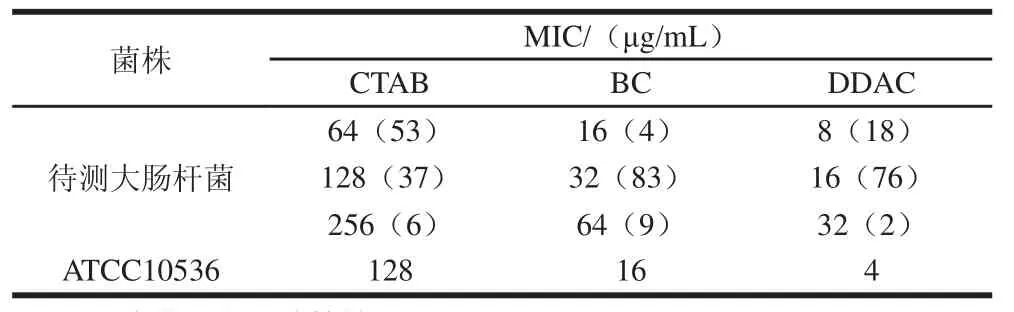
表4 季銨鹽類消毒劑及質控菌株對大腸桿菌的MICTable 4 MIC of the QACs against 96 E. coli isolates and quality control strain
由表4可知,不同的消毒劑MIC值不同,大腸桿菌消毒劑MIC值CTAB>BC>DDAC,大腸桿菌抑菌效果最好的是DDAC。Sidhu等[20]將BC的MIC值大于30 μg/mL定義為耐藥,并在分離于肉類食品的600株大腸桿菌中發現1株BC耐藥菌。本次實驗結果表明大腸桿菌對BC的耐藥率較高為86.45%(83/96);Buffet-Bataillon等[21]從醫院病人中分離到153株大腸桿菌,DDAC 的MIC值為2~16 μg/mL,其中57.5%(88/153)MIC值為8 μg/mL,ATCC 10536為4μg/mL,本次實驗結果DDAC的MIC值較高為8~32 μg/mL,大腸桿菌對DDAC的耐藥較普遍。
2.3.2 大腸桿菌消毒劑耐藥基因型
除qacG-未檢出外,其他基因均有檢出,且條帶大小與擴增長度相同(圖1)。本次實驗中消毒劑耐藥基因檢出率從大到小依次為ydgE/F(81.25%)、mdfA(50%)、sugE(c) (45.83%)、emrE(36.46%)、qacEΔ1(19.79%)、qacF(17.71%)、qacE(14.58%)、sugE(p)(3.13%),qacG-未檢出。由于攜帶了qacEΔ1基因,陽性株可以將Qacs類化合物排出菌體從而提高自身的抗力,2008年Wang等[22]研究了中國臨床革蘭氏陰性菌qacEΔ1基因流行情況,發現大腸桿菌中qacEΔ1檢出率為60.3%;2012年,Pastrana-Carrasco等[11]檢測59株產超廣譜β-內酰胺酶的腸桿菌,發現68%的耐藥菌檢出qacEΔ1,本次qacEΔ1檢出率較低。
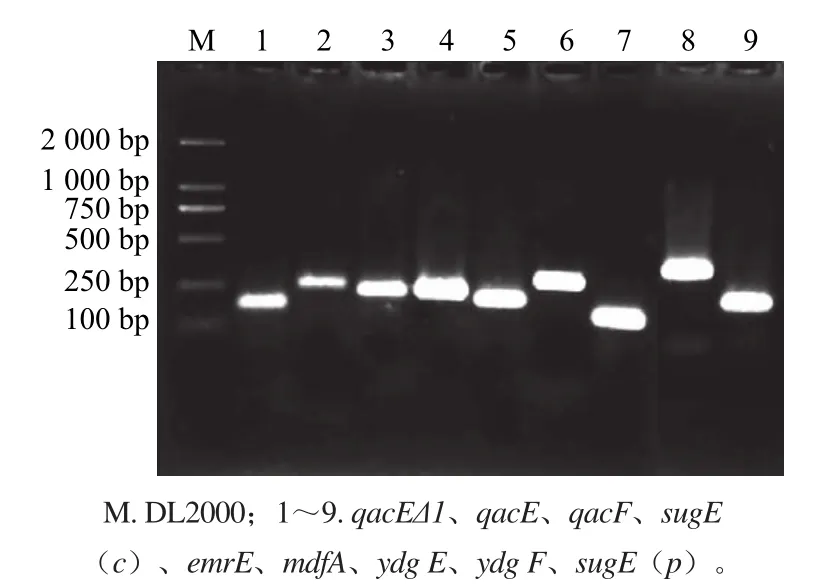
圖1 季銨鹽類耐藥基因電泳圖Fig.1 Electrophoresis of PCR amplified products of QACs resistance genes
96株大腸桿菌共檢出42種消毒劑耐藥基因組合,各組合所占比例為:1.04%~12.50%,檢出率較高的4種組合為 mdfA/ydgE/F(12.50%)、ydgE/F(7.29%)、emrE /ydgE/F(6.25%)、sugE(c)/ydgE/F(6.25%)。其中qacE、emrE/mdfA、mdfA/ydgE/F、qacE/qacEΔ1/sugE(c)、qacE/sugE(p)/ydgE/F、mdfA/qacE/sugE(p)/ ydgE/F、emrE/mdfA/qacE/sugE(c)/sugE(p)/ydgE/F對應的大腸桿菌的MIC較高。
2.3.3 大腸桿菌消毒劑耐藥表型與基因型關系
CTAB的MIC值為256 μg/mL的6株大腸桿菌中,其中5株檢出qacE,3株檢出sugE(p)。Welch等[23]的研究表明qac、sugE(p)基因共存于多重耐藥質粒InA/C、pSN上,可介導高水平消毒劑耐藥,最耐CTAB的6株大腸桿菌中,qacE及sugE(p)較高,可能是由于菌株含有耐藥質粒。
2.4 大腸桿菌消毒劑耐藥與抗生素耐藥的關系
2.4.1 大腸桿菌抗生素與消毒劑耐藥表型
在MIC值較高的37株大腸桿菌(3種消毒劑MIC值大于標準菌株)中,TET耐藥的有30株,耐藥率達到81.08%(P<0.01)。Sidhu等[20]的實驗結果表明BC與抗生素不存在共同耐藥。Buffet-Bataillon等[21]的實驗結果表明DDAC與阿莫西林及磺胺甲基異惡唑相關。本次實驗結果表明季銨鹽類消毒劑和四環素共同介導對大腸桿菌的耐藥。
2.4.2 大腸桿菌抗生素耐藥與消毒劑基因型

圖2 氨基糖苷類耐藥與消毒劑耐藥基因的關系Fig.2 Percentage of QAC resistance genes in aminoglycoside resistant and susceptible E. coli isolates
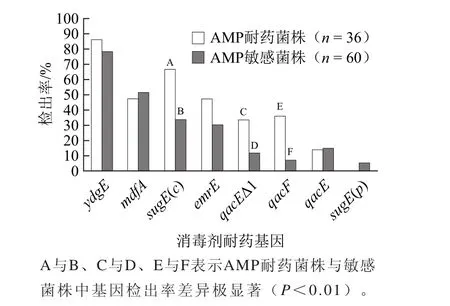
圖3 AMP與消毒劑耐藥基因的關系Fig.3 Percentage of QAC resistance genes in AMP resistant and susceptible E. coli isolates
在革蘭氏陰性細菌中,qac基因常與抗生素耐藥基因一起存在于質粒介導的I型整合子上,因此qac基因和抗生素耐藥基因可同時表達,可編碼對消毒劑和抗生素的共同抗性[24-25]。通過消毒劑和抗生素耐藥基因介導,可以共篩選同時對消毒劑和抗生素耐藥的細菌并共同傳播[26]。如圖2所示,36株氨基糖苷類耐藥菌中sugE(c)、qacF分別檢出24、12株,與氨基糖苷類敏感菌差異顯著(P<0.01),氨基糖苷類耐藥菌與sugE(c)、qacF相關;如圖3所示,36株AMP耐藥菌中sugE(c),qacF,qacEΔ1分別檢出25、13、12株,與AMP敏感菌差異顯著(P<0.01),因此AMP耐藥與sugE(c)、qacF、qacEΔ1相關。
3 結 論
采集四川省市場鮮肉和超市冷鮮肉130份,共分離大腸桿菌96株,大腸桿菌污染率較高為73.85%,大腸桿菌對各種抗生素的耐藥率為0~64.58%,對TET、AMP耐藥率最高,分別為64.58%、37.5%。共產生28種譜型,以TET譜型最多,為21.88%(21/96)。大腸桿菌消毒劑MIC較高,分別為CTAB 64~256 μg/mL;BC 16~64 μg/mL;DDAC 8~32 μg/mL。消毒劑耐藥基因僅qacG-未檢出,檢出率最高的分別為ydgE/F(81.25%)、mdfA(50%)、sugE(45.83%)。共檢出42種消毒劑耐藥基因組合(1.04%~12.50%),其中emrE/mdfA/qacE、mdfA/ydgE/F、qacE/qacEΔ1/sugE(c)、qacE/sugE(p)/ ydgE/F、mdfA/qacE/sugE(p)/ydgE/F、emrE/mdfA/qacE/ sugE(c)/sugE(p)/ydgE/F等6種組合對應的大腸桿菌的MIC較高; sugE(c)、qacF基因與氨基糖苷類耐藥相關,sugE(c)、qacF、qacEΔ1基因與AMP耐藥相關。四川省肉源大腸桿菌污染情況較嚴重,菌株對抗生素的耐藥率及多重耐藥相對較低,對季銨鹽類消毒劑MIC較高,消毒劑耐藥基因檢出率較高,應引起足夠重視,加強對其檢測。
[1] NYACHUBA D G. Foodborne illness: is it on the rise?[J]. Nutrition Reviews, 2010, 68(5): 257-269.
[2] 毛雪丹, 胡俊峰, 劉秀梅. 2003—2007年中國1060起細菌性食源性疾病流行病學特征分析[J]. 中國食品衛生雜志, 2010, 22(3): 224-228.
[3] 龐璐, 張哲, 徐進. 2006—2010年我國食源性疾病暴發簡介[J]. 中國食品衛生雜志, 2011, 23(6): 560-563.
[4] 唐國策. 中國肉類食品安全報告[J]. 中國牧業通訊, 2005(16): 13-17. [5] 孫艷, 湯雪梅, 叢柏林, 等. 沈陽市零售肉類大腸埃希菌與沙門菌污染調查[J]. 中國公共衛生, 2005(10): 1233-1234.
[6] 席美麗. 食源性革蘭氏陰性腸道病原菌PFGE分型和大腸桿菌耐藥性研究[D]. 楊凌: 西北農林科技大學, 2009.
[7] K?RKK?INEN U, IK?HEIMO R, KATILA M L, et al. Pfi mbriation of Escherichia coli strains from patients with urosepsis demonstrated by a commercial agglutination test (PF TEST)[J]. Journal of Clinical Microbiology, 1991, 29(1): 221-224.
[8] 宋立, 寧宜寶, 沈建忠, 等. 中國不同年代食品動物大腸桿菌耐藥性調查研究[J]. 中國科學C輯: 生命科學, 2009, 397: 692-698.
[9] HENRIQUES I S, FONSECA F, ALVES A, et al. Occurrence and diversity of integrons and beta-lactamase genes among ampicillinresistant isolates from estuarine waters[J]. Research in Microbiology, 2006, 157(10): 938-947.
[10] CHAPLIN C E. Bacterial resistance to quaternary ammonium disinfectants[J]. Journal of Bacteriology, 1952, 63(4): 453-458.
[11] PASTRANA-CARRASCO J, GARZA-RAMOS J, BARRIOS H, et al. qacEΔ1 gene frequency and biocide resistance in exten ded-spectrum beta-lactamase producing enterobacteriaceae clinical isolates[J]. Revista de Investigaci on Clinica, 2012, 64(6): 535-540.
[12] 張本, 劉衡川, 張朝武, 等. 四川省大腸桿菌O157:H7分子流行病學、耐藥性及對消毒劑抗性研究[J]. 衛生研究, 2005(5): 606-610.
[13] SOUM ET C, FOURREAU E, LEGRANDOIS P, et al. Resistance to phenicol compounds following adaptation to quate rnary ammonium compounds in Escherichia coli[J]. Veterinary Microbio logy, 2012, 158(1/2): 147-152.
[14] Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing: 19th informational supplement M100-S19[S]. Wayne, PA: Clin ical and Laboratory Standards Institute, 2009.
[15] JORGENSEN J H, CRAWFORD S A, FIEBELKORN K R. Susceptibility of Neisseria meningitidis to 16 antimicrobial agents and characterization of resistance mechanisms affecting some agents[J]. Jou rnal of Clinical Microbiology, 2005, 43(7): 3162-3171.
[16] 只帥, 席美麗, 劉攻關, 等. 陜西部分地區不同食源性大腸桿菌耐藥性檢測[J]. 中國食品學報, 2011, 11(1): 196-201.
[17] 史秋梅, 張艷英, 高桂生, 等. 河北省部分地區肉、蛋食品大腸桿菌污染狀況的檢測[J]. 河北科技師范學院學報, 2012(4): 7-11.
[18] 何嘉儀, 盧沛炯, 賴紅青. 肉類大腸桿菌耐藥性調查[J]. 中國畜牧獸醫, 2009(3): 201-202.
[19] 鄒立扣, 蒲妍君, 楊莉, 等. 四川省豬肉源大腸桿菌和沙門氏菌的分離與耐藥性分析[J]. 食品科學, 2012, 33(13): 202-206.
[20] SIDHU M S, S?RUM H, HOLCK A. Resistance to quaternary ammonium compounds in food-related bacteria[J]. Microbial D rug Resistance, 2002, 8(4): 393-399.
[21] BUFFET-BATAILLON S, BRANGER B, CORMIER M, et al. Effect of higher minimum inhibitory concentrations of quaternary ammonium compounds in clinical E. coli isolates on antibiotic susceptibilities and clinical outcomes[J]. Journal of Hospital Infection, 2011, 79(2): 141-146.
[22] WANG C, ZHAN Q, MI Z, et al. Distribution of the ant iseptic-resistance gene qacEΔ1 in 283 clinical isolates of Gram-negative bacteria in China[J]. Journal of Hospital Infection, 2008, 69(4): 394-396.
[23] WELCH T J, FRICKE W F, McDERMOTT P F, et al. Multiple an timicrobial resistance in plague: an emerging public health risk[J]. Public Library of Science One, 2007, 2(3): e309.
[24] ZHAO Weihua, CHEN Gelin, ITO R, et al. Identifi cation of a plasmidborne blaIMP-11 gene in clinical isolates of Escherichia coli and Klebsiella pneumoniae[J]. Journal of Medical Microbiology, 2012, 61(2): 246-251.
[25] CARSON R T, LARSON E, LEVY S B, et al. Use of antibacterial consumer products containing quaternary ammonium compounds and drug resis tance in the community[J]. Journal of Antimicrobial Chemotherapy, 2008, 62(5): 1160-1162.
[26] WELCH T J, EVENHUIS J, WHITE D G, et al. IncA/C plasmid-mediated florfenicol resistance in the catfish pathogen Edwardsiella ictaluri[J]. A ntimicrobial Agents and Chemotherapy, 2009, 53(2): 845-846.
Antibiotic and Disinfectant Resistance of Escherichia coli Isolated from Pork in Sichuan Province
HE Xue-mei1,2, GUO Li-juan1,2, WU Guo-yan1,2, CHENG Lin2, LI Bei2, LUO Yan2, ZOU Li-kou1,2,*, QING Ling-shan3
(1. College of Resources and Environment, Sichuan Agricultural University, Chengdu 611130, China; 2. Laboratory of Microbiology, Dujiangyan Campus of Sichuan Agricultural University, Dujiangyan 611830, China; 3. College of Life Sciences, Hebei United University, Shijiazhuang 050018, China)
Escherichia coli strains were isolated from 130 pork samples collected in Sichuan province using selective medium and confi rmed by VITEK. The susceptibility of the isolated E. coli strains to ten antibiotics was tested according to the standard disk diffusion method of the Clinical and Laboratory Standards Institute (CLSI). The minimum inhibitory concentrations (MICs) of three quaternary ammonium compounds (QACs) against these strains were determined by an agar dilution method. QAC resistance genes were amplifi ed using ten different sets of primers. The results showed that 96 E. coli strains were obtained with frequency of 73.85%. The resistance frequency to tetracycline (TET), ampicillin (AMP), streptomycin (S), kanamycin (K), ceftofur (KF), ciprofloxacin (CIP), gentamicin (CN) ampicillin/sulbactam (SAM), c eftazidime (CAZ) and ceftriaxone (CRO) was 64.58%, 37.50%, 32.29%, 21.88%, 20.83%, 18.75%, 9.38%, 6.25%, 2.08% and 2.08%, respectively. There were 28 different antibiotic resistance profiles Among these, TET profile was the dominant one. The MICs of benzalkonium chloride (BC), didecyldimethylammonium chloride (DDAC) and etrimonium bromide (CTAB) against E. coli were 16-64 μg/mL, 8-32 μg/mL, and 64-256 μg/mL, respectively. ydgE/F(81.25%)was the most prevalent QAC resistance gene in E. coli, followed by mdfA (50%), sugE(c) (45.83%), emrE (36.46%), qacEΔ1 (19.79%), qacF (17.71%), qacE (14.58%) and sugE(p) (3.13%). And qacG-was not detected in any of the isolates. There were 42 different qac resistance gene groups (1.04%-12.50%). Both sugE(c)and qacF gene were commonly present in aminoglycoside and AMP resistantE. coli, and q acEΔ1 gene was also related with AMP resistance. The resistance frequency and multi-drug resistance were lower than those of other reports. The frequency of QAC resistance genes and the MIC of QACs were high, suggesting that the E. coli from pork may be a reservoir of antibacterial resistance.
pork; Escherichia coli; drug resistance; disinfectants
TS251.51
A
1002-6630(2014)07-0132-06
10.7506/spkx1002-6630-201407027
2013-08-25
四川省教育廳重點項目(10ZA055);教育部“長江學者和創新團隊發展計劃”項目(IRT13083);動物疫病防控與食品安全四川省重點實驗室開放課題
何雪梅(1988—),女,碩士研究生,研究方向為微生物分子生物學。E-mail:wyxmyes@126.com
*通信作者:鄒立扣(1979—),男,教授,博士,研究方向為微生物分子生物學、食品安全。E-mail:zoulkcn@hotmail.com

