激活態雪旺細胞對神經干細胞分化作用的研究
張 睿 張 軍 趙承斌
哈爾濱醫科大學附屬第四醫院骨科,黑龍江哈爾濱 150086
周圍神經損傷是骨科常見的疾病之一,雖然周圍神經具有一定的再生能力,但對于較大缺損卻很難自身修復[1]。隨著組織工程學領域研究的深入,神經干細胞 (NSCs) 已被公認為是對神經損傷修復的有效方法,通過NSCs 在神經斷端的不斷分化,使受損的周圍神經重新恢復連接。然而單純形態學得連接不能保證神經的傳導功能,有研究表明,這與NSCs 分化過程中分化為膠質細胞和神經元的比例有關[2],提高神經元的分化比例,降低膠質細胞的表達可有效提高神經的傳導速度,因此許多學者通過不同方法促進神經干細胞向神經元的分化[3-5],均取得了一定進展。 本研究通過激活態雪旺細胞(SCs)刺激NSCs 的分化,觀察其誘導NSCs 分化為神經元的能力。
1 材料與方法
1.1 實驗材料
雌性SD 大鼠[中國農科院哈爾濱獸醫研究所提供,許可證號:SYXK(黑)2006-032];DMEM/F12 細胞培養基(Hyclone 公司,美國);青-鏈雙抗,胰蛋白酶,Ⅱ型膠原酶 (碧云天, 中國); 兔抗鼠單克隆抗體Nestin,FITC 標記的羊抗兔IgG,兔抗鼠堿性成纖維細胞生長因子(bFGF)、表皮細胞生長因子(EGF)單克隆抗體,兔抗鼠MAP-2、GFAP 單克隆抗體(武漢博士德公司);Transwell 培養皿(Corning 公司,美國)。
1.2 實驗方法
1.2.1 神經干細胞的分離培養與鑒定 取出生24 h 內的SD 大鼠,斷髓處死后無菌條件下取出脊髓,顯微鏡下剝離硬脊膜,剪成5 mm3組織塊,加入0.25%胰酶消化10 min,用吸管反復吹打至單細胞懸液,加入5 mL DMEM/F12 培養基終止消化。 1000 r/min 離心5 min,棄上清,加入含20 ng/mL 的EGF 和20 ng/mL的DMEM/F12 培養液,重懸后移入細胞培養瓶,置于37℃含5%CO2的細胞培養箱中培養。 每6~8 天傳代1次,連續傳4 代。 取第4 代神經球,移入含有多聚賴氨酸包被的蓋玻片的6 孔板內,24 h 后取出蓋玻片,4%多聚甲醛固定,加入兔抗鼠Nestin(1∶100)單克隆抗體作為一抗,4℃過夜,加入異硫氰酸熒光素(FITC)標記的羊抗兔二抗,孵育30 min,進行觀察。
1.2.2 雪旺細胞的分離培養 取體重(100±5)g 的SD大鼠,10%水合氯醛3 mL/kg 腹腔麻醉后,以右側臀大肌為中心消毒, 鋪無菌孔巾, 縱行做一長約1.5 cm 切口,分離暴露坐骨神經,于近端結扎,逐層縫合。 1 周后,處死大鼠,分離雙側坐骨神經,右側坐骨神經由于結扎變性,SCs 受刺激而發生激活, 稱激活態SCs;左側為正常坐骨神經,提取的SCs 稱為普通SCs。 雙側坐骨神經均剪成5 mm 小段, 加入0.1%胰蛋白酶和0.25%的Ⅱ型膠原酶消化1 h, 反復吹打至單細胞懸液,加入5 mL DMEM/F12 培養基終止消化。 采用差速貼壁法,使成纖維細胞貼壁,未貼壁細胞移入含20 ng/mL EGF 和20 ng/mL 的DMEM/F12 培 養液中行原代培養。
1.2.3 細胞的分組與聯合培養 將細胞隨機分為3 組,A 組為激活態SCs 與NSCs 聯合培養,B 組為普通SCs 與NSCs 聯合培養,C 組NSCs 單獨培養, 作為對照。 細胞的聯合培養采用0.2 μm 的6 孔Transwell 培養皿,上室為SCs,下室為NSCs。 培養基采用不含任何營養因子的DMEM/F12 培養基。于培養的第2、4、6天分別對下室細胞行MTT 染色,檢測細胞活性。
1.2.4 Western blot 檢測激活態雪旺細胞營養因子的表達水平 聯合培養1 周后, 取A、B 兩組上室細胞,提取總蛋白,進行電泳、轉膜、封閉,分別加入兔抗鼠EGF(1∶100)、bFGF(1∶200)單克隆抗體,4℃過夜,加入AP 顯色液顯色。 用Image-ProPlus 專業圖像分析系統測定平均光密度值,并進行統計學分析。
1.2.5 神經干細胞分化的免疫熒光檢測 聯合培養1周后,將多聚賴氨酸包被的蓋玻片放入下室,24 h 后取出蓋玻片,4%多聚甲醛固定, 分別加入兔抗鼠MAP-2(1∶200)、GFAP(1∶200)單克隆抗體作為一抗,4℃過夜,加入FITC 標記的羊抗兔IgG 二抗(1∶200),室溫孵育30 min。 在100 倍熒光顯微鏡下隨機選取6 個不同視野, 計數抗原陽性細胞數與全部細胞數,計算陽性細胞數在全部細胞中的比值,公式為:陽性細胞比值=陽性細胞數/細胞總數×100%。
1.3 統計學方法
采用統計軟件SPSS 18.0 對數據進行分析, 正態分布計量資料以均數±標準差(±s)表示,多組間比較采用方差分析, 兩兩比較采用LSD-t 檢驗。 以P <0.05 為差異有統計學意義。
2 結果
2.1 神經干細胞的分離培養與鑒定
NSCs 在培養瓶內懸浮生長,呈圓形,核較大,折光性強。于培養第5 天開始聚集成團,呈球樣生長,第7 天左右可見部分神經球出現貼壁, 并發出短小突起。傳4 代后,NSCs 形態穩定,未見異型性改變。熒光染色可見聚集成球的NSCs 發出綠色熒光,可見因貼壁而發出的短促突起。
2.2 激活態雪旺細胞的分離培養
結扎SD 大鼠右側坐骨神經后,大鼠出現右下肢跛行,1 周后有足部有潰瘍形成。 分離雙側坐骨神經,可見結扎遠端坐骨神經明顯較對側增粗。細胞經差速貼壁以后可見胞體較大的成纖維細胞得以去除,去除后細胞呈梭形,3 d 后,胞體增長,發出突起,至7 d 細胞大量增殖呈旋渦狀排列,激活態SCs 生長速度較普通SCs 的生長速度快。
2.3 各組神經干細胞的分化狀態
A 組NSCs 在培養5 d 后即開始發出較長突起,出現貼壁細胞,細胞形態增長,細胞間借突起形成網狀連接。 B 組細胞在8 d 后開始出現分化,但細胞發出的突起較A 組短小。 C 組細胞仍呈球形生長,少見貼壁細胞。 應用MTT 法檢測三組細胞的平均光密度值,可見第2、4 天三組細胞的活性差異無統計學意義(P > 0.05),第6 天C 組活細胞比例開始降低,A、B 組與C 組比較差異有統計學意義 (P < 0.05),A 組與B組比較差異無統計學意義(P > 0.05)。 見圖1。

圖1 MTT 法對神經干細胞活性的檢測
2.4 激活態雪旺細胞營養因子的表達水平
A、B 兩組上室細胞提取的蛋白經電泳后,條帶清晰,兩組相同蛋白密度有差異,管家基因GAPDH 作為內參,電泳條帶亮度一致。應用Image-ProPlus 專業圖像分析系統測定平均光密度值,根據公式:相對量=產物電泳條帶密度/GAPDH×100%,計算各組蛋白量,可見A 組細胞EGF、bFGF 的表達水平均高于B 組,差異有統計學意義(P < 0.05)。 見表1。
表1 雪旺細胞營養因子表達的平均光密度值(±s)
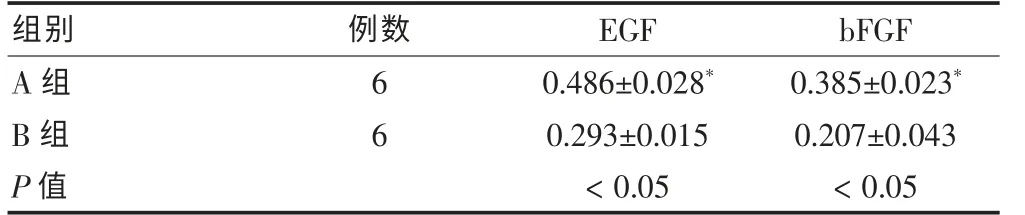
表1 雪旺細胞營養因子表達的平均光密度值(±s)
注:EGF:表皮生長因子,bFGF:堿性成纖維細胞生長因子
?
2.5 神經干細胞分化的免疫熒光檢測
對三組細胞分別進行MAP-2 和GFAP 染色,計算每高倍視野陽性細胞的比例。A 組細胞MAP-2 染色陽性率明顯高于B、C 組,差異有統計學意義(P<0.05);B 組MAP-2 染色陽性率明顯高于C 組, 差異有統計學意義(P < 0.05)。A 組GFAP 陽性率明顯低于B 組,差異有統計學意義(P < 0.05);C 組GFAP 陽性率明顯低于A、B 組,差異有統計學意義(P < 0.05)。 見表2。
表2 免疫熒光染色陽性細胞在分化細胞中的比例(%,±s)
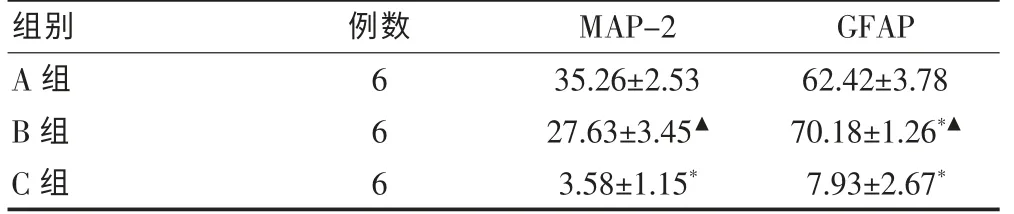
表2 免疫熒光染色陽性細胞在分化細胞中的比例(%,±s)
注:與A 組比較,*P <0.05;與C 組比較,▲P <0.05
?
3 討論
各種外傷或病變所致的周圍神經損傷一直以來都是顯微外科研究的重點內容。雖然周圍神經具有自我修復能力, 但是如果缺損大于10 mm 以上則很難使近端神經纖維長入[6],從而造成永久性的功能喪失。為此有學者研制出干細胞結合導管支架的技術[7-10],使得周圍神經的斷端得以重連,然而單純的形態學重建卻難以恢復神經的傳導速度。 有研究指出NSCs 在體內主要分化為膠質細胞,而膠質細胞則會影響神經元的傳導速度[11-12],因此NSCs 如何高效分化出神經元就成為研究關鍵。
周圍神經損傷后, 損傷遠端軸突發生華勒變性,繼而壞死溶解,周圍的SCs 此時會發生增殖,一方面吞噬溶解的軸突,另一方面分泌大量神經營養因子促進近端軸突的長入[13-14]。 本研究利用雪旺細胞這一特點,于體外建立SCs,使其持續分泌多種神經營養因子,誘導NSCs 的分化。有研究指出,NSCs 的生長分化需要多種營養因子的協同作用[15-16],盡管某一因子的濃度較低,但卻是不可或缺的。 體外添加營養因子則難以滿足干細胞分化的要求[17-18]。 本研究運用細胞聯合培養的方式,通過細胞間的旁分泌作用,克服這一不足。 同時,應用Transwell 培養皿,借助聚碳酸酯膜的作用使細胞間不發生接觸,排除了細胞間的相互干擾。
本研究的結果可以看出,與普通SCs 相比,激活態SCs 對NSCs 的誘導作用存在時間短、神經元分化率高等優點。 但是從MTT 染色可以看出,由于各組只應用單純DMEM/F12 培養基培養,活細胞比例隨時間呈下降趨勢,說明單純在體外依靠雪旺細胞分泌的營養因子難以滿足NSCs 的生長需求,從而解釋了體內移植神經干細胞死亡率高的原因[19-20]。 這就需要進一步探索能夠保持體內高濃度營養因子的方法,從而維持NSCs 的體內生長狀態。
由于條件限制, 本實驗尚存在一些不足之處,對SCs 分泌的因子只進行了較為重要的EGF 和bFGF的檢測, 如果能檢測出全部營養因子的表達水平,將有助于進一步的詳細分析。
綜述所述,激活態雪旺細胞能夠促進神經干細胞向神經元的分化進程,提高神經元的分化比例。
[1] Cheng LN,Duan XH,Zhong XM,et al. Transplanted neural stem cells promote nerve regeneration in acute peripheral nerve traction injury:assessment using MRI [J]. AJR Am J Roentgenol,2011,196(6):1381-1387.
[2] Chang DJ,Oh SH,Lee N,et al. Contralaterally transplanted human embryonic stem cell-derived neural precursor cells (ENStem-A)migrate and improve brain functions in stroke-damaged rats [J]. Exp Mol Med,2013,45:53.
[3] Akama K,Horikoshi T,Nakayama T,et al. Proteomic identification of differentially expressed genes during differentiation of cynomolgus monkey(Macaca fascicularis)embryonic stem cells to astrocyte progenitor cells in vitro [J].Biochim Biophys Acta,2013,1834(2):601-610.
[4] Stringari C,Nourse JL,Flanagan LA,et al. Phasor fluorescence lifetime microscopy of free and protein -bound NADH reveals neural stem cell differentiation potential[J]. PLoS One,2012,7(11):48014.
[5] Jha RM,Liu X,Chrenek R,et al.The postnatal human filum terminale is a source of autologous multipotent neurospheres capable of generating motor neurons[J].Neurosurgery,2013,72(1):118-129.
[6] 李高山.骨髓基質干細胞與施萬細胞聯合移植對周圍神經缺損的修復作用[J].中國醫藥導報,2013,10(21):90-93.
[7] Emborg ME,Liu Y,Xi J,et al. Induced pluripotent stem cell-derived neural cells survive and mature in the nonhuman primate brain [J]. Cell Rep,2013,3(3):646-650.
[8] Heermann S,Motlik K,Hinz U,et al. Glia cell line-derived neurotrophic factor mediates survival of murine sympathetic precursors [J]. J Neurosci Res,2013,91(6):780-785.
[9] He BL,Ba YC,Wang XY,et al.BDNF expression with functional improvement in transected spinal cord treated with neural stem cells in adult rats [J]. Neuropeptides,2013,47(1):1-7.
[10] Ishii M,Arias AC,Liu L,et al.A stable cranial neural crest cell line from mouse [J]. Stem Cells Dev,2012,21(17):3069-3080.
[11] Ortega F,Gascon S,Masserdotti G,et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling [J]. Nat Cell Biol,2013,15(6):602-613.
[12] Bonner JF,Haas CJ,Fischer I. Preparation of neural stem cells and progenitors:neuronal production and grafting applications [J]. Methods Mol Biol,2013,1078:65-88.
[13] Lamond R,Barnett SC. Schwann cells but not olfactory ensheathing cells inhibit CNS myelination via the secretion of connective tissue growth factor [J]. J Neurosci,2013,33(47):18686-18697.
[14] Faulkner SD,Ruff CA,Fehlings MG.The potential for stem cells in cerebral palsy-piecing together the puzzle [J].Semin Pediatr Neurol,2013,20(2):146-153.
[15] Nitzan E,Pfaltzgraff ER,Labosky PA,et al. Neural crest and Schwann cell progenitor-derived melanocytes are two spatially segregated populations similarly regulated by Foxd3 [J]. Proc Natl Acad Sci USA,2013,110(31):12709-12714.
[16] Ren YJ,Zhang S,Mi R,et al. Enhanced differentiation of human neural crest stem cells towards the Schwann cell lineage by aligned electrospun fiber matrix [J]. Acta Biomater,2013,9(8):7727-7736.
[17] Guo X,Spradling S,Stancescu M,et al. Derivation of sensory neurons and neural crest stem cells from human neural progenitor hNP1 [J]. Biomaterials,2013,34(18):4418-4427.
[18] Xia L,Wan H,Hao SY,et al. Co-transplantation of neural stem cells and Schwann cells within poly (L-lacticco-glycolic acid) scaffolds facilitates axonal regeneration in hemisected rat spinal cord [J]. Chin Med J(Engl),2013,126(5):909-917.
[19] Armati PJ,Mathey EK. An update on Schwann cell biology-immunomodulation, neural regulation and other surprises [J]. J Neurol Sci,2013,333(1-2):68-72.
[20] Guo Z,Wang X,Xiao J,et al. Early postnatal GFAP-expressing cells produce multilineage progeny in cerebrum and astrocytes in cerebellum of adult mice [J]. Brain Res,2013,1532:14-20.

