IPTG與乳糖聯合誘導重組大腸桿菌右旋糖酐蔗糖酶表達
李攀峰,張洪斌,胡雪芹
(合肥工業大學醫學工程學院制藥工程系,安徽 合肥 230009)
IPTG與乳糖聯合誘導重組大腸桿菌右旋糖酐蔗糖酶表達
李攀峰,張洪斌*,胡雪芹
(合肥工業大學醫學工程學院制藥工程系,安徽 合肥 230009)
研究異丙基硫代-β-D-呋喃半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG)與乳糖聯合誘導重組大腸桿菌右旋糖酐蔗糖酶表達的效果。在利用IPTG和乳糖分別作為誘導劑對右旋糖酐蔗糖酶工程菌Escherichia coli BL21(DE3)/pET28-dexYG進行誘導表達的基礎上,嘗試將此兩種誘導劑聯合使用,在降低成本的同時獲得較好的表達效果。在獲得最佳培養基的基礎上,考察菌體IPTG與乳糖的聯合加入量、菌體濃度、誘導時間對右旋糖酐蔗糖酶表達的影響。在菌濃(OD600nm)達到3.0時,加入0.1 mmol/L IPTG 95 μL+2.5 g/L乳糖,25℃混合誘導培養4 h,酶活力最高,達到40.44 U/mL。IPTG與乳糖聯合誘導重組大腸桿菌右旋糖酐蔗糖酶表達可行。
異丙基-β-D-硫代吡喃半乳糖苷;乳糖;右旋糖酐蔗糖酶;表達;聯合誘導
右旋糖酐蔗糖酶(dextransucrase,DSR,EC2.4.1.5)屬于糖苷水解酶第70家族,是一種葡聚糖蔗糖酶(又稱葡萄糖基轉移酶,glucosyhransferase,簡稱GTF),是葡聚糖蔗糖酶領域中研究較早較熱門的一類酶[1-2]。該酶的催化是以蔗糖為底物,切斷D-葡萄糖基與果糖基的糖苷鍵,并形成D-葡萄糖基與酶的復合物,釋放出果糖,然后將葡萄糖基單元以α-1,6或其他糖苷鍵的形式連接起來,生成兩類重要產品:右旋糖酐和果糖[3]。
果糖在食品行業中有著廣泛的應用。果糖具有優越的代謝性能,其代謝過程不依賴胰島素[4],不會引起血糖、胰島素、胰高血糖素的較大變化[5],因此常被作為糖尿病人的甜味食品[6]。果糖代謝不會產生乳酸,能對體內消耗蛋白質有抑制作用,能夠迅速提高并且補充人體所需的能量,使得人體耐力以及代謝得到強化,因此常被制作為功能性飲料,為運動員及體力勞動者快速恢復體力[7];果糖因其爽口,風味好、溫和無異味、透明度好被大量用于軟飲料產品,如可樂型飲料、汽水、果汁飲料、果露等。果糖入口后不殘留,有水果的優質甜味,也能增強果香,在發酵型烘焙食品中果糖的發酵性、焦化性及保濕性可以作為優點發揮出來。并在產品的銷售過程中有效地防止產品發干、變硬,發霉等[8]。關鍵酶右旋糖酐蔗糖酶的研究也越來越受到研究人員的重視。Tsuchiya等[9]報道右旋糖酐蔗糖酶搖瓶培養較靜止培養時酶活力高。Alsop[10]報道在空氣攪動的情況下右旋糖酐蔗糖酶的酶活力也高于無氧或純氧的條件。Veljkovic等[11]研究證明當生物反應器中氣體流量與菌體最大耗氧量一致時酶活力最高。Lazic等[12]發現L. mesenteroids ZDRAVLJE SR-P在pH5.5,攪拌速率200 r/min;進氣流速0.05 vvm時,酶活力最高34 DSU/mL。變旋糖酐蔗糖酶受3-脫氧-3-氟-α-D-呋喃葡萄糖、2-氨基乙醇的抑制[13]。
基因工程技術的發展使右旋糖酐蔗糖酶工程菌的構建和表達研究的發展加快。Wilke-Douglase等[14]首次從L. mesenteroids NRRL B2512F克隆得到右旋糖酐蔗糖酶基因darS,通過巨大芽孢桿菌表達所獲得的右旋糖酐蔗糖酶酶活力為0.065 U/mL,經過高密度培養后酶活力高達28.6 U/mL[15]。2006年國外有報道通過克隆darS在大腸桿菌中表達,采用0.2mmol/L 異丙基硫代-β-D-呋喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)作為誘導劑,獲得的右旋糖酐蔗糖酶活力達到5.85 U/mL[16]。不過IPTG價格昂貴,使用量過多時有毒性,并且提高了工業生產成本。因此研發1種降低IPTG使用量的誘導方法具有重要意義。
本實驗室通過分子生物學技術成功構建右旋糖酐蔗糖酶工程菌株E. coli BL21(DE3)/pET28-dexYG,并分別利用IPTG和乳糖作為誘導劑對其進行誘導表達,并利用兩種誘導劑進行聯合誘導研究,在降低成本的同時獲得較好的表達效果,為該酶的工業化生產提供參考。
1 材料與方法
1.1 材料與試劑
基因工程菌Escherichia coli BL21(DE3)/pET28-dexYG由本實驗室構建、保存。
卡納霉素 上海捷瑞生物工程有限公司;IPTG德國默克公司;其他常用試劑均為分析純。
1.2 培養基
LB液體培養基(g/L):胰蛋白胨10、酵母提取物5、氯化鈉10,pH 7.0。
發酵培養基:蛋白胨10 g/L、硝酸鉀10 g/L、MgSO4(1mol/L)100μL/L、甘油(500g/L)10mL/L、M9鹽90 mL/L,p H 7.0。其中M 9鹽配方:磷酸氫二鈉17.105 g/200 mL、磷酸二氫鉀3g/100mL、氯化銨1g/100mL。
1.3 儀器與設備
SL202N電子天平 上海民橋精密科學儀器有限公司;WH-861旋渦混合器 太倉市科教儀器廠;W-1調節萬用電爐 通州市滬通實驗儀器廠;TG16-WS臺式高速離心機 長沙湘儀離心機有限公司;GL-20G-II高速冷凍離心機 上海安亭科學儀器廠;PHS-3CT酸度計上海大中分析儀器廠;CHA-SA氣浴恒溫搖床 江蘇金壇國勝實驗儀器廠;LS-B50L立式圓形壓力蒸汽滅菌器 張家港市化菱醫療設備有限公司;KS-150超聲波細胞粉碎機 寧波科生儀器廠;VIS-723紫外分光光度計 上海精密科學儀器有限公司;MDF-U332醫用低溫冰箱(-50℃) 日本三洋公司;HH-2恒溫水浴鍋江蘇金壇晶玻實驗儀器廠;微量移液器 上海大龍醫療設備有限公司。
1.4 方法
1.4.1 右旋糖酐蔗糖酶的表達培養
將基因工程菌BL21(DE3)/pET28-dexYG于37℃、含50mg/mL卡那霉素的LB培養基中進行過夜富集培養[17-18]。將過夜富集培養后的菌液按照1%的接種量接種到100 mL含卡那霉素50 μg/mL的培養基中進行發酵,37℃、250 r/min培養直到菌濃(OD600nm)達到1.8時,加入IPTG至終濃度0.5 mmol/L,25℃、250 r/min誘導4 h來使得右旋糖酐酶表達,離心取菌體。
1.4.2 右旋糖酐蔗糖酶的酶活力測定
方法參照文獻[19]。酶活力單位(U)定義:在25℃條件下,1 mL底物反應液中1h催化蔗糖產生0.1 mg果糖所需要的酶量。
1.4.3 IPTG和乳糖聯合誘導
將實驗分成A、B、C、D組,4組均為發酵培養基,其中,A、B兩組為IPTG與乳糖聯合誘導,C組IPTG單獨誘導D組乳糖單獨誘導A和C組到OD600nm=2.0時開始進行誘導,B和D兩組到OD600nm=3.0開始誘導。A、B兩組均為125 μL 0.1 mmol/L IPTG+2.5 g/L乳糖混合誘導,C組為250 μL 0.1 mmol/L的IPTG單獨誘導,D組為2.5 g/L乳糖單獨誘導;A、B兩組在誘導3、4、5、6、7 h時分別取樣15 mL測酶活力,C組誘導4 h后測定酶活力,D組誘導6 h后測酶活力。
1.4.4 IPTG和乳糖聯合誘導條件優化
1.4.4.1 乳糖添加量對誘導過程的影響
將實驗分成A、B、C、D、E、F共6組,分別按照發酵培養基成分進行配制。A、C、E組在O D600nm=2.0時開始進行誘導,B、D、F組在OD600nm=3.0開始誘導。其中A、B兩組加入60 μL 0.1 mmol/L IPTG+1.25 g/L乳糖混合誘導,C、D兩組加入60 μL 0.1 mmol/L IPTG+2.5 g/L乳糖混合誘導,E、F兩組加入60 μL 0.1 mmol/L IPTG+5.0 g/L乳糖混合誘導。A、C、E 3組在菌濃OD600nm=2.0時開始誘導,B、D、F 3組在菌濃OD600nm=3.0時開始誘導。4組均在誘導3、4、5、6、7 h時分別取樣15 mL測定酶活力。
1.4.4.2 IPTG含量對誘導過程的影響
實驗過程同1.4.4.1節,將A、C組在OD600nm=2.0時開始進行誘導,B、D組在OD600nm=3.0開始誘導,A、B兩組為加入78 μL 0.1 mmol/L IPTG+2.5 g/L乳糖混合誘導,C、D兩組為加入95 μL 0.1 mmol/L IPTG+2.5 g/L乳糖混合誘導4 h。
2 結果與分析
2.1 IPTG和乳糖聯合誘導

表1 IPTG和乳糖聯合誘導所得右旋糖酐蔗糖酶酶活力Table 1 Activity of dextransucrase induced by the presence of both IPTG and lactose
由表1可知,比較C、D兩組實驗可以看出,當乳糖單獨作為誘導物的時候,所誘導產生的重組右旋糖酐蔗糖酶酶表達活力較低,乳糖不適合作為獨立誘導物來誘導產酶。比較A、B、C、D 4組實驗數據可以看出,IPTG與乳糖混合使用作為誘導物能產生較好的效果。比較A、B兩組看出,不同的菌濃對酶活力表達并沒有特別的影響,但是不能保證在IPTG用量繼續較少的情況下,菌濃對其依然沒有特別影響,所以在以后的實驗中,菌濃需要繼續同時考察OD600nm=2.0以及OD600nm=3.0兩種情況。由于最終目的是節約成本,即降低IPTG用量,在此實驗基礎之上,繼續考察降低IPTG的用量,并同時考察乳糖用量增減對此過程的影響。
2.2 IPTG和乳糖聯合誘導條件優化
2.2.1 乳糖添加量對誘導過程的影響
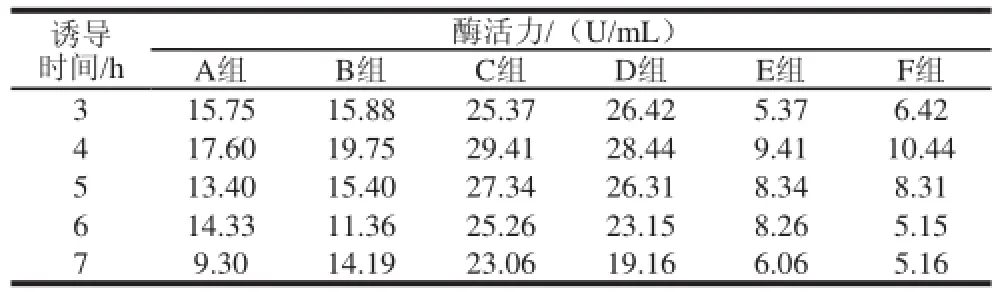
表2 IPTG和乳糖聯合誘導所得右旋糖酐蔗糖酶酶活力Table 2 Activity of dextransucrase induced by the presence of both Table 2 Activity of dextransucrase induced by the presence of both IPTG and lactose ose
由表2可知,在降低IPTG濃度后,所誘導得到的酶活力很低。主要原因為當IPTG用量過低的時候,不能有效的抑制菌體的生長,無法進行持續的誘導而使得合成的可溶性蛋白減少;當提高加入乳糖的量時,酶活力相對并沒有提高;分別比較上述6組可以看出,當IPTG過低時,菌濃對酶活力沒有特別的影響;分別比較A、C、E 3組與B、D、F 3組可以看出,乳糖質量濃度提高并不能使得酶活力提高,反而會抑制酶活力,所以在二者混合誘導時,乳糖的量不能過多,本實驗結果顯示選擇乳糖質量濃度為2.5 g/L;將0.1 mmol/L IPTG用量定在60~125 μL,根據預實驗情況選擇78 μL以及95 μL 2個值來考察。
2.2.2 IPTG用量對誘導過程的影響
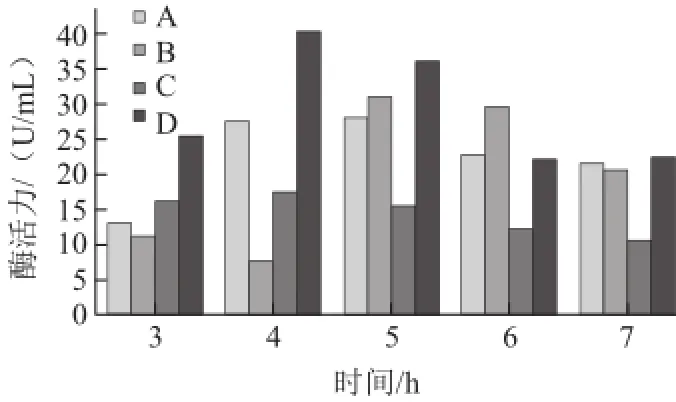
圖1 IPTG用量對右旋糖酐蔗糖酶酶活力的影響Fig.1 Effect of IPTG concentration on dextransucrase activity
由圖1可知,比較A、B兩組數據,當添加78 μL 0.1 mmol/L IPTG時,所得的酶活力相對較低,最適合條件為OD600nm=3.0條件下誘導5 h,所得的酶活力為31.10 U/mL,酶活力不是很理想;比較C、D兩組數據,當添加95 μL 0.1 mmol/L IPTG時,所得的酶活力最高為在OD600nm=3.0時IPTG和乳糖聯合誘導4 h后右旋糖酐蔗糖酶酶活力達到40.44 U/mL,相對較高。得出最優組合為95 μL 0.1 mmol/L IPTG+2.5 g/L乳糖。
3 結 論
當乳糖單獨使用被用來作為誘導物的時候,其誘導產生的右旋糖酐蔗糖酶活力很低,不能用來作為誘導劑;而使用IPTG作為誘導物的時候,能夠得到比較理想的效果。但是IPTG是有毒物質,所以在不得不使用IPTG作為誘導物的情況下,需要盡量減少IPTG的用量。在OD600nm=3.0、0.1 mmol/L IPTG 95 μL+ 2.5 g/L乳糖情況下,混合誘導4 h,酶活力可以達到40.44 U/mL。與單獨IPTG誘導相比,IPTG用量減少了62%,而酶活力僅減少了8%。同文獻[19-20]比較,IPTG用量減少了5%,而酶活力保持在相當的水平。結果表明IPTG與乳糖混合誘導可行,既可以降低生產的成本,又可以減少IPTG作為有毒物質所帶來的不利影響,為工業應用提供參考。
參考文獻:
[1] ROBYT J F, EKLUND S H. Revative quantitative effects of acceptors in the reaction of Leuconostoc mesenteroides B-512F dextransucrase[J]. Carbonhydrate Research, 1983, 121: 279-286.
[2] ROBYT J F, SEUNG-HEON Y, RUPENDRA M. Dextransucrase and the mechanism for dextran biosynthesis[J]. Carbohydrate Research, 2008, 10: 1-10.
[3] RICHARD G, YU S K. A novel family of glucosyl 1,5-anhydro-D-fructose derivatives synthesised by transglucosylation with dextransucrase from Leuconostoc mesenteroides NRRL B-512F[J]. Carbohydrate Research, 2005, 340: 395-401.
[4] CCRANE R. Intestinal absorption of sugars[J]. Physiology Reviews, 1960, 40: 789.
[5] OLEFSEY J M, CRAPO P. Fructose its characteristics, pH, physiology and metabolism[J]. Food Science, 1978, 43: 251.
[6] 陳潔, 趙郁, 徐玉延, 等. 果糖的研究進展[J]. 華西藥學雜志,2002, 15(2): 111-112.
[7] 苑家駿, 李思忠, 李小娜, 等. 果糖在運動中的應用[J]. 中國運動醫學雜志, 1998, 17(2): 149-150.
[8] ESTER J T, MICHELE V. Production of high-fructose syrup using immobilized invertase in a membrane reactor[J]. Journal of Food Engineering, 2007, 80: 662-667.
[9] TAUCHIYA H M, KOEPSELL H J, CORMAN J, et al. The effect of certain cultural factors on production of dextransucrase by Leuconostoc mesenteroides[J]. Journal of Bacteriology, 1952, 64(4): 521-526.
[10] ALSOP R M. Industrial production of dextrans[J]. Progress in Industrial Microbiology, 1983, 18: 1-44.
[11] VELJKOVIC V B, LAZIC M L, RUTIC D J, et al. Effects of aeration on extracellular dextran production by Leuconostoc mesenteroides[J]. Enzyme and Microbial Technology, 1992, 14(8): 665-668.
[12] LAZIC M L, VELJKOVIC V B, VUCETIC J I. Effect of pH and aeration on dextran production by Leuconostoc mesenteroides[J]. Enzyme and Microbial Technology, 1993, 15(4): 334-338.
[13] G R E G O RY L, C OT E J F. I s o l a t i o n a n d p a r t i a l characterization of an extracelular glucansucrase from Leuconostoc mesenteroides NRRL B-1355 that synthesizes an alternating(16),(13)-α-D-glucan carbonhydrate research[J]. Carbohydrate Research, 1982, 101: 57-74.
[14] WILKE-DOUGLAS M, PERCHOROWICZ J T, HOUCH C M, et al. Methods and compositions for altering physical characteristics of fruit and fruit products: USA, WO89/12386 [P]. 1989-12-28.
[15] MALTEN M, NAHRSTEDT H, MEINHARDT F, et al. Coexpression of the type I signal peptidase gene sipM increases recombinant protein production and export in Bacillus megaterium MS 941[J]. Biotechnology and Bioengineering, 2005, 91(5): 616-621.
[16] MALTEN M, HOLLMANN R, DECKWER W D, et al. Production and secretion of recombinant Leuconostoc mesenteroides dextransucrase DsrS in Bacillus megaterium[J]. Biotechnology and Bioengineering, 2005, 89(2): 206-218.
[17] 張洪斌, 胡雪芹, 冒小青, 等. 重組大腸桿菌右旋糖酐蔗糖酶的表達條件優化[J]. 生物工程學報, 2009, 25(12): 2022-2028.
[18] 張洪斌, 朱春寶, 胡又佳, 等. 右旋糖酐蔗糖酶工程菌株的構建及其培養條件的研究[J]. 微生物學報, 2008, 48(4): 1-6.
[19] ZHANG Hongbin, HU Youjia, ZHU Chunbao, et al. Cloning, sequencing and expression of a dextransucrase gene (dexYG) from Leuconostoc mesenteroides[J]. Biotechnology Letter, 2008, 30: 1441-1446.
[20] 王雅潔, 張洪斌, 胡雪芹, 等. 重組大腸桿菌右旋糖酐蔗糖酶的純化及其性質[J]. 微生物學報, 2008, 48(9): 1266-1269.
Combinatorial Induction of Recombinant Dextransucrase Expression in E. coli by IPTG and Lactose
LI Pan-feng, ZHANG Hong-bin*, HU Xue-qin
(Department of Pharmaceutical Engineering, School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
In order to explore the combinatorial induction of recombinant dextransurase experssion in E. coli by isopropyl β-D-1-thiogalactopyranoside (IPTG) and lactose, a mixture of IPTG and lactose was added to the cell culture to induce the expression of recombinant dextransurase. Based on the optimal culture medium, IPTG concentration and the amount of lactose added, bacteria concentration and induction time revealed significant impacts on the enzyme activity. The results showed that the optimal concentrations of IPTG and lactose were 0.1 mmol/L and 2.5 g/L, respectively, and optimal induction time was 4 h at 25 ℃. Under these culture conditions, the activity of dextransucrase could reach up to 40.44 U/mL. The combinatorial induction of recombinant E. coli dextransurase by IPTG and lactose was feasible, greatly reducing the dosage of IPTG and industrial production costs.
isopropyl-β-D-1-thiogalactopyranoside (IPTG); lactose; dextransucrase; expression; combinatorial induction
Q814
A
1002-6630(2014)01-0185-04
10.7506/spkx1002-6630-201401036
2013-04-06
安徽省長三角科技攻關基金項目(10140702001);安徽省自主創新專項(2013AKKG0391)
李攀峰(1988—),男,碩士研究生,研究方向為酶與制藥工程。E-mail:395427915@qq.com
*通信作者:張洪斌(1970—),男,教授,博士,研究方向為酶與制藥工程。E-mail:zhb5678@163.com

