EDC和NHS對玉米醇溶蛋白成膜性質(zhì)的影響
張 敏,陳 野,劉 君,周淑紅,王君予,李燕丹
(天津科技大學(xué)食品工程與生物技術(shù)學(xué)院,天津 300457)
EDC和NHS對玉米醇溶蛋白成膜性質(zhì)的影響
張 敏,陳 野*,劉 君,周淑紅,王君予,李燕丹
(天津科技大學(xué)食品工程與生物技術(shù)學(xué)院,天津 300457)
為提高玉米醇溶蛋白膜的抗拉強度和伸長率,降低其水蒸氣透過率和吸水率,研究交聯(lián)劑1-乙基-3-(3-二甲基氨丙基)碳二亞胺鹽酸鹽(EDC)和N-羥基琥珀酰亞胺(NHS)對成膜性質(zhì)的影響。結(jié)果表明:以90%乙醇為溶劑,EDC和NHS的添加量分別為0.06 g/g時,制得的膜性能最佳,抗拉強度為83 MPa,較未添加交聯(lián)劑的蛋白膜提高97.6%;伸長率為5.5%,提高57.1%;水蒸氣透過率為2.5×10-8(g·m)/(m2·h·Pa),降低43.2%;吸水率為39.4%,降低24.4%;質(zhì)量損失率為3.6%,增加20.0%;靜態(tài)接觸角為67.4°,表 明膜表面仍為疏水表面。原子力顯微鏡觀測顯示,加入交聯(lián)劑后,蛋白分子聚集體變小,以均一的小球型聚集體形式緊密有序排列。
1-乙基-3-(3-二甲基氨丙基)碳二亞胺鹽酸鹽(EDC);N-羥基琥珀酰亞胺(NHS);玉米醇溶蛋白;成膜性質(zhì)
玉米醇溶蛋白,由于含有大量的非極性氨基酸,缺乏堿性和酸性的氨基酸而具有獨特的溶解性。它不溶于水,但可溶于醇溶液、高濃度的尿素溶液、高濃度的堿(pH≥11)或陰離子活性劑[1],其中乙醇溶液是最常用的溶劑。玉米醇溶蛋白能溶于50%~90%乙醇,但不溶于無水乙醇(甲醇除外)。然而,溫度高于溶劑的沸點時,玉米醇溶蛋白能溶于高濃度的乙醇甚至無水乙醇溶液[2]。且在溶液中,玉米醇溶蛋白有聚集趨向[3]。玉米醇溶蛋白是由平均相對分子質(zhì)量為25 000~45 000的蛋白質(zhì)組成的混合物,分子是棒狀的,以長短軸比為6∶1的不對稱拉長分子結(jié)構(gòu)存在[4-5]。玉米醇溶蛋白是相對疏水性高和熱塑性好的材料,具有極強的成膜性,它是通過蛋白間疏水鍵、氫鍵和有限的二硫鍵形成膜[6-7]。在眾多的可食性薄膜中,唯有玉米醇溶蛋白可在無需添加劑、鞣制劑的條件下制成薄膜,并且具有良好的阻濕性及阻氧性,因而可以用于食品保鮮、包裝以及制藥行業(yè)[8]。但由天然玉米醇溶蛋白所制得的膜機械強度低,柔韌性差,脆而易碎,限制了其工業(yè)化應(yīng)用。
為了改善膜的性質(zhì),目前研究大多集中在酰化改性和磷酸化改性上。尤其是酰化改性研究較多,包括添加增塑劑、酸酐、檸檬酸等[9]。這些方法都能提高膜的一些性質(zhì),但整體性質(zhì)仍然較差,尤其是脆而易碎的問題,一直未能解決。有些改性方法復(fù)雜,較難操作,或引入了有毒物質(zhì)。利用1-乙基-3-(3-二甲基氨丙基)碳二亞胺鹽酸鹽(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide,EDC)做交聯(lián)劑,其最終一個分子的羧基和另一分子的氨基之間可以形成酰胺鍵,但EDC本身并沒有成為實際交聯(lián)的一部分。N-羥基琥珀酰亞胺(N-hydroxysuccinimide,NHS)能促進以上的交聯(lián)反應(yīng)。反應(yīng)機制如圖1所示[10]。水溶性的碳化二亞胺EDC與玉米醇溶蛋白的羧基反應(yīng),通過酰胺結(jié)合形成活潑的共價偶聯(lián)物O-酰基脲中間體。隨后,另一玉米醇溶蛋白分子的氨基通過親核攻擊,最終與玉米醇溶蛋白分子的羧基鏈接,同時釋放出水溶性的尿素衍生物。O-酰基脲非常活潑,如果不與氨基反應(yīng),則會很快水解并重新釋放出羧基基團。NHS促進了該反應(yīng),與含羧基的化合物反應(yīng),形成酰胺基酯類。與氨基反應(yīng)的速度相比,該酯類的水解要緩慢的多。因此NHS提高了碳化二亞胺結(jié)合羧酸鹽化合物與一級胺類的鏈接效率[10-11]。

圖1 利用EDC和NHS改善膜性質(zhì)的反應(yīng)機理[[1100]]Fig.1 Schematic showing amide bond formation from zein molecules reacted with EDC and NHS[[1100]]
由于EDC具有無毒、生物相容性良好等特點[12],目前已被用作膠原、纖維蛋白凝膠、麥谷蛋白膜、魚膠膜等的交聯(lián)劑。
玉米醇溶蛋白中含有大量的非極性氨基酸,在水中的溶解度比極性氨基酸要小,因此溶劑中水的含量將直接影響玉米醇溶蛋白的溶解度[13]。也就是說在不同體積分數(shù)的乙醇溶液中,玉米醇溶蛋白的溶解度也不同。此外,玉米醇溶蛋白是兩性分子,空間結(jié)構(gòu)上既有親水基團也有疏水基團,膜的耐水性與其分子親水基團、疏水基團的空間排列結(jié)構(gòu)有關(guān)[14]。乙醇是半極性分子,高體積分數(shù)乙醇可以破壞維持醇溶蛋白在乙醇溶液中形成的膠體穩(wěn)定的某些重要作用力(如氫鍵),而使醇溶蛋白的空間結(jié)構(gòu)發(fā)生變化,使原來包埋在內(nèi)部的疏水基團暴露于蛋白表面并與乙醇的疏水基團結(jié)合,生成疏水層,得到高耐水性的膜[15]。因此乙醇體積分數(shù)將顯著影響成型模的性質(zhì)。
本實驗采用EDC和NHS作為交聯(lián)劑,研究了不同乙醇體積分數(shù)、不同EDC和NHS含量條件下玉米醇溶蛋白膜的性質(zhì),并通過原子力顯微鏡觀測了蛋白的微觀結(jié)構(gòu),研究玉米醇溶蛋白膜的成膜規(guī)律及EDC和NHS對成膜性質(zhì)的影響。
1 材料與方法
1.1 材料與試劑
玉米醇溶蛋白 江蘇高郵日星藥用輔料有限公司;無水乙醇(分析純) 天津市化學(xué)試劑一廠;1-乙基-3-(3-二甲基氨丙基)碳二亞胺鹽酸鹽、N-羥基琥珀酰亞胺 生工生物工程(上海)股份有限公司。
1.2 儀器與設(shè)備
WDW-20H型微機控制電子式萬能試驗機 濟南中路昌試驗機制造有限公司;DGG-101-OBS型電熱鼓風(fēng)干燥箱 天津市天宇實驗儀器儀表公司;JY-82A型視頻接觸角測定儀 承德鼎盛試驗機檢測設(shè)備有限公司;JSPM-5200型原子力顯微鏡 日本電子公司。
1.3 方法
1.3.1 玉米醇溶蛋白膜的制備
取80%、85%、90%、95%的乙醇溶液各20 mL,于60℃水浴中加熱3 min,分別加入2 g玉米醇溶蛋白,混合均勻后再于60℃水浴中加熱10 min,將溶液倒于成膜模具中,室溫下干燥成膜。膜于相對濕度為50%的干燥器中平衡1周。
1.3.2 改性玉米醇溶蛋白膜的制備
如前述,在加入玉米醇溶蛋白的同時,加入EDC和NHS(以玉米醇溶蛋白質(zhì)量為基準),EDC的添加量分別為0.05、0.06、0.07、0.08 g/g,NHS的添加量分別為0.05、0.06、0.07、0.08 g/g。其余步驟同1.3.1節(jié)。
1.3.3 膜的機械性質(zhì)測定
將平衡后的膜裁成10 mm×100 mm的長條,有效測定長度為50 mm。用螺旋測微器測量膜的厚度,每個長條隨機測5個點,以平均值作為膜的厚度。萬能試驗機的拉伸速率為10 mm/min。每個試樣平行5次,以平均值作為抗拉強度和伸長率。
1.3.4 膜的水蒸氣透過率的測定
將膜裁成圓片,用螺旋測微器測量膜的厚度,每個圓片隨機測5個點,以平均值作為膜的厚度。將圓片密封在測試杯上,有效測量面積為半徑15 mm的圓,每個杯里放置10 g無水CaCl2,然后置于相對濕度90%、溫度25℃的環(huán)境中,每隔24 h,測試杯子的質(zhì)量。膜的水蒸氣透過率的計算見式(1)。

式中:WVP為水蒸氣透過率/(10-8(g·m)/(m2·h·Pa));m為杯子的增加質(zhì)量/g;L為膜的厚度/m;t為測試時間/h;S為膜的測試面積/m2;ΔP為膜的內(nèi)外水蒸氣壓差/Pa。
1.3.5 膜的耐水性測定
測量膜的吸水率和質(zhì)量損失率來表征膜的耐水性。樣品在50℃條件下恒溫干燥(24±1)h,干燥器中冷卻后稱質(zhì)量m1,干燥后的樣品放在(23±0.5)℃的純凈水中浸漬(24±1)h后取出,用干燥潔凈的紗布擦干,在1 min內(nèi)放在稱量瓶中,稱得吸水后的質(zhì)量m2;再將吸濕后的樣品于50℃恒溫干燥(24±1)h,冷卻后稱質(zhì)量m3。每個樣品平行測5次,計算其平均值。

1.3.6 膜的表面疏水性測定
測量膜的動態(tài)接觸角和靜態(tài)接觸角來表征膜的表面疏水性。采用躺滴法測量。將5 μL去離子水滴在玉米醇溶蛋白膜的表面,以5次/s的速率連續(xù)拍照10 s,記錄液滴在膜表面的形狀變化,測定接觸角。所有膜都是以90%乙醇為溶液所成的膜,采用膜的正面,每張膜隨機測定5個點。
同上法測量膜正面的動態(tài)接觸角,以平衡接觸角作為靜態(tài)角。每個樣品測量5個點。
1.3.7 膜的原子力顯微鏡觀測
取80%、85%、90%、95%的乙醇溶液各50 mL,于60℃水浴中加熱3 min,分別加入0.005 g玉米醇溶蛋白,混合均勻后再于60℃水浴中加熱10 min,取20 μL滴于云母片上,干燥后進行原子力顯微鏡掃描,采用輕敲模式,掃描面積為2 μm×2 μm,掃描速率為333.3 μs。改性膜為在加入玉米醇溶蛋白的同時加入0.0003 g EDC和0.0003 g NHS,其余同上。
2 結(jié)果與分析
2.1 EDC和NHS對玉米醇溶蛋白膜機械性質(zhì)的影響

圖2 EDC和NHS對膜抗拉強度的影響Fig.2 Effect of EDC and NHS on the tensile strength of zein films
由于以60%、70%乙醇為溶劑所成的膜表面龜裂較多,不能完整成膜,實驗未采用。由圖2可知,隨著乙醇體積分數(shù)從80%增加到95%,膜的抗拉強度先升高后降低,在90%時達到最大值。這是由于玉米醇溶蛋白中含有大量的非極性氨基酸,在水中的溶解度比極性氨基酸要小,因此溶劑中水的含量將直接影響玉米醇溶蛋白的溶解度[13]。隨著乙醇體積分數(shù)的增高,溶液中水含量降低,非極性氨基酸充分溶解,同時在熱作用下組織化變性,從而使成型模具有高的抗拉強度。當乙醇體積分數(shù)達到95%時,玉米醇溶蛋白的溶解度降低,產(chǎn)生沉淀,溶液中蛋白含量減少,所以成型膜的抗拉強度較90%時減小。
根據(jù)Kim等[10]的研究,EDC和NHS作為交聯(lián)劑等量加入。預(yù)實驗中,以90%乙醇為溶劑,EDC和NHS的加入量均為0.02、0.04、0.06、0.08、0.1 g/g。結(jié)果表明兩者添加量為0.02、0.04 g/g的玉米醇溶蛋白膜成膜不均勻,成型的膜脆度仍較大,表明交聯(lián)劑添加量不足,不能和所有玉米醇溶蛋白反應(yīng)。當兩者添加量達到0.1 g/g時,膜的抗拉強度與0.08 g/g時相比降低較大,表明此時添加過量。因此兩者添加量選為0.05、0.06、0.07、0.08 g/g。在此條件下加入EDC和NHS后,膜的抗拉強度均大幅提高。在兩者添加量為0.06 g/g時抗拉強度達到最大。以90%乙醇為例,未改性膜的抗拉強度為42 MPa,EDC和NHS的添加量分別為0.06 g/g時,抗拉強度為83 MPa,提高了97.6%。這是由于加入交聯(lián)劑后,玉米醇溶蛋白分子間發(fā)生了交聯(lián)。
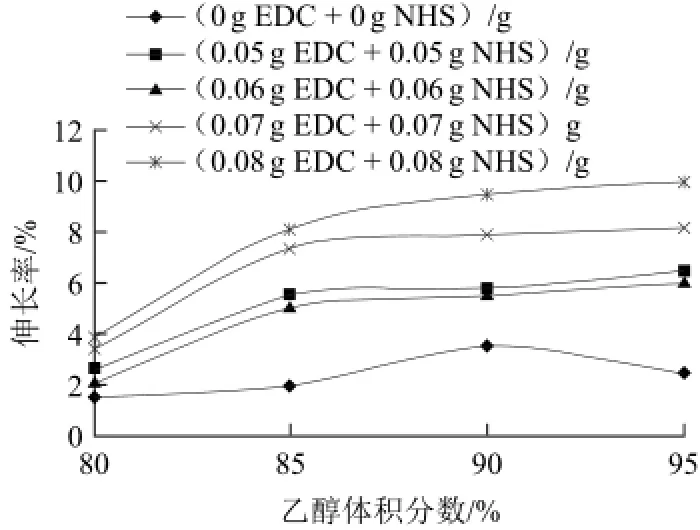
圖3 EDC和NHS對膜伸長率的影響Fig.3 Effect of EDC and NHS on the elongation of zein films
由圖3可知,未改性蛋白膜的伸長率很小,添加EDC和NHS后,膜的柔韌性大大提高,變得很柔軟,幾乎沒有裂口和碎片現(xiàn)象,伸長率也有所提高。在乙醇體積分數(shù)為95%、添加量為0.08 g/g時達到最大值10%,是相同乙醇體積分數(shù)條件下未改性蛋白膜的4倍。Yang Yiqi等[16]認為,玉米醇溶蛋白成型物易脆及延伸性差是因為在乙醇溶液中制備時,玉米醇溶蛋白蛋白不能完全展開,以致大量的側(cè)鏈基團阻止多肽互相接近,并以有序的結(jié)構(gòu)排列或在膜軸心定向排列。添加交聯(lián)劑后伸長率的顯著提高可能是因為大量的側(cè)鏈基團間發(fā)生交聯(lián),形成網(wǎng)狀結(jié)構(gòu),從而膜的柔韌性和延展性都有所提高。乙醇體積分數(shù)為90%,EDC和NHS的添加量各為0.06 g/g時,膜的抗拉強度最大,此時玉米醇溶蛋白分子間作用力最大,因此伸長率較小,為5.5%。但與90%乙醇體積分數(shù)條件下的未改性蛋白相比,仍提高了57.1%。
綜上所述,添加EDC和NHS能顯著提高玉米醇溶蛋白膜的機械性質(zhì)。
2.2 EDC和NHS對玉米醇溶蛋白膜水蒸氣透過率的影響

圖4 EDC和NHS對膜水蒸氣透過率的影響Fig.4 Effect of EDC and NHS on the water vapor permeability of zein films
由圖4可知,隨著乙醇體積分數(shù)的增加,玉米醇溶蛋白膜的水蒸氣透過率先降低后升高,在90%時達到最低值。這是由于在90%的乙醇溶液中,玉米醇溶蛋白分子溶解更充分,分子間結(jié)合力大,分子間隙小,因此水蒸氣透過率低。加入EDC和NHS后,膜的水蒸氣透過率大大降低,在添加量為0.06 g/g時水蒸氣透過率降到最低。以90%乙醇為例,未改性膜的水蒸氣透過率為4.4× 10-8(g·m)/(m2·h·Pa),當添加量為0.06 g/g時,該值降低到了2.5×10-8(g·m)/(m2·h·Pa),降低了43.2%。這是由于玉米醇溶蛋白分子發(fā)生交聯(lián),分子間隙變得更小,聚集體蛋白鏈片段移動性降低,因此交聯(lián)劑的加入大大降低了膜的水蒸氣透過率。而以95%乙醇為溶劑,當交聯(lián)劑含量增加到0.08 g/g時,水蒸氣透過率顯著增加,幾乎與未改性蛋白膜相等,這可能是由于玉米醇溶蛋白分子過多的交聯(lián),難以在95%的乙醇中充分溶解,從而造成分子間力降低,分子間隙較大。
2.3 EDC和NHS對玉米醇溶蛋白膜耐水性的影響
吸水率是耐水性的重要指標,通常情況下,吸水率越低,膜耐水性越好。由圖5可知,隨著乙醇體積分數(shù)的增加,膜的吸水率先降低后升高,在90%時達到最小值52.2%。玉米醇溶蛋白溶于乙醇溶液后會形成微束結(jié)構(gòu)蛋白聚集體,成型膜是各玉米醇溶蛋白分子聚集體的結(jié)合體。膜的耐水性與玉米醇溶蛋白分子親水基團、疏水基團的空間排列結(jié)構(gòu)有關(guān)[14]。當乙醇體積分數(shù)低于90%時,親水基團在微束聚集體外側(cè),隨著乙醇體積分數(shù)升高,水合粒徑逐漸減小[15],因此吸水率逐漸降低。當乙醇體積分數(shù)高于90%時,高體積分數(shù)乙醇破壞了維持玉米醇溶蛋白在乙醇溶液中形成的聚集體的穩(wěn)定性,埋在內(nèi)部的疏水基團暴露于蛋白表面生成疏水層。此時膜的吸水率應(yīng)該降低。但實際上,膜的吸水率升高了。這是因為當乙醇體積分數(shù)高于90%時,隨著乙醇體積分數(shù)升高,玉米醇溶蛋白分子的水合粒徑逐漸增大[15],95%的乙醇溶液不能完全溶解它,造成膜的結(jié)構(gòu)較松散,水分子更容易滲透到蛋白內(nèi)部。隨著交聯(lián)劑的增加,吸水率先降低后升高,當EDC和NHS的添加量均為0.06 g/g時,吸水率最低,為39.4%,降低了24.4%。加入低量的EDC和NHS后,膜的吸水率降低,這是因為玉米醇溶蛋白分子發(fā)生交聯(lián),分子間力增大,膜結(jié)構(gòu)致密,水分子不易滲透到蛋白內(nèi)部。而高含量的交聯(lián)劑使玉米醇溶蛋白分子過分交聯(lián),不能在乙醇溶液中完全溶解,膜結(jié)構(gòu)變得松散,水分子較容易滲透到蛋白內(nèi)部。
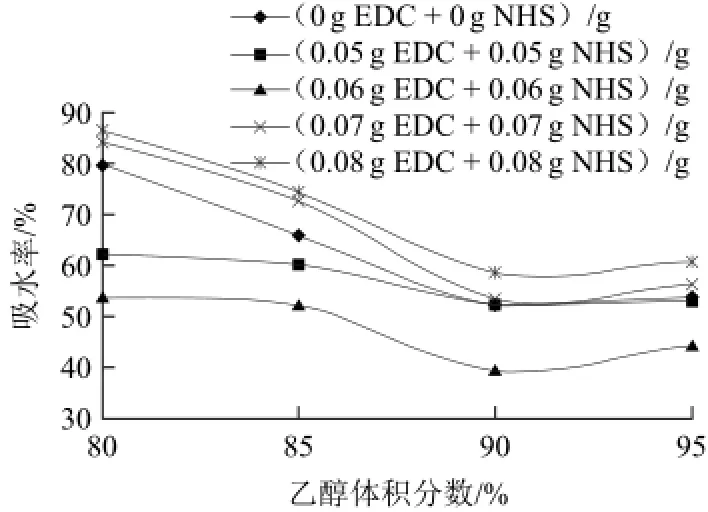
圖5 EDC和NHS對膜吸水率的影響Fig.5 Effect of EDC and NHS on the water absorption of zein films

圖6 EDC和NHS對膜質(zhì)量損失率的影響Fig.6 Effect of EDC and NHS on the weight loss of zein films
由圖6可知,隨著乙醇體積分數(shù)的增加,膜質(zhì)量損失率先降低后增高,在90%時達到最低值3.0%。這是因為乙醇體積分數(shù)為90%時,膜分子間力最大,分子間隙最小,物質(zhì)最難溶出。當膜浸泡在水中時,一方面膜會吸水,另一方面,膜中的某些成分會溶出到水中,造成膜的質(zhì)量損失。因此質(zhì)量損失率與膜的耐水性相關(guān)[17]。通常,疏水材料的質(zhì)量損失率比親水材料的要低。加入交聯(lián)劑后,膜質(zhì)量損失率比未改性時增加,證明耐水性降低。這是因為EDC和NHS是水溶性的,當膜浸泡在水中時,部分交聯(lián)劑會逐漸遷移到膜表面,最后溶入到水中,造成膜質(zhì)量損失率增加。而隨著交聯(lián)劑含量增加,膜質(zhì)量損失率先降低后增加,在EDC和NHS的添加量均為0.06 g/g時最低,為3.6%,這是因為該含量條件下,玉米醇溶蛋白分子結(jié)合最緊密,交聯(lián)劑較難溶出。
2.4 EDC和NHS對玉米醇溶蛋白膜表面疏水性的影響

圖7 EDC和NHS對膜動態(tài)接觸角的影響Fig.7 Effect of EDC and NHS on the dynamic contact angle of zein films
圖7中所有膜的溶劑均為90%的乙醇溶液。實際應(yīng)用中,液體在固體表面的潤濕行為是一個動態(tài)過程,從液滴接觸固體表面的瞬間開始,由固、液、氣三相組成的潤濕線是隨時間而移動,移動過程中無法達到平衡,在任意時刻潤濕線所產(chǎn)生的接觸角稱為動態(tài)接觸角,動態(tài)接觸角變化情況受到固體表面、測試液滴的黏度和表面張力影響[18]。水在膜表面形成接觸角的大小一定程度上反映膜表面的疏水性質(zhì),接觸角越大,疏水性越好。通常,形成較大的接觸角的表面(θ>65°)為疏水表面,而具有較小接觸角的表面(θ<65°)為親水表面[19]。由圖7可知,隨著時間延長,所有膜的接觸角呈先下降后穩(wěn)定的趨勢。穩(wěn)定時的接觸角為平衡接觸角。接觸角時間依賴性主要是由于水滴與聚合物接觸后其表面發(fā)生重構(gòu)引起,起始接觸角與平衡接觸角則分別與聚合物表面疏水性組分和親水性組分相關(guān)[20]。未改性蛋白的平衡接觸角為68.9°,證明此時膜為疏水表面。加入交聯(lián)劑后,接觸角都有所下降,證明膜的表面疏水性降低。這是因為EDC和NHS均是親水的,更易與水結(jié)合,從而使接觸角減小。而隨著交聯(lián)劑含量增加,膜接觸角先增大后減小,在EDC和NHS的添加量均為0.06 g/g時最大,為67.4°,比未改性時減小了2.2%,此時仍為疏水表面。此含量下,交聯(lián)劑和玉米醇溶蛋白分子結(jié)合最緊密,所以表面疏水性最好。其他膜接觸角均小于65°,為親水表面。
由圖8可知,未改性蛋白膜的接觸角隨著乙醇體積分數(shù)的增加,先增大后減小,在90%時達到最大,為68.9°,此時為疏水表面。加入交聯(lián)劑后,接觸角均減小,證明膜的表面疏水性降低了。隨著交聯(lián)劑含量增加,接觸角先增大后減小,在EDC和NHS的添加量均為0.06 g/g時最大。

圖8 EDC和NHS對膜靜態(tài)接觸角的影響Fig.8 Effect of EDC and NHS on the static contact angle of zein films
2.5 原子力顯微鏡圖

圖9 玉米醇溶蛋白膜原子力顯微圖(2 μm×2m2 μm)Fig.9 Atomic force microscope photographs of zein films (2 μmm×2 μmm)
由圖9可知,許多圓形或橢圓形的蛋白小球,每個小球都是由許多玉米醇溶蛋白單體聚集而成的蛋白聚集體。它們大小的不均勻性,可能是由于聚集程度的不同造成的[21]。純蛋白膜的聚集體排列不是特別緊密,隨著乙醇體積分數(shù)的升高,聚集體間隙先減小后增大,在90%時排列緊密,間隙最小,所以膜的整體性質(zhì),在乙醇體積分數(shù)為90%時達到最佳。加入交聯(lián)劑后,聚集體尺寸明顯變小,且大小均一,排列緊密。這證明EDC和NHS阻礙了玉米醇溶蛋白的聚集。Kim等[10]用動態(tài)光散射技術(shù)證明,EDC和NHS阻礙了玉米醇溶蛋白在乙醇溶液中的聚集。本研究結(jié)果與其一致。造成該現(xiàn)象的原因可能是加入交聯(lián)劑后,玉米醇溶蛋白分子間發(fā)生交聯(lián),形成聚集體,當交聯(lián)的數(shù)目達到一定時,玉米醇溶蛋白分子間不再交聯(lián),而聚集體之間發(fā)生交聯(lián),最終形成了排列緊密的結(jié)構(gòu)。這些結(jié)構(gòu)是一層層的,許多層結(jié)合在一起,從而形成了玉米醇溶蛋白膜。也就是說這些聚集體形成的結(jié)構(gòu)構(gòu)成了膜的結(jié)構(gòu)基礎(chǔ)。由于排列緊密,間隙小,分子間作用力增大,所以加入交聯(lián)劑后,玉米醇溶蛋白膜的性質(zhì)有顯著提高。
3 結(jié) 論
未改性玉米醇溶蛋白膜在乙醇體積分數(shù)為90%時,各項性質(zhì)優(yōu)于80%、85%和95%乙醇條件下所制得的膜,但膜柔韌性差,抗拉強度較低。添加交聯(lián)劑EDC和NHS能顯著提高膜的抗拉強度和柔韌性,降低水蒸氣透過率。這是因為加入交聯(lián)劑后,玉米醇溶蛋白分子間發(fā)生了交聯(lián),最終,玉米醇溶蛋白分子的羧基與另一蛋白分子的氨基交聯(lián),分子間結(jié)合力增大,分子間隙減小。
通過原子力顯微鏡觀測,蛋白呈圓形或橢圓形的小球,這是玉米醇溶蛋白的蛋白聚集體。純蛋白膜的聚集體均一性差,排列不緊密,在乙醇體積分數(shù)為90%時排列緊密,間隙小。加入交聯(lián)劑后,聚集體尺寸明顯變小,且大小均一,排列緊密,間隙小,證明EDC和NHS阻礙了玉米醇溶蛋白的聚集。
[1] XU Weijie, YANG Yiqi. An acidic method of zein extraction from DDGS[J]. J Agric Food Chem, 2007, 55(15): 6279-6284.
[2] MANGAVEL C, BARBOT J, GUEGUEN J, et al. Molecular determinants of the influence of hydrophilic plasticizers on the mechanical properties of cast wheat gluten films[J]. Journal of Agricultural and Food Chemistry, 2003, 51(5): 1447-1452.
[3] CABRA V, ARREGUIN R, VAZQUEZ-DUHALT R, et al. Effect of temperature and pH on the secondary structure and processes of oligomerization of 19 kDa alpha-zein[J]. Biochimica Et Biophysica Acta-Proteins and Proteom ics, 2006, 1764(6): 1110-1118.
[4] SHUKLA R, CHERYAN M. Zein: the industrial protein from corn[J]. Industrial Crops Products, 2001, 13(3): 171-192.
[5] MATSUSHIMA N, DANNO G L, TAKEZAWA H, et al. Threedimensional structure of maize alpha-zein proteins[J]. Biochim Biophys Acta, 1997, 1339(12): 14-22.
[6] 吳磊燕. 玉米醇溶蛋白改性、界面特性及成膜性研究[D]. 廣州: 華南理工大學(xué), 2010.
[7] BYARUHANGA Y B, ERASMUS C, EMMAMBUX M N, et al. Effect of heating cast kafirin films on their functional properties[J]. Journal of the Science of Food and Agriculture, 2007, 87(1): 167-175.
[8] LAWTON J W. Zein: a history of processing and use[J]. Cereal Chemistry, 2002, 79(1): 1-18.
[9] 吳國際, 呂長波, 魯傳華, 等. 玉米醇溶蛋白的物理化學(xué)改性[J]. 中國組織工程研究與臨床康復(fù), 2011, 15(25): 4665-4668.
[10] KIM S, SESSA D J, LAWTON J W. Characterization of zein modi ed with a mild cross-linking agent[J]. Industrial Crops and Products, 2004, 20: 291-300.
[11] TAGUCHI T, SAITO H, IWASASHI M, et al. Development of a novel glue consisting naturally-derived biomolecules: citric acid and human serum albumin[J]. Nanosci Nanotechnol, 2007, 7(3): 742-747.
[12] 王迎軍, 楊春蓉, 汪凌云. EDC/NHS交聯(lián)對膠原物理化學(xué)性能的影響[J]. 華南理工大學(xué)學(xué)報: 自然科學(xué)版, 2007, 35(12): 66-70.
[13] 陳野, 杜悅, 王冠禹. 前處理乙醇濃度對玉米醇溶蛋白膜性質(zhì)的影響[J]. 食品科學(xué), 2009, 30(19): 100-103.
[14] WANG Q, GEIL P, PADUA G. Role of hydrophilic and hydrophobic interactions in structure development of zein films[J]. Journal of Polymer and the Environment, 2004, 12(3): 197-202.
[15] KIM S. Aggregate formation of zein and its structural inversion in aqueous ethanol[J]. Journal of Cereal Science, 2008, 47: 1-5.
[16] YANG Yiqi, WANG Liming, LI Shiqi. Formaldehyde-free zein fiber preparation and investigation[J]. J Appl Polym Sci, 1996, 59(3): 433-441.
[17] LIU Chaoming, CHEN Yun, WANG Xiaomei, et al. Improvement in physical properties and cytocompatibility of zein by incorporation of pea protein isolate[J]. J Mater Sci, 2010, 45: 6775-6785.
[18] MYERS D. Surfaces, interfaces and colloids: principles and applications[M]. John Wiley &Sons Inc, 1999: 415-447.
[19] HERSHKO V, NUSSINOVITCH A. Relationships between hydrocolloid coating and mushroom structure[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 2988-2997.
[20] KWOK D Y, NEUMANN A W. Contact angle measurement and contact angle interpretation[J]. Advances in Colloid and Interface Science, 1999, 81: 167-249.
[21] 郭云昌, 劉鐘棟, 安宏杰, 等. 基于AFM 的玉米醇溶蛋白的納米結(jié)構(gòu)研究[J]. 鄭州工程學(xué)院學(xué)報, 2004, 25(4): 8-11.
Effects of EDC and NHS on Physical Properties of Zein Films
ZHANG Min, CHEN Ye*, LIU Jun, ZHOU Shu-hong, WANG Jun-yu, LI Yan-dan
(College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
The effects of 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) and N-hydroxysuccinimide (NHS) as crosslinking reagents on the structure and properties of zein fi lms were investigated to fi nd ways to improve the tensile strength and elongation and reduce the water vapor permeability and moisture absorption. Results showed that fi lms prepared with 90% ethanol as the solvent and 0.06 g of EDC/g zein or 0.06 g of NHS/g zein exhib ited the best properties. The tensile strength, elongation, water vapor permeability, moisture absorption and weight loss were 83 MPa, 5.5%, 2.5 × 10-8(g·m)/ (m2·h·Pa), 39.4% and 3.6%, which were increased by 97.6%, 57.1%, reduced by 43.2% and 24.4%, and enhanced by 20.0% compared to those without added cross-linking reagent, respectively, and the static water contact angle of the experimental samples was 67.4°, indicating the fi lm surface to be hydrophobic. In addition, the surface of zein fi lms containing EDC and NHS was arranged orderly and closely as smaller uniform spherical aggregates as observed using atomic force microscope (AFM)
1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC); N-hydroxysuccinimide (NHS); zein; fi lm properties
TQ321.4
A
1002-6630(2014)01-0012-06
10.7506/spkx1002-6630-201401003
2012-10-16
國家自然科學(xué)基金面上項目(31071634)
張敏(1987—),女,碩士研究生,研究方向為食品產(chǎn)品與技術(shù)開發(fā)。E-mail:zm1112011@163.com
*通信作者:陳野(1968—),男,教授,博士,研究方向為農(nóng)產(chǎn)品加工。E-mail:chenye@tust.edu.cn

