產角質酶酵母菌的發現與鑒定及產酶條件的優化
冉琴琴 張效寧 張文坤 張學俊 張萌萌
(1.貴州大學 貴州省發酵工程與生物制藥重點實驗室,貴陽 550025;2.貴州大學釀酒與食品工程學院,貴陽 550025)
從植物中提取天然活性成分化合物,即從植物的組織結構中溶出這些化合物,并使之與固體組織分離。傳統的天然產物提取方法有堿煮法、酸煮法以及水煮或醇煮法,但這些方法都涉及到高溫蒸煮,對藥效好的高活性藥物可能造成活性喪失;特別是酸性或堿性條件下,還有可能改變化合物的藥效結構,如苷鍵、酯鍵的水解等。環境污染明顯也是傳統方法的一大弊端。酶降解提取植物中天然藥物成分方法是一種溫和的提取方法,因為組織結構的破壞,多種組分可一并溶出,顯著地減少提取液的用量,降低污染,降低單一組分的提取成本;多種天然產物的同時溶出,可提高分離純化的效率,降低純化的成本;此外,酶法提取最大的特點就是反應條件溫和,酶作為一種生物催化劑,具有高效性、底物專一性等特點,在反應中不會發生副反應,保證了植物中有效成分的結構性質不被破壞,有利于后續生產。杜仲(Eucommia ulmoides Oliv)是中國特有的名貴經濟樹種[1,2],杜仲葉與杜仲皮中的化學成分十分相似,有著同樣的藥理作用,而且杜仲葉中還含有多種杜仲皮中所沒有的成分,杜仲屬于落葉喬木,其葉子是可再生的,資源豐富[3],相比于杜仲皮更具有開發價值。杜仲葉中的杜仲膠、綠原酸、桃葉珊瑚苷、杜仲黃酮、木脂素等多種成分的同時提取是對自然資源的充分利用和保護,最終使整個生產獲得較高的經濟效益和社會效益。
但是,用纖維素酶、果膠酶、蛋白酶、淀粉酶等生物酶降解葉片植物組織和細胞壁[4,5]時,在葉片組織的最外層有一層保護植物組織不受外界生物浸蝕的角質保護層,阻擋了各種酶降解植物組織的作用。當致病菌入侵植物時,必須分泌出角質酶降解角質層,破壞角質層后方可侵入到植物內部。同樣,欲用酶水解植物葉片,必須先水解表面的角質層。
目前的研究已證明,角質酶是降解角質層的最主要的功能酶。而在自然界中,角質酶的來源十分有限,僅有微生物和花粉[6]兩個途徑。產角質酶的微生物也很少,主要為植物的病原真菌,至今尚無有關于產角質酶酵母菌的報道。相對于病原真菌的培養來說,酵母菌的意義更為重大,因為酵母菌生長周期比其他病原真菌短,且對環境來說不具有病原真菌的危害性,是安全的。
角質酶(EC3.1.1.74)是一種多功能酶[7],具有屬于α/β 水解酶折疊的共同結構的蛋白質,可以降解角質產生大量的脂肪酸[8],也可以水解甘油三酯等化合物[8,9]。角質酶是絲氨酸水解酶家族中較小的成員。因為角質酶能夠水解短鏈或長鏈酯類,還能夠催化酸與醇的酯化、脂肪酸鹽與醇的轉酯化等反應,在食品工業、制藥工業、化工工業及印染工業等許多領域得到廣泛應用[10],因此,對產角質酶菌株的研究意義十分重大。本研究從病變的杜仲葉分離出一株能高產角質酶的菌種,鑒定分析證實該菌株是膠紅酵母,并對該菌株發酵產角質酶的條件進行優化,旨在為角質酶的大規模生產提供參考。
1 材料與方法
1.1 材料
1.1.1 試驗材料 對硝基苯丁酸酯(p-nitrophenyl butyrate,PNB)購自Sigma 公司;杜仲葉購買于貴州省遵義市遵義縣新舟鎮金仲村;馬鈴薯購于附近市場;NaNO3、K2HPO4、MgSO4、KCl、FeSO4·7H2O、瓊脂、葡萄糖、草酸、草酸銨、Na2HPO4、KH2PO4等試劑均為國產分析純。
1.1.2 培養基 基礎培養基(PDA):馬鈴薯200 g,葡萄糖20 g,瓊脂20 g(液體培養基中不加瓊脂),蒸餾水 1 000 mL。富集培養基[11]:馬鈴薯20%,葡萄糖 2%,KH2PO4·3H2O 0.5%,硫胺素(VB1)0.008%。篩選培養基:NaNO33.0 g;K2HPO41.0 g;KCl 0.5 g;FeSO4·7H2O 0.01 g,瓊 脂17 g,蒸 餾 水1 000 mL,角質0.2%。發酵基礎培養基[12]:葡萄糖 1.0%,NaNO30.6 g/L,K2HPO40.6 g/L,MgSO40.2 g/L,KCl 0.2 g/L,FeSO4·7H2O 0.1 g/L,角質0.1%。
以上培養基除需要特別要求的pH 用HCl 或NaOH 調節外,其余的均為自然pH,于121℃滅菌20 min,冷卻至室溫備用。
1.2 方法
1.2.1 菌種分離 挑選病變的杜仲葉揉碎,取少量加入富集培養基中在30℃恒溫振蕩培養箱中培養2 d 后,取其培養液用無菌水按一定倍數稀釋涂布,接種于篩選培養基的平板上培養24 h 后進行觀察識別,將識別的不同菌株分別在不同的PDA 平板上劃線培養,連續分離操作3 次,對菌株反復進行分離、純化。
1.2.2 角質酶酶活的測定 酶活測定[13]:以對硝基苯丁酸酯(PNB)為底物測定酶的活力。反應體系為1.8 mL,包括200 μL 的粗酶液、200 μL 0.4%的Tritonx-100、1 380 μL 50 mmol/L 磷 酸 鹽 緩 沖 液(pH7.0)和20 μL 1.76%的PNB 溶液。于37℃反應10 min 后,在波長405 nm 處測定吸光度值。在反應條件下,將每毫升酶液每分鐘產生1 μg 的對硝基苯酚定義為1 個酶活單位,即1 U/mL。
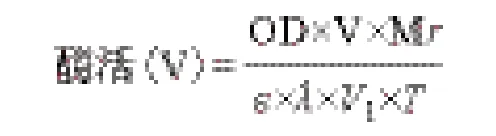
其中,OD:吸光值;V:反應體系的體積,1.8 mL;Mr:產物對硝基苯酚的分子量,139.11 g/mol;ε:摩爾消光系數,6 830 L/(mol·cm);λ:比色皿的光程,0.5 cm;V1:酶液體積,200 μL;T:反應時間10 min。
1.2.3 培養方法 種子培養:將儲備于低溫冰箱中的菌種接入斜面種子培養基上,在30℃培養48 h,然后接種于裝有100 mL 液體PDA 的250 mL 錐形瓶中,30℃、160 r/min 搖床培養36 h。
發酵培養:將菌種活化后接種到裝有100 mL 基礎培養的250 mL 錐形瓶里,置于30℃恒溫搖床中、160 r/min 環境下培養。6 d 后將發酵液用12 層紗布過濾,濾液再于5 500 r/min 4℃下離心30 min,上清即為粗酶液,用于酶活測定。
1.2.4 菌種鑒定方法 首先按SK8229 真菌基因組DNA 抽提試劑盒的要求提取DNA,并以提取得到的真菌DNA 作為模板,再使真菌通用引物擴增18S rDNA 的序列。上游引物NS1 為:5'-GTAGTCATATGCTTGTCTC-3',下游引物NS6 為:5'-GCATCACAGACCTGTTATTGCCTC-3'。PCR 擴增的反應條件為:98℃預變性3 min;98℃變性25 s,55℃退火25 s,72℃延伸1 min,30 個循環;72℃延伸10 min,4℃終止反應。取10 μL PCR 的反應產物在2%瓊脂糖凝膠上電泳。產物在上海生工生物工程股份有限公司對該菌株進行基因和結構方面的鑒定。
1.2.5 分離方法與依據 為了有針對性的選育能有效地降解杜仲葉表面角質層的菌株,首先將采來的杜仲葉發水,有利于霉菌在杜仲葉表面附著繁殖。在不同的環境,室內、室外、陰暗處、土壤表面等條件下進行培養。結果發現,在實驗室內置于的大盆中,覆蓋有塑料膜的潮濕杜仲葉有一部分發生了病變,長出較少的菌斑。仔細觀察發現,有的菌斑剝離后,杜仲葉表面有潰瘍現象,說明這部分菌斑有產角質酶的能力。
植物角質是高等植物表層的一種生物聚酯,其單體主要由十六碳、十八碳的羥基脂肪酸和環氧脂肪酸組成,而角質水解的過程中降解出來的脂肪酸產物會降低培養基中的pH。能產生角質酶的菌種在一種經改良的查彼克—多克斯(Zapek-Dox)選擇性培養基上生長,在這種培養基中含有作為菌種唯一碳源的純角質和一種酸堿指示劑。能產生角質酶的菌株,在這種培養基中,由于酸堿性指示劑的作用,在菌絲的前端產生顏色變化帶。這是由于菌種產生角質酶將角質降解生成脂肪酸,使培養基中的pH值下降而導致的。這是一種簡便、快速而靈敏的測定真菌產生角質酶的分析法[14]。據文獻報道此方法最初是用于觀察引起木瓜炭疽病菌產生的缺乏角質酶突變體,但它也可以用來測定其它真菌產生的角質酶。
酸堿指示劑一般是有機弱酸或有機弱堿,其共軛酸堿形式具有明顯不同的顏色。但酸堿指示劑本身具有酸堿性質,也會消耗少量的脂肪酸,用量過大會使色帶的變化不明顯而引起較大的誤差。在不同濃度下測驗指示劑,以了解由于pH 的降低所引起的指示劑最佳顏色變化。本試驗中所選用指示劑指示范圍見表1。
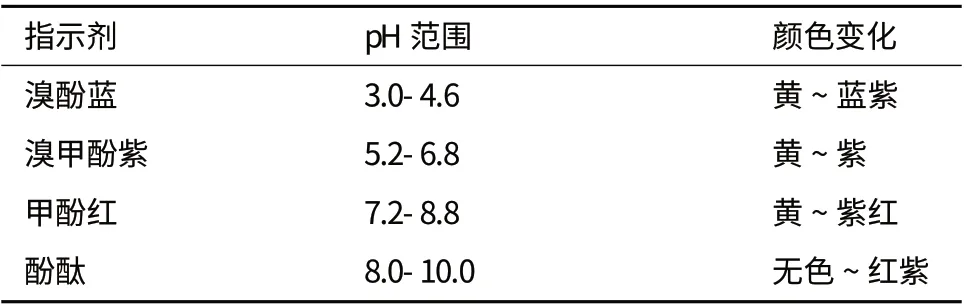
表1 指示劑指示范圍
2 結果
2.1 指示劑的確定
將分離前的菌株群接入含有不同指示劑的篩選培養基上,置于27℃下培養,并觀察記錄各菌種生長及培養基顏色變化,結果見表2。將篩選培養基中的角質替換成0.2%的葡萄糖,其它操作處理同上,置于27℃下培養,并觀察記錄各菌種生長及培養基顏色變化,結果見表3。

表2 分離前的菌群在含不同指示劑的培養基中的生長情況

表3 分離前的菌群在不含角質的培養基中的生長情況
2.2 產角質酶菌種的篩選
指示劑顯色反應證明,發生病變的杜仲葉通過富集培養后,得到的菌株群具有產角質酶的功能。但是這是多種菌株混合菌群。經過多次反復的分離、培養,最終分離純化得到3 株比較強壯的菌種,分別為1 號粉紅色菌、2 號粉墨綠色菌和3 號白色菌(圖1)。
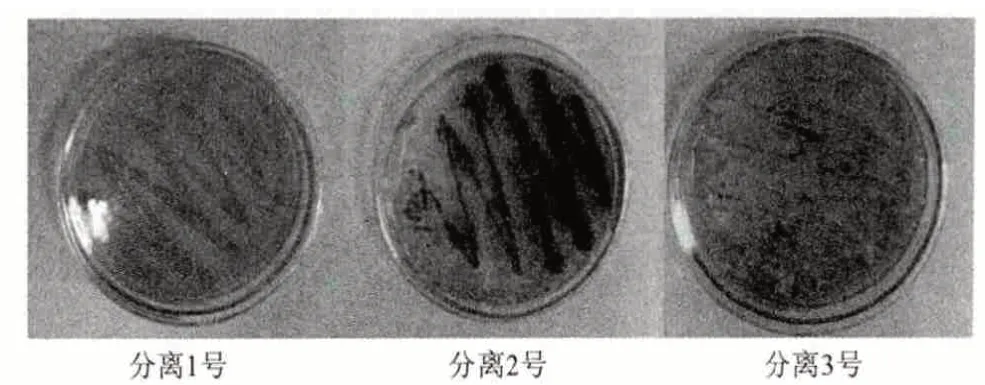
圖1 分離得到的3 種菌
將所選的菌種接入加有指示劑的PDA 平板培養基上,于27℃下培養48 h 后,觀察各菌種生長情況,挑選各菌種生長比較好的平板,在平板中間放入滅過菌的牛津杯,向其中加入0.1 mL 1.76%的PNB,6 h 后觀察記錄各菌平板顏色變化(表4)。

表4 病菌生長情況及培養基顏色變化
指示劑的顏色反應表明,1 號和2 號分離菌株具有明顯的產角質酶功能,白色的3 號菌株幾乎不產角質酶。為了進一步研究這3 株菌株的產角質酶功能,對它們進行了產角質酶酶活的測定。在實驗室中以確有產角質酶功能的棉花枯萎病菌、蘋果炭疽病菌和煙草赤星病菌為對照,同時對以上分離所得的3 種菌株進行了發酵培養,得到粗酶液進行酶活測定。從圖2 中可看出,分離得到的1 號粉紅菌株的酶活(產酶量)較高,僅次于棉花枯萎病菌的產酶量,高于蘋果炭疽病菌和煙草赤星病菌,是一株理想的產角質酶的菌株,而2 號墨綠色菌株和3號白色菌株也具有產角質酶的功能,只是產酶量和酶活僅為1 號粉紅菌株的一半,甚至更低。因此把研究的重點放在了1 號粉紅色菌株。
2.3 菌株的鑒定
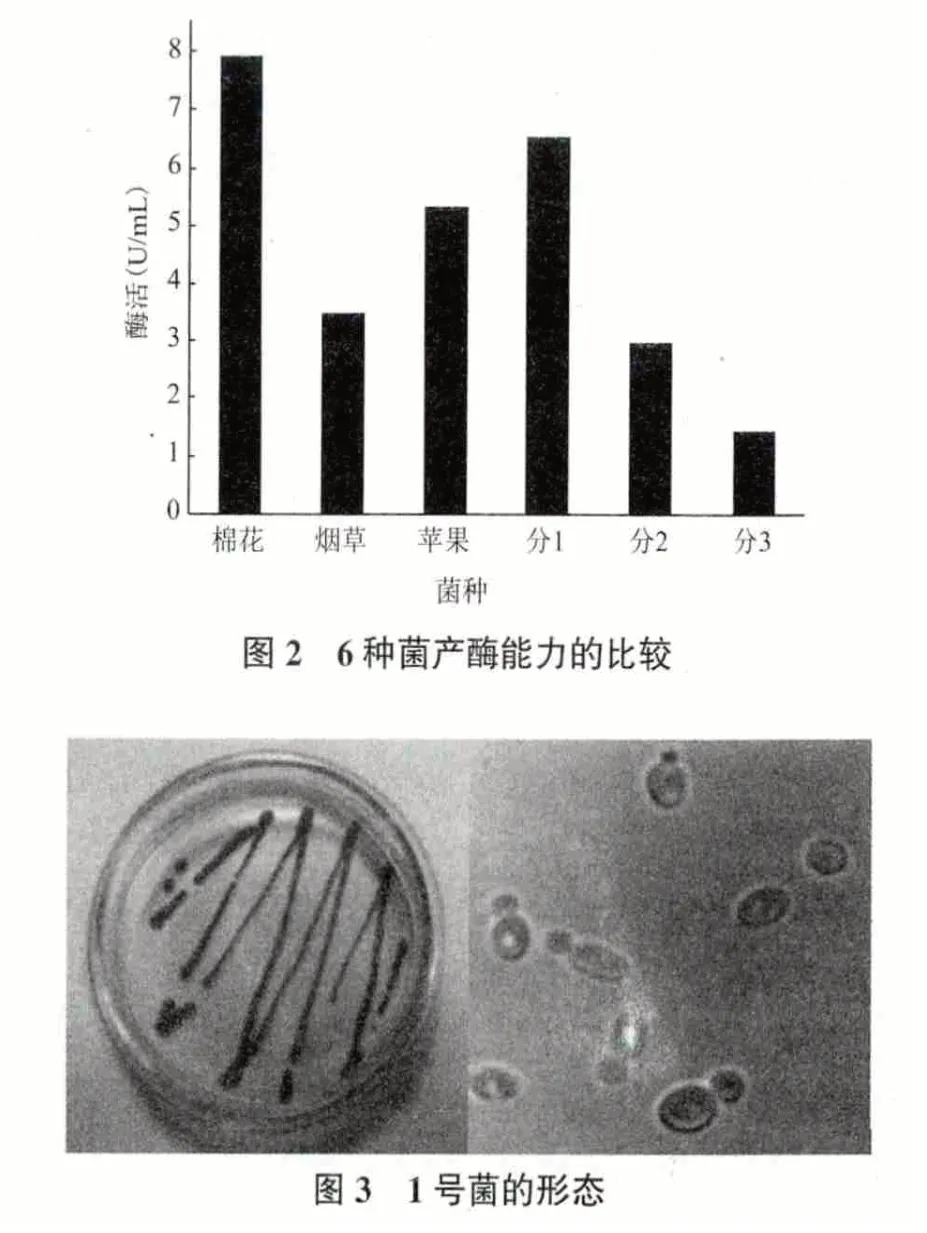
在圖2 中的6 種菌中,分離1 號菌種的產酶量相對較高,僅次于實驗室已有的棉花枯萎病菌,是在實驗室中從杜仲葉上生長出來的未知的菌株。對這一新菌株進行了形貌、生化及結構的研究。對分離1 號菌種進行制片和顯微鏡觀察(圖3),可看出菌種表面平滑,在顯微鏡下呈橢圓形,出芽繁殖,有芽孢。初步判定該菌為酵母菌。
將分離得到的1 號菌株接到斜面上,培養2 d后,進行凝膠電泳分析。結果(圖4)顯示,擴增的DNA 片段IS180 在約1 500 bp(base pair)處有一條明亮的PCR 特征性條帶,用Applied Biosystems 3730XL 測序軟件得出該菌株的DNA 序列為TAAGTTTAAG-----------GGACTATCCA 且長度為1 339 bp。將所獲得的DNA 在NCBI 上進行序列比對發現,有5 種菌株匹配性最高,且都屬于Rhodotorula mucilaginosa(膠紅酵母),它們的匹配E 值為0,Ident 值為100%,覆蓋率為99%。通過比對,從NCBI 的核酸基因數據庫中得到11 條與1 號菌的PCR 擴增序列匹配性、覆蓋率、E 值、匹配一致性最相符的序列。
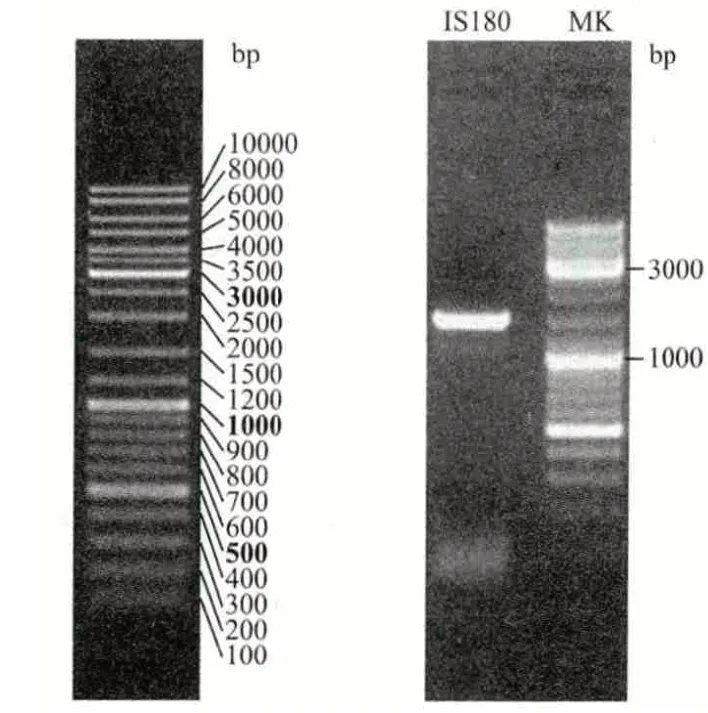
圖4 DNA 電泳圖
將這11 條序列與1 號菌PCR 擴增所得序列在MEGA5.0 軟件上構建系統發育樹(圖5)。
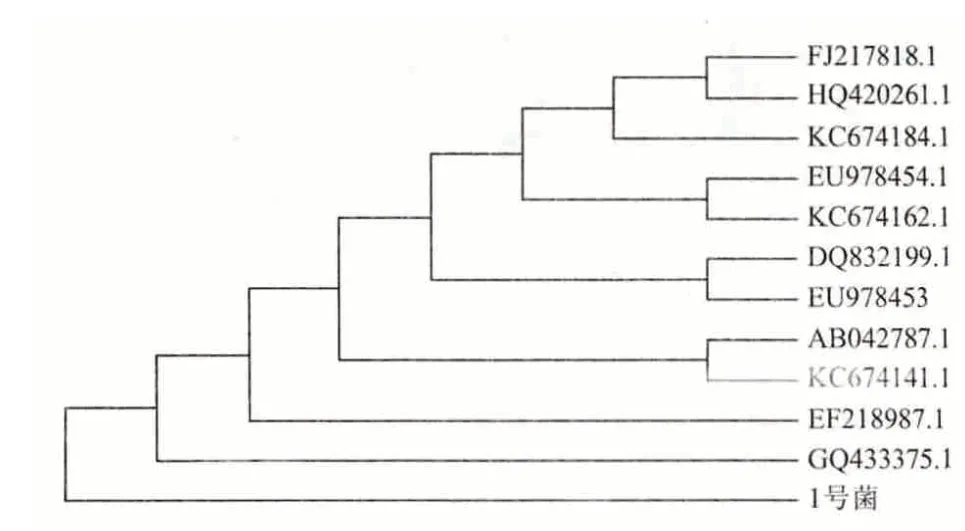
圖5 MEGA5.0 構建的系統發育樹
圖5 顯示,1 號菌與膠紅酵母18S rRNA 克隆的部分序列(Uncultured fungus clone nco85d05c1 18S ribosomal RNA gene,partial sequence)都屬于真菌膠紅酵母(Rhodotorula mucilaginosa)。而且,分離1號菌與膠紅酵母菌株ZM-1 18S rRNA 部分序列[(Rhodotorula mucilaginosa strain ZM-1 18S ribosomal RNA gene,partial sequence(序列號為GQ433375.1)]的親緣關系最近,因此可判定1 號菌株是膠紅酵母菌(Rhodotorula mucilaginosa)。
2.4 1號菌株產酶條件的優化
2.4.1 最佳碳源 在發酵基礎培養基中分別添加蔗糖、可溶性淀粉、乳糖、麥芽糖、葡萄糖作為碳源,濃度均為1%,培養6 d 后測酶活,結果(圖6)顯示,在分離1 號菌發酵產角質酶的培養基中,最適合其發酵生產角質酶的碳源是乳糖,其次是葡萄糖,因此將該菌的發酵培養基中碳源換為乳糖。
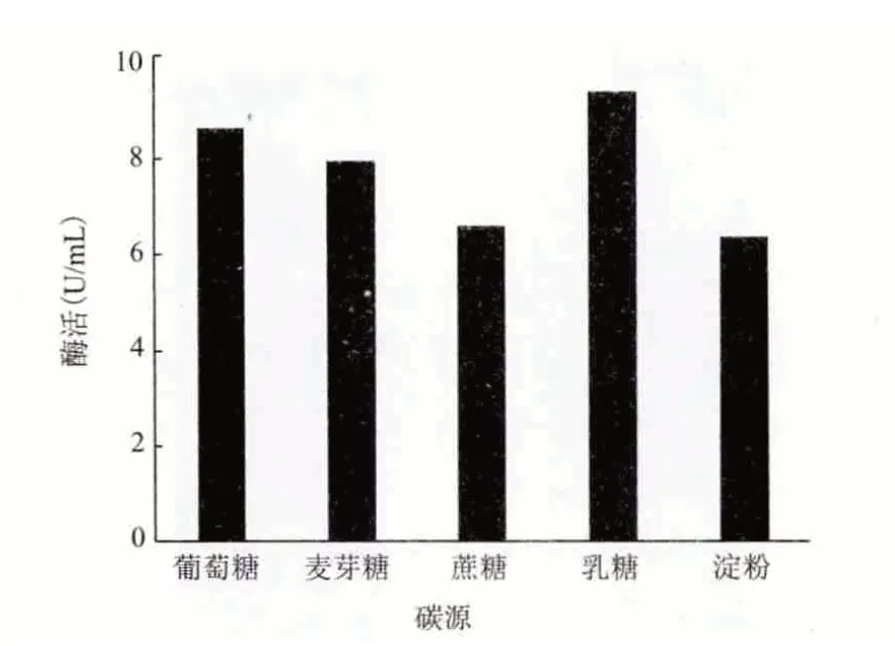
圖6 最佳碳源的篩選結果
2.4.2 最佳氮源 發酵基礎培養基中分別以酵母膏、蛋白胨、硫酸銨、氯化銨和硝酸鈉為其氮源,濃度均為1%進行培養。培養6 d 后測酶活,結果(圖7)顯示,最適合該菌發酵生產角質酶的氮源是酵母粉,蛋白胨次之,因此將該菌的發酵培養基中氮源定為酵母粉。
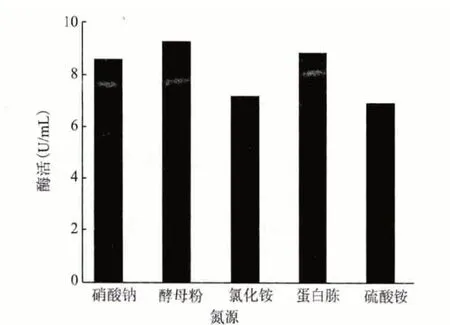
圖7 最佳氮源的篩選結果
2.4.3 1 號菌的生長曲線 將保存的1 號菌接入液體PDA 培養基中振蕩培養18 h 后,以10%的接種量接入裝有200 mL 液體PDA 培養基的500 mL 錐形瓶中,置于30℃、160 r/min 的搖床中振蕩培養,每隔2 h 取其發酵液,用未接種的空白培養液做參比,在波長為600 nm 處測定其吸光度。生長曲線(圖8)表明該菌培養4 h 后開始進入對數生長期,生長繁殖迅速,培養到30 h 后,該菌進入穩定期,生長繁殖基本進入平穩期。
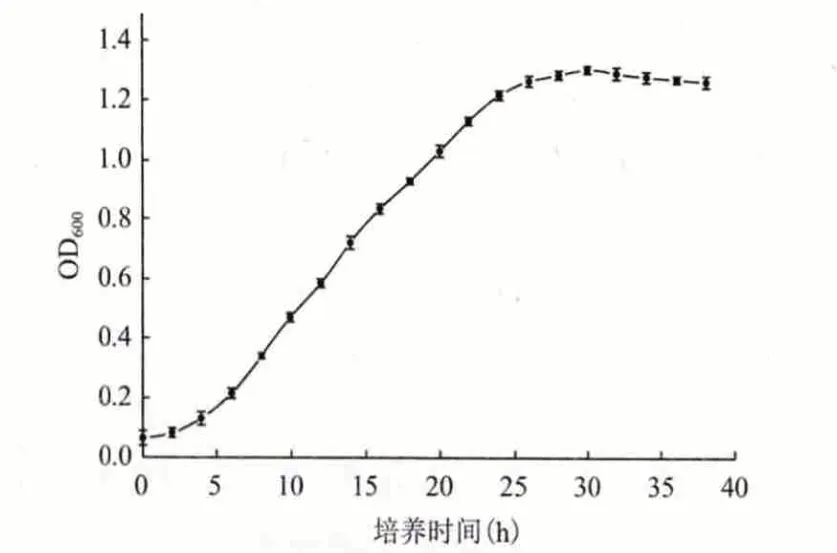
圖8 生長曲線
2.4.4 產角質酶最佳時間 通過生長曲線的分析,將保存的分離1 號菌株活化1 d 后,接入裝有100 mL 發酵基礎培養基(將葡萄糖換為乳糖,氮源換為酵母粉)的250 mL 錐形瓶中,置于30℃搖床中,160 r/min 振蕩培養,每天均勻取該菌發酵液8 mL 于5 500 r/min、4℃離心30 min,上清液用于測定酶活。結果(圖9)顯示,該菌的產酶最佳時間為5 d,前5 d 角質酶的含量持續增加,第5 天達到最高,之后角質酶含量有輕微的減少,最佳時間選為5 d。對比圖8 和圖9,說明菌的生物量達到最大時的時間很短,而產生角質酶最大酶活的時間則需5 d 時間。

圖9 產酶最佳時間
2.4.5 最適溫度 保存的分離1 號菌活化1 d 后,接入裝有100 mL 發酵基礎培養基(將葡萄糖換為乳糖,氮源換為酵母粉)的250 mL 錐形瓶中,分別置于20℃、25℃、28℃、30℃、35℃和40℃的搖床中,160 r/min 振蕩培養5 d 后,按照1.2.3 的方法處理,用于測定酶活。溫度對角質酶活性的影響(圖10)顯示,該菌最適發酵產酶的溫度為28℃。
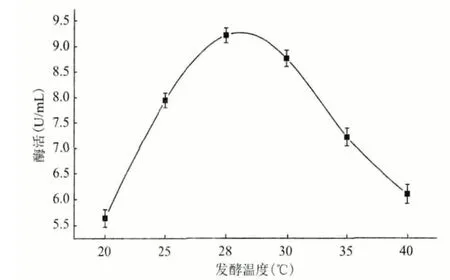
圖10 產酶最適溫度
2.4.6 培養基的初始pH 分別用稀鹽酸和稀氫氧化鈉將發酵基礎培養基(碳源換為乳糖)的pH 調至:5.0、5.5、6.0、6.5、7.0、7.5 和8.0 七個梯度,將分離1 號菌種活化1 d 后,分別接入裝有100 mL 不同pH 梯度培養基的250 mL 錐形瓶中,置于28℃搖床中,160 r/min 振蕩培養5 d 后,測定酶活。圖11 顯示,初始pH 為6.5 時最有利于該菌發酵培養產角質酶。
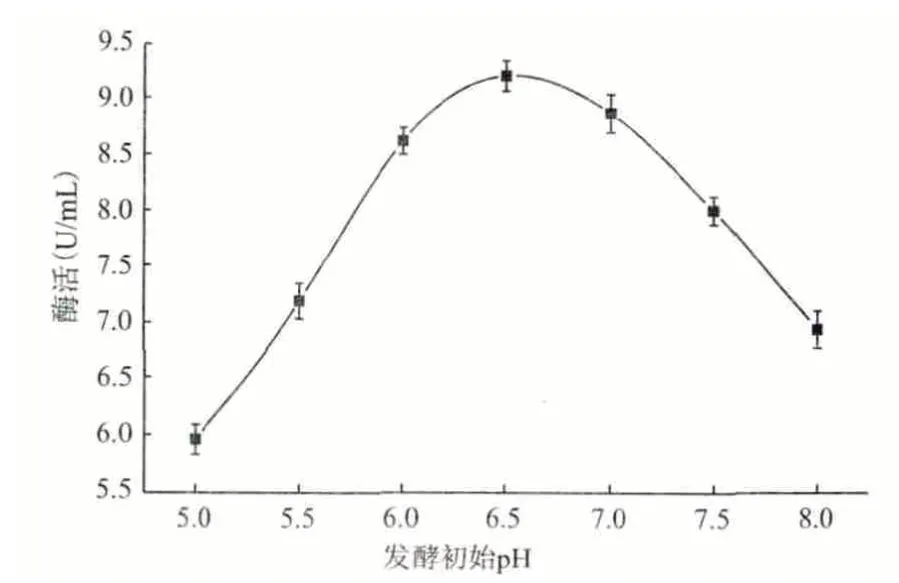
圖11 初始pH 對產酶的影響
3 討論
杜仲葉中含有大量的活性藥物成分,存在葉片細胞內或者細胞間,在提取這些物質時破壞植物組織和細胞壁就可以釋放出這些藥物成分。杜仲葉的細胞壁可用纖維素酶和果膠酶降解,但其最外層的角質層保護葉片免受生物酶和微生物的破壞,成為如今對降解植物組織最為關注的技術難點。角質酶(EC3.1.1.74)是一種多功能酶,理論上可降解角質層。將角質酶用于酶解法提取杜仲葉中的活性成分,將比傳統的堿浸法帶來更大的經濟和物質效益。
鑒于目前無大規模生產角質酶的研究,國內外眾多學者對角質酶進行了大量研究,江南大學做了很多關于產角質酶發酵條件優化[15]、基因重組改良等方面研究[16],但還未見有分離可產角質酶的微生物的報道。本試驗從杜仲中分離能產角質酶的微生物,對該菌株進行鑒定,發現該菌株屬于膠紅酵母。這是首次發現酵母菌能產角質酶,而且酶活較高,可達到10 U/mL 左右。這一發現具有重大的實踐意義,因為通常高產角質酶的真菌都是植物的病原真菌,在生產角質酶進行培養時必須嚴格控制生產環境,而本研究發現的是酵母菌,可以大規模培養,不會對環境帶來危害。本試驗還對該菌產酶條件進行了優化,在優化培養條件的過程中,除了要選擇的適合菌株生長并且不會對角質酶產量造成影響的碳源和氮源外,還要選擇合適的溫度、初始pH 和適當的菌齡,要適宜菌體生長及產角質酶。本研究分別考察了發酵的碳源、氮源、溫度、時間和初始pH 值等對膠紅酵母產角質酶的影響。在選擇適當的菌齡時,一般以對數生長期的后期較為適宜,太年輕的種子接種后,往往會使發酵前期菌體生長過于緩慢,使得發酵周期延長;過老的種子雖然菌量較多,但接種后菌體會過早自溶,導致生產能力下降。所以本研究通過測定菌種的生長曲線,得出將該菌活化1 d 后的種子液接入發酵培養基培養,以保證產酶量。
由于膠紅酵母比植物病原真菌更安全,因此可廣泛用于角質酶制劑的生產,可以繼續進行菌株的誘變研究,進一步提高該酵母的角質酶產量。
4 結論
在本試驗將病變的杜仲葉分離所得的3 株菌中,分離1 號菌產角質酶量最高,經形態觀察及菌種鑒定、序列比對、系統發育樹的構建等判定分離1 號菌為膠紅酵母(Rhodotorula mucilaginosa)。這是首次發現酵母菌產角質酶且酶活較高(10 U/mL)的菌株。對膠紅酵母產角質酶的發酵條件進行優化,確定了該菌發酵生產角質酶的最佳碳源(乳糖)、氮源(酵母粉)、最佳溫度(28℃)、時間(5 d)和初始pH 值(6.5)。
[1] 陸志科, 謝碧霞, 杜紅巖.杜仲膠提取方法的研究[J].福建林學院學報, 2004, 4:353-356.
[2] 宮本紅.杜仲葉多糖的提取分離及生物活性研究[D].貴陽:貴州大學, 2008.
[3] 龔桂珍, 宮本紅, 張學俊, 等.杜仲葉和杜仲皮中化學成分的比較[J]. 西南大學學報:自然科學版, 2010, 7:167-172.
[4] 宋磊, 張學俊, 董大鵬, 王慶輝.杜仲膠性質及提取研究的進展[J].貴州化工, 2006, 4:4-8.
[5] Zhang X, Cheng C, Zhang M, et al. Effect of alkali and enzymatic pretreatments of Eucommia ulmoides leaves and barks on the extraction of gutta percha[J]. J Agric Food Chem, 2008, 56(19):8936-8943.
[6] 張守亮, 陳堅.角質酶產生菌Thermobifida fusca WSH03-11 誘變及高產突變株發酵條件優化[J].化工進展, 2006, 25(5):533-537.
[7] 張瑤, 陳晟, 吳丹, 等.角質酶及其在紡織工業中的應用[J].中國生物工程雜志, 2010, 30(9):105-109.
[8] 陳晟, 張芙華, 陳堅, 等.流加發酵對重組Bacillus subtilis 發酵生產角質酶的影響[J].中國生物工程雜志, 2010, 30(1):62.
[9] Murphy CA, Cameron JA, Huang SJ, et al. Fusarium polycaprolactone depolymerase is cutinase[J]. Applied and Environmental Microbiology, 1996, 62(2):456-460.
[10] 王義勛, 柳艷軍, 陳敏, 等.真菌角質酶研究進展[J].湖北林業科技, 2011, 4:12.
[11] 薛海燕.降解玉米秸稈產纖維素酶和木質素酶菌種的篩選[J].釀酒科技, 2008, 10:44-47.
[12] Fernandes S, Johansson G, Hatti-Kaul R. Purification of recombinant cutinase by extraction in an aqueous two-phase system facilitated by a fatty acid substrate[J]. Biotechnology and Bioengineering, 2001, 73(6):465-475.
[13] Davies KA, DELorono I, Foster SJ, et al. Evidence for a role of cutinase in pathogenicity of Pyrenopeziza brassicae on brassicas[J]. Physicl Mol Plant Pathol, 2000, 57:63-75.
[14] Dickman MB, 謝旭陽.檢驗植物病原真菌產生角質酶的一種快速而靈敏的平板分析法[J].國外農學, 植物保護, 1988, 4:17.
[15] 張芙華, 華兆哲, 陳堅, 等.溫度兩階段控制策略發酵生產重組角質酶[J].應用與環境生物學報, 2009, 15(5):730-733.
[16] 郭森.重組大腸桿菌產角質酶-CBM 發酵優化[D].無錫:江南大學, 2012.

