培養基種類對花生毛狀根株系生物量和白藜蘆醇含量的影響
姚慶收 姜吉剛 武玉永 梁乘榜
白藜蘆醇是一種天然的抗氧化劑,具有重要的藥用價值[1,2]。近年來,Ri質粒及其發根培養系統因其在次生代謝產物生產方面的優越性而被廣泛重視[3,4],并成為藥用植物可持續發展的有效途徑之一。花生中含有較高的白藜蘆醇,花生(包括根、莖、果仁)將會成為生產白藜蘆醇及與其相關醫藥、保健品的重要植物資源[5],因此利用花生毛狀根進行白藜蘆醇的生產具有現實意義。
本試驗利用發根農桿菌R1601介導,對花生葉片進行誘導,獲得毛狀根后,經PCR鑒定,選取轉染成功的生長快的毛狀根株系,利用不同培養基培養,對經培養后毛狀根的生物量和毛狀根中白藜蘆醇含量進行測定,探究不同培養基對毛狀根的生物量和白藜蘆醇含量的影響,旨在為進一步篩選并建立適宜的花生毛狀根培養體系,用于生產白藜蘆醇奠定研究基礎。
1 材料與方法
1.1 材料
1.1.1 試驗材料 發根農桿菌R1601,魯花11號,毛狀根株系。
1.1.2 主要試劑 主要試劑均為國產分析純,分子生物學試劑購自上海生工生物工程有限公司,白藜蘆醇標準品購自上海融禾醫藥科技有限公司。
1.1.3 培養基 MS、B5和N6培養基的組分參照李志勇等[6],配制的培養基pH為5.8。1/2MS培養基是在MS培養基的基礎上,大量元素、微量元素、鐵鹽、有機成分、蔗糖用量均減半,其他同MS培養基。配制加入抗生素的MS培養基,在原有MS培養基的基礎上,在培養基滅菌冷卻但未凝固時加入500mg/L的羧芐西林鈉,其他條件同MS培養基。其中1/2MS培養基為液體培養基,其它為固體培養基。
1.2 方法
1.2.1 花生毛狀根的誘導及鑒定 主要試驗過程參照文獻[7],取花生魯花11號葉片,流水沖洗30min,用4%的NaClO浸泡5-10min后,無菌水沖洗3-4次,每次5min,將葉片切成0.5cm左右,并輕輕劃上傷口,置于發根農桿菌R1601培養液(A600=0.8)中5-10min,取出外植體,置于MS培養基上培養2-3d,轉移到含500mg/L羧芐西林鈉的MS培養基上2-3d(根據發根農桿菌生長情況,可以多次進行該步驟,直至發根農桿菌被去除),置于無激素MS培養基上,誘導毛狀根。另做一份為對照,除不與發根農桿菌接觸外,其余操作均相同。誘導出毛狀根后,剪取毛狀根,移到含500mg/L羧芐青霉素的MS培養基上除菌培養,每3-5d轉接1次,直至去除發根農桿菌R1601后,繼代培養用于后續試驗。利用CTAB法提取花生毛狀根和葉片DNA,根據Ri質粒序列,設計PCR擴增引物進行PCR鑒定。
1.2.2 毛狀根的繼代培養 選取一株經PCR鑒定的優良的花生毛狀根繼代培養,擴繁,并作為培養株系用于生物量和白藜蘆醇含量的測定。每瓶加入80mL MS培養基(培養瓶為ZP16-340廣口瓶,上海稼豐園藝用品有限公司生產)。具體培養條件為MS培養基、B5培養基、N6培養基和MS+500mg/mL培養基為固體,培養條件為26℃,光照條件為2000 lx,12h/d光照,培養,1/2MS培養基為液體培養基,培養條件為26℃,160r/min,暗黑條件。
1.2.3 毛狀根生物量測定 將培養4周的毛狀根進行生物量(生物量=收獲量-接種量)的測定,將毛狀根團塊中所含的培養基去掉,用水洗凈晾干,稱鮮重,對不同培養基培養的毛狀根株系的生物量進行統計分析。
1.2.4 毛狀根中白藜蘆醇含量的測定
1.2.4.1 白藜蘆醇的提取 對不同培養基上收獲的毛狀根,于60℃烘干,將同一培養基收獲的毛狀根混合,隨機分為3組,按照文獻[8]中超聲波提取法對不同培養基培養的毛狀根進行白藜蘆醇的提取,作為測試樣品備用。
1.2.4.2 對照品溶液和測試樣品溶液的制備 精密稱取白藜蘆醇對照品5mg,于25mL棕色容量瓶中,用甲醇溶解并稀釋至刻度,搖勻,即得到0.20mg/mL的對照品溶液,備用。
1.2.4.3 樣品中白藜蘆醇含量的測定 色譜條件和標準曲線的繪制按照文獻[8]進行,繪制得到回歸方程。然后測定待測溶液的峰面積并將此值帶入回歸方程求得待測溶液中白藜蘆醇的含量。
1.2.5 不同培養基毛狀根中白藜蘆醇總量 設定同一培養基毛狀根中白藜蘆醇總量=毛狀根生物量(干重總量)×毛狀根中白藜蘆醇含量,計算不同培養基中毛狀根中白藜蘆醇的總量(以每種培養基接種相同瓶數為基礎)。
2 結果
2.1 花生葉片毛狀根的誘導及PCR鑒定
用發根農桿菌R1601侵染花生的葉片,1周左右感染發根農桿菌的花生葉片在傷口部位出現白色突起,2周左右分化為白色細根(圖1),生長速度快,生根密度大。
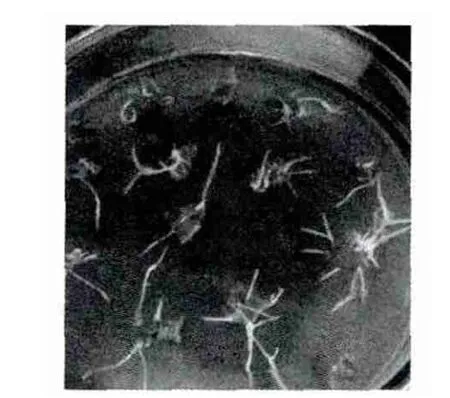
圖1 花生葉片誘導的毛狀根
通過設計rolB基因的特異引物,進行PCR擴增,如圖2中1、2、5、6泳道所示,能夠以葉片誘導的毛狀根的DNA為模板擴增到預期的條帶(865bp),說明所獲得的毛狀根為發根農桿菌誘導的遺傳轉化體,可以用于繼代培養。
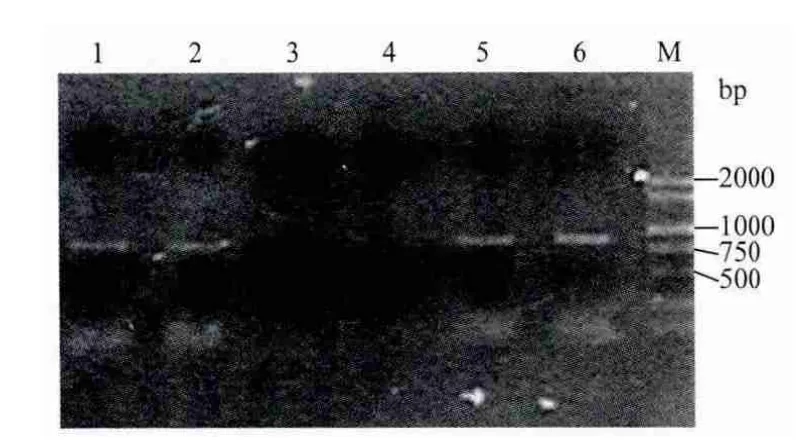
圖2 毛狀根PCR檢測電泳圖
2.2 花生毛狀根繼代培養
固體培養基中,在相同時間內,MS培養基中的花生毛狀根克隆系生長快,生長勢強,根呈乳白色,不發生褐化現象,較少出現表皮褐化(圖3),大約經過4周左右即可長滿培養基。加入500mg/mL的MS固體培養基中的花生毛狀根生長慢,在3周后根尖開始出現老化,表皮褐化,4周左右不能長滿培養基,抗生素有效抑制雜菌,很少發生污染,但對毛狀根的生長有抑制作用,形態上與MS培養基中的毛狀根也略有區別,主干根段變粗,顏色略黃(圖4)。B5和N6培養基中的花生毛狀根生長勢弱,生長慢,外部形態縮短變粗現象比加抗生素的MS培養基明顯,隨著生長表皮褐化,4周左右也不能長滿培養基(圖5)。
1/2MS培養基是液體培養基,生長速度快,外部形態生長正常,無縮短變粗現象,但表皮褐化較快,只有根尖保持乳白色,4周時已經能夠長滿培養液(圖 6)。
由于固體和液體培養基中,生長最快的經過4周左右即可長滿培養基,故選取4周的毛狀根進行生物量和白藜蘆醇的測定。

圖3 MS固體培養基培養的毛狀根
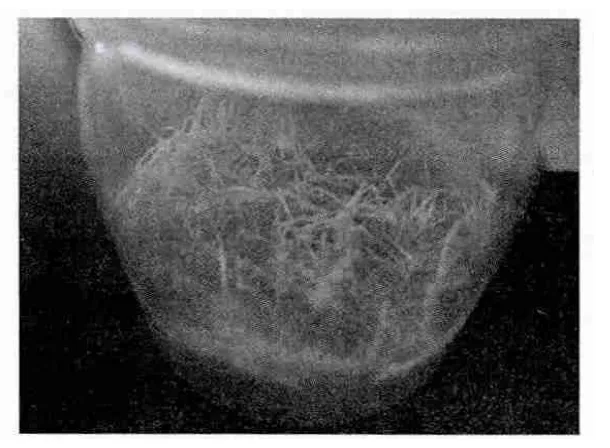
圖4 MS+500mg/mL羧芐西林鈉固體培養基培養的毛狀根
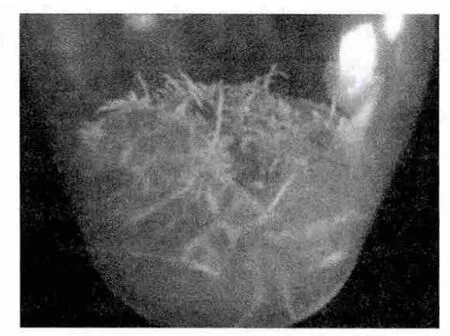
圖5 N6固體培養基培養的毛狀根
圖6 1/2MS液體培養基培養的毛狀根
2.3 不同培養基中毛狀根生物量測定
選取4周的毛狀根進行生物量測定,不同培養基之間的生物量如表1所示。
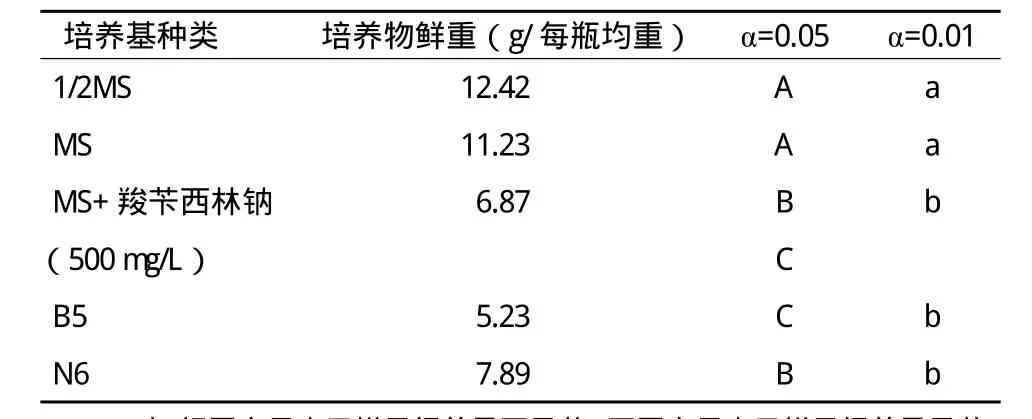
表1 不同培養基毛狀根生物量測定及分析
對不同培養基之間的生物量進行統計分析,結果顯示,不同培養基之間生物量的變化明顯不同,4周內,1/2MS培養基和MS培養基花生毛狀根的生物量積累明顯要快;MS+羧芐西林鈉(500mg/L)、B5和N6的培養基上花生毛狀根生物量的積累慢,產量遠低于1/2MS培養基和MS培養基上的毛狀根,1/2MS培養基和MS培養基之間無差異,但與其他3種培養基差異極顯著,但MS+羧芐西林鈉(500mg/L)、B5和N6的培養基之間有差異顯著但無極顯著性差異。說明不同培養基對毛狀根生物量的積累有明顯差異,其中1/2MS培養基和MS培養基有利于毛狀根生物量的積累。
2.4 不同培養基毛狀根中白藜蘆醇含量的測定
根據不同濃度梯度的白藜蘆醇標準品得到HPLC的線性回歸方程:y=7.8×107x+6390,R2=0.9931。由HPLC測定得知白藜蘆醇在tR=5.070附近出峰。根據回歸方程得出供試樣品濃度,計算各樣品白藜蘆醇含量及SAS8.1軟件統計分析如表2所示。
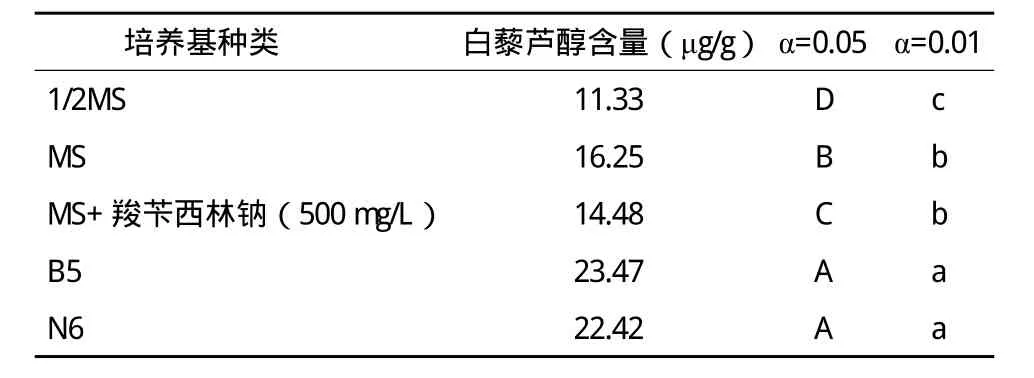
表2 不同培養基毛狀根白藜蘆醇含量測定分析
由表2可見,在不同培養基培養的毛狀根中,B5培養基中培養的毛狀根中白藜蘆醇的含量最高;1/2MS 培養基中的毛狀根中白藜蘆醇的含量最低。MS+羧芐西林鈉(500mg/L)與MS培養基中毛狀根的白藜蘆醇含量差異顯著,但無極顯著差異;B5和N6培養基中毛狀根的白藜蘆醇含量無顯著差異。說明B5和N6培養基適合于以獲得白藜蘆醇為目的的毛狀根培養。
2.5 不同培養基毛狀根中白藜蘆醇的總量
根據毛狀根中白藜蘆醇總量=毛狀根生物量(干重總量)×毛狀根中白藜蘆醇含量,計算出同一培養基中毛狀根中白藜蘆醇的總量,結果(表3)顯示,根據生物量或者白藜蘆醇含量這兩個因素中的任何一個因素的量高或量低,并不能就能確定最終收獲的白藜蘆醇的量多或量少,判定某種培養基是最適合的培養基,或者調整某種培養基,需要結合生物量和白藜蘆醇的含量共同判斷。
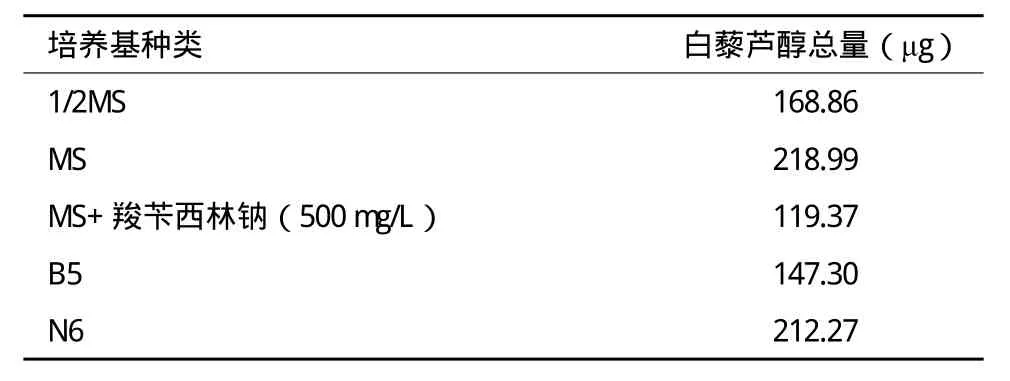
表3 不同培養基毛狀根白藜蘆醇總量
3 討論
由于毛狀根起源于單細胞,這些細胞在結構、大小、遺傳和生理生化等特征上各不相同,其代謝狀態和合成次生物質的能力也不同[9]。本試驗選取了PCR技術鑒定為轉染成功并生長旺盛的毛狀根單克隆系作為繼代培養的材料,以期為后續試驗提供一個統一的基礎條件,盡量減少試驗影響因素。
各種培養基由于所含組分及其比例不同,對毛狀根生長和次生產物的形成有不同的影響[10-16]。本試驗中選取的5種培養基的成分不盡相同,MS培養基是富集元素平衡培養基[17],成分較多,營養元素豐富;1/2MS培養基是在MS培養基基礎上不添加瓊脂粉外對各成分減半獲得,B5和N6培養基是高硝酸鉀含量培養基[17]。試驗顯示1/2MS和MS培養基有利于生物量的積累,這可能與其營養元素全面相關,毛狀根的生長是細胞不斷分裂和生長的結果,涉及的生化代謝過程特別復雜,培養基成分全面就有助于這些生化過程的進行,有助于生物量的積累。而添加了抗生素后由于抗生素的作用,生物量降低,說明羧芐西林鈉對毛狀根的生長有抑制作用。而B5和N6培養基由于屬于高硝酸鉀含量培養基,營養物質種類較MS培養基少,顯示出相同時間內生物量的積累要低,說明不同培養基對毛狀根的生物量積累是有很大影響的,進行培養基的選擇,是培養毛狀根獲得高生物量的前提。
培養基中銨態氮和硝態氮之間的比例也會影響毛狀根生長和次生代謝產物的合成[11,18]。本試驗中,B5和N6培養基最有利于白藜蘆醇量的積累,顯著優于MS和1/2MS培養基。而這可能是由于B5和N6是屬于高硝酸鉀含量培養基,硝態氮比例高,在白藜蘆醇的合成過程中有助于其中的生化代謝途徑,從而提高了毛狀根中的白藜蘆醇含量。
本試驗表明根據單一的生物量或者白藜蘆醇含量,并不能判定某種培養基是最適合的培養基,需要結合生物量和白藜蘆醇的含量共同判斷,因此生物量和白藜蘆醇含量這兩個因素為選擇或者改進培養基提供了重要的依據,也為今后的試驗研究提供了思路,今后應向尋求毛狀根生長速度與白藜蘆醇含量達到最佳結合的培養基種類探索,使之達到生產上的最大效益。
4 結論
探究了不同培養基對花生毛狀根株系生物量積累和白藜蘆醇含量的影響,表明1/2MS培養基和MS培養基有利于花生毛狀根株系生物量的積累,B5培養基和N6培養基有利于花生毛狀根株系中白藜蘆醇的積累。
[1]李延華, 王偉君, 張蘭威, 等.白藜蘆醇的研究現狀及應用前景[J].中國釀造, 2008, 184(7):10-12.
[2]Aggarwal BB, Bhardwaj A, Aggarwal RS, et al. Role of resveratrol in prevention and theraphy of cancer:preclinicaland clinical studies[J]. Anticancer Research, 2004, 24(5):2783-2840.
[3]辛萍, 王有志, 孫世芹.毛狀根培養在植物化學成分和重組藥物蛋白研究中的應用[J].時珍國醫國藥, 2012, 23(11):2750-2752.
[4]Sharma P, Padh H, Shrivastaval N. Hairy root cultures:A suitable biological system for studying secondary metabolic pathways in plants[J]. Engineering in Life Sciences, 2013, 13(1):62-75.
[5]黃紀念, 尚遂存, 方杰, 等.花生中白藜蘆醇研究開發現狀與趨勢[J].中國食物與營養, 2006(2):20-23.
[6]李志勇.細胞工程[M].北京:科學出版社, 2003:83-84.
[7]姚慶收, 武玉永, 王學全.發根農桿菌介導的花生遺傳轉化體系的建立[J].安徽農業科學, 2008, 36(35):15367-15369.
[8]姚慶收, 姜吉剛, 甘晶晶, 等.花生毛狀根及其愈傷組織中白藜蘆醇提取方法的比較[J].時珍國醫國藥, 2012, 23(1):9-10.
[9]謝靜.生物技術與藥用植物次生代謝產物[J].西南軍醫,2007, 9(3):89-90.
[10]姜伊娜, 武天龍.毛狀根的研究進展及應用[J].中國農業科技導報, 2009, 11(1):27-32.
[11]張興, 劉曉娟, 呂巧玲.毛狀根生產次生代謝產物的研究進展[J].化工進展, 2007, 26(9):1228-1232.
[12]孫際薇, 張鴻, 王鳳英, 等.茉莉酸甲酯對曼陀羅毛狀根中主要莨菪烷類生物堿成分積累和釋放的影響[J].中國中藥雜志,2013, 38(11):1712-1718.
[13]張璞, 王芳, 朱查山.真菌誘導子與吸附樹脂對新疆紫草毛狀根中萘醌積累的影響[J].生物工程學報, 2013, 29(2):214-223.
[14]盛東峰, 陳龍.聚乙二醇-6000脅迫對丹參毛狀根中丹參酮積累的影響[J].中草藥, 2013, 44(9):1181-1185.
[15]盛東峰, 張永亮.脫落酸處理對丹參毛狀根中丹參酮積累的影響[J].中藥材 , 2013, 36(3):354-358.
[16]王淑芳, 張仁波, 竇全麗.外界因子對粘毛黃芩毛狀根生長和黃酮類化合物合成的影響[J].河南師范大學學報:自然科學版 , 2012, 40(4):124-126.
[17]楊秀平, 劉莉麗.植物組織培養常用基本培養基的數量分析[J].西北林學院學報, 2010, 25(1):97-100.
[18]Bensaddek L, Gillet F, Saucedo JE, et al. The effect of nitrate and ammonium concentrations on growth and alkaloid accumulation of Atropa belladonna hairy roots[J]. J Biotechnol, 2001, 85(1):35-40.

