鄰苯二甲酸單丁酯致小鼠肝臟和腎臟組織的氧化損傷
劉志敏,熊 棣,曹鳳華,梅宇飛,吳 卓,楊 旭,袁均林
(華中師范大學(xué)生命科學(xué)學(xué)院 遺傳調(diào)控與整合生物學(xué)湖北省重點實驗室,湖北 武漢430079)
從20世紀(jì)30年代至今,鄰苯二甲酸酯(PAEs)主要作為增塑劑大量存在于日常生活中,主要作用是軟化塑料和增強塑料的彈性。由于此類材料不是以共價鍵與終產(chǎn)物結(jié)合,可不斷釋放至土壤、水和大氣中,造成環(huán)境污染[1-2]。鄰苯二甲酸二丁酯(dibutyl phthalate,DBP)是使用量最大、污染最嚴(yán)重的PAEs[3]。檢測尿液中PAEs的代謝物發(fā)現(xiàn),DBP的人體內(nèi)暴露水平最高[4]。由于PAEs在環(huán)境中普遍存在,其一級代謝物鄰苯二甲酸單丁酯(MBP)在一些環(huán)境中也被發(fā)現(xiàn)。研究表明,MBP生物活性更高、毒性更大,不僅對生殖、發(fā)育、體內(nèi)激素、核受體、炎癥和肥胖等方面都能產(chǎn)生影響,甚至還可以致死、致畸、致突變[5],成為PAEs毒性研究的新熱點[6-10]。
近年來,國外科學(xué)家通過測定尿液中PAEs的代謝物MBP的含量間接反映PAEs的內(nèi)接觸水平,并基于尿液樣品的易得性和檢測方法的成熟度,認(rèn)為MBP是一種較為合適的反映PAEs暴露的生物標(biāo)志物。對尿液中MBP的研究為評價PAEs在人體的暴露量及對人體健康的影響提供了重要的信息[11-13]。
作者在此對MBP引起的小鼠肝臟和腎臟組織的氧化損傷進行研究,擬為全面評價PAEs對人體健康的影響提供更豐富的信息,也為全面了解PAEs毒性提供依據(jù)。
1 實驗
1.1 材料、試劑與儀器
SPF級雄性BALB/c小鼠,購于湖北省預(yù)防醫(yī)學(xué)科學(xué)院動物實驗中心。
鄰苯二甲酸單丁酯(純度≥98.5%)、DCFH-DA熒光染料(純度>99.9%),Sigma公司;硫代巴比妥酸(TBA)、5,5′-二硫代二硝基苯甲酸(DTNB),分析純,國藥集團化學(xué)試劑有限公司。
5415R型低溫冷凍離心機,德國Eppendorf公司;MS1Minishaker型渦旋儀,德國IKA公司;FLx800型熒光酶標(biāo)儀,美國Bio-Tek儀器有限公司;DNM-9602型酶標(biāo)分析儀,北京普朗新技術(shù)有限公司;JN-3200DT型超聲處理器,寧波江南儀器廠。
1.2 動物分組和染毒
對42只4周齡SPF級雄性BALB/c小鼠先進行1周的實驗室環(huán)境飼養(yǎng),1周后隨機分為7組,每組6只:空白對照組,溶劑對照組,25mg·kg-1MBP染毒組,50mg·kg-1MBP染毒組,100mg·kg-1MBP染毒組,200mg·kg-1MBP染毒組,100mg·kg-1DBP染毒組。MBP、DBP均用金龍魚調(diào)和油進行配制,每天定時對小鼠給予0.005mL·(g體重)-1灌胃1次,染毒14d。溶劑對照組以等體積的金龍魚調(diào)和油進行灌胃,染毒期間小鼠均可自由進水、進食。
1.3 染毒期間小鼠體征的觀察
觀察并記錄染毒期間7組小鼠的體征變化,并記錄染毒期間7組小鼠的平均體重。
1.4 肝臟、腎臟組織切片觀察
染毒結(jié)束后,取小鼠部分肝臟和一側(cè)的腎臟,用10%的甲醛固定,脫水,透明,浸蠟,包埋,切片,HE染色,在顯微鏡下觀察組織的病理學(xué)變化。
1.5 組織勻漿液的制備
分別快速取出小鼠肝、腎,先用冰冷的PBS緩沖溶液漂洗,然后稱取適量,加入10BV的PBS緩沖溶液(pH=7.5)制成質(zhì)量分?jǐn)?shù)為10%的勻漿液,低溫離心后取上清液,用于活性氧(ROS)、還原性谷胱甘肽(GSH)和丙二醛(MDA)含量的測定。
1.6 ROS含量的測定
參照Crow[10]的方法并稍加改進。分別取小鼠肝臟和腎臟組織勻漿上清液2μL,加入198μL PBS緩沖溶液稀釋100倍;取100μL排列于酶標(biāo)板中,然后加入100μL熒光染料染色,避光反應(yīng)5min,用熒光酶標(biāo)儀檢測,以熒光強度表征ROS含量。空白組為100μL PBS緩沖溶液加100μL熒光染料。
1.7 GSH含量的測定
參照Anderson[14]方法并稍加改進。分別取小鼠肝臟和腎臟組織勻漿上清液200μL,加入有機溶劑(V氯仿∶V正丁醇=4∶1)1mL,用渦旋儀混合均勻,在冰上靜置10min后10 000×g離心5min;在不破壞蛋白層的情況下取上清液50μL加入酶標(biāo)板,加150μL濃度為60ng·mL-1的DTNB,室溫下避光反應(yīng)5 min,測其在412nm處的吸光值(OD412)。空白組為50mL PBS緩沖溶液加150μL DTNB。
1.8 MDA含量的測定
參照Draper等[15]方法并稍加改進。分別取500 μL肝臟和腎臟組織勻漿上清液于試管中,加入2mL 0.6%TBA,沸水浴15min;取上清液1mL于EP管中,10 000×g離心5min;取上清液100μL于酶標(biāo)板中排列,用全波長酶標(biāo)儀檢測,分別在450nm、532nm和600nm波長下測定吸光值(以加PBS緩沖溶液的空白組為對照)。按公式c=6.45(OD532-OD600)-0.56OD450計算MDA的含量。
1.9 統(tǒng)計分析
數(shù)據(jù)采用Origin6.1統(tǒng)計軟件進行檢驗處理,比較染毒組與對照組測量值的差異:P<0.05為差異顯著,P<0.01為差異極顯著。
2 結(jié)果與討論
2.1 染毒期間小鼠體征的變化
實驗發(fā)現(xiàn):染毒前2d,各實驗組小鼠進食、進水正常,無中毒癥狀及體征變化;染毒后第3~15d,與對照組相比,各染毒組存活小鼠依據(jù)染毒劑量的高低分別出現(xiàn)不同程度的中毒癥狀如輕微精神不振、行動遲緩、食欲下降、皮毛無光澤等,低劑量組小鼠體重總體仍呈上升趨勢,而100mg·kg-1MBP、200mg·kg-1MBP和100mg·kg-1DBP染毒組體重均呈下降趨勢,且最高劑量染毒組體重下降最為明顯,體重相差最大的一只小鼠從染毒第1d的31.07g下降到第14d的24.36g,且皮毛呈炸起狀,身體發(fā)青,在每天換墊料與清洗鼠籠的情況下,皮毛仍為濕漉狀態(tài)且局部粘連,并伴有刺激味道。
小鼠在接觸MBP過程中所出現(xiàn)的中毒癥狀隨著染毒劑量的增加越來越明顯,說明MBP引起了小鼠不同程度的機體損傷。
2.2 小鼠肝臟組織切片觀察(圖1)
染毒14d后,在顯微鏡下觀察經(jīng)HE染色的小鼠肝臟組織細(xì)胞時發(fā)現(xiàn),肝細(xì)胞的損傷程度與染毒劑量水平呈明顯的劑量-效應(yīng)關(guān)系,200mg·kg-1MBP染毒組小鼠肝細(xì)胞病變最為明顯。
由圖1可看出:對照組的肝細(xì)胞以中央靜脈為中心向外呈輻射狀排列,肝竇狀隙規(guī)則分布(圖1a、b);100mg·kg-1MBP染毒組(圖1e)和200mg·kg-1MBP染毒組(圖1f)部分肝細(xì)胞水腫、細(xì)胞核固縮、破裂、水解、胞漿空亮、核消失、空泡樣變、脂肪滴增大融合、局部細(xì)胞嚴(yán)重壞死,說明肝細(xì)胞存在嚴(yán)重的氧化損傷;25mg·kg-1MBP染毒組(圖1c)和50mg·kg-1MBP染毒組(圖1d)肝細(xì)胞質(zhì)地相對均勻,局部伴隨輕微炎癥細(xì)胞浸潤、細(xì)胞核輕微固縮、局部胞漿空亮和局部細(xì)胞腫大等癥狀。
相關(guān)研究表明MBP在體內(nèi)的生物活性并不降低,故本實驗另設(shè)染毒組DBP,與相同劑量的MBP染毒組比較氧化損傷程度。與100mg·kg-1MBP染毒組(圖1e)比較,100mg·kg-1DBP染毒組(圖1g)出現(xiàn)了明顯的細(xì)胞水腫和細(xì)胞核固縮,但100mg·kg-1MBP染毒組細(xì)胞核固縮、細(xì)胞水腫、空泡樣變等癥狀比100mg·kg-1DBP染毒組嚴(yán)重。

圖1 不同處理組對小鼠肝臟的病理組織學(xué)影響(HE×200)Fig.1 Effects of different treatment groups on the histopathology of mice liver(HE×200)
2.3 小鼠腎臟組織切片觀察(圖2)
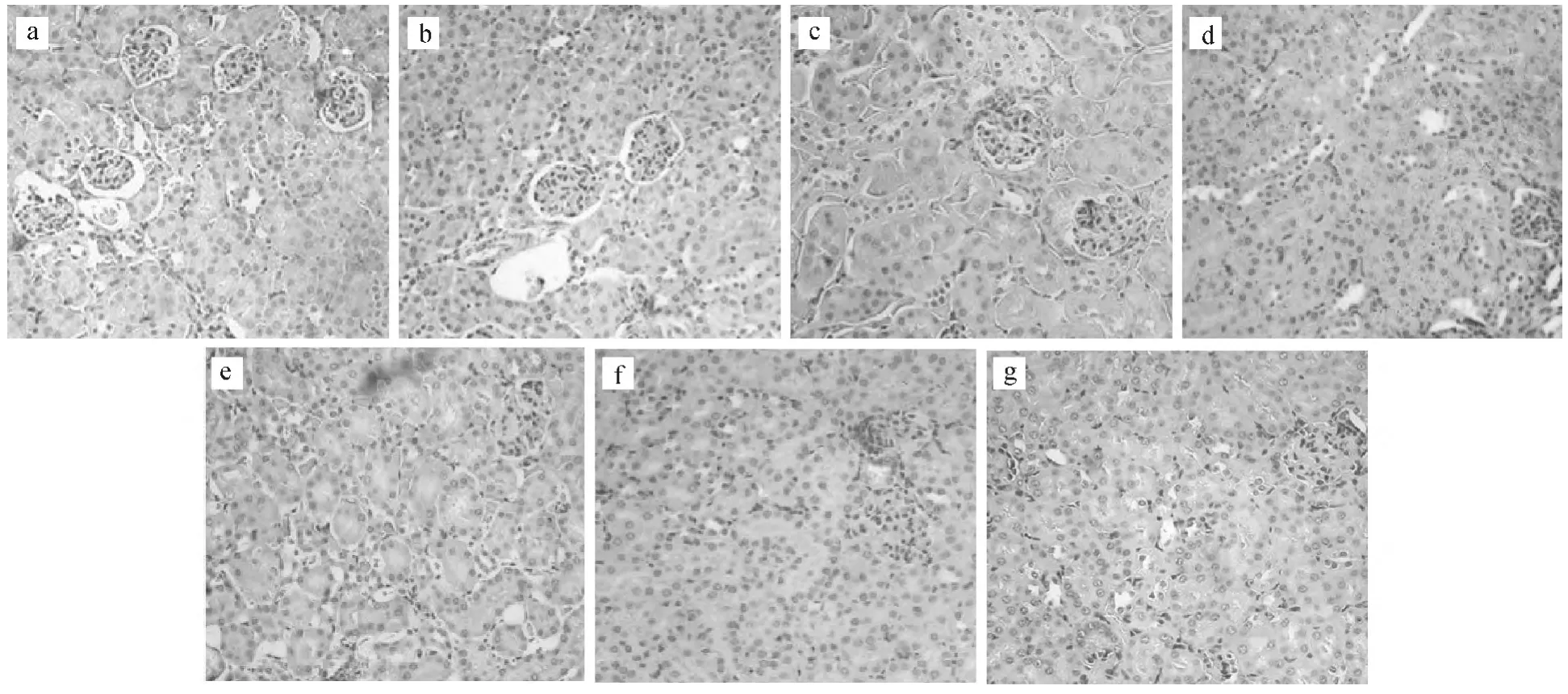
圖2 不同處理組對小鼠腎臟的病理組織學(xué)影響(HE×200)Fig.2 Effects of different treatment groups on the histopathology of mice kidney(HE×200)
在顯微鏡下觀察經(jīng)HE染色的腎臟組織細(xì)胞時發(fā)現(xiàn),與肝臟組織細(xì)胞相比,腎臟組織細(xì)胞只發(fā)生輕微的變化,小鼠腎臟組織損傷程度與染毒劑量水平無明顯的劑量-效應(yīng)關(guān)系。
由圖2可以看出,100mg·kg-1MBP染毒組(圖2e)和200mg·kg-1MBP染毒組(圖2f)與對照組(圖2a)比較,出現(xiàn)了局部腎小管上皮細(xì)胞脫落于管腔、水樣變性等癥狀,但小鼠腎臟病理切片可見腎皮質(zhì)和髓質(zhì)結(jié)構(gòu)清晰,系膜區(qū)無增生及沉積物,基底膜未見病變;隨著染毒劑量的增加,出現(xiàn)了腎小體數(shù)目減少、腎小囊管腔變窄、淋巴細(xì)胞浸潤程度增大等癥狀。
100mg·kg-1MBP染毒組(圖2e)和100mg·kg-1DBP染毒組(圖2g)相比沒有明顯差別,但與對照組相比,細(xì)胞腎小囊管腔均變窄,出現(xiàn)炎癥細(xì)胞浸潤等癥狀。
2.4 小鼠肝臟和腎臟組織中ROS含量的變化
小鼠經(jīng)不同處理后,肝臟和腎臟組織中ROS含量的變化如圖3所示。
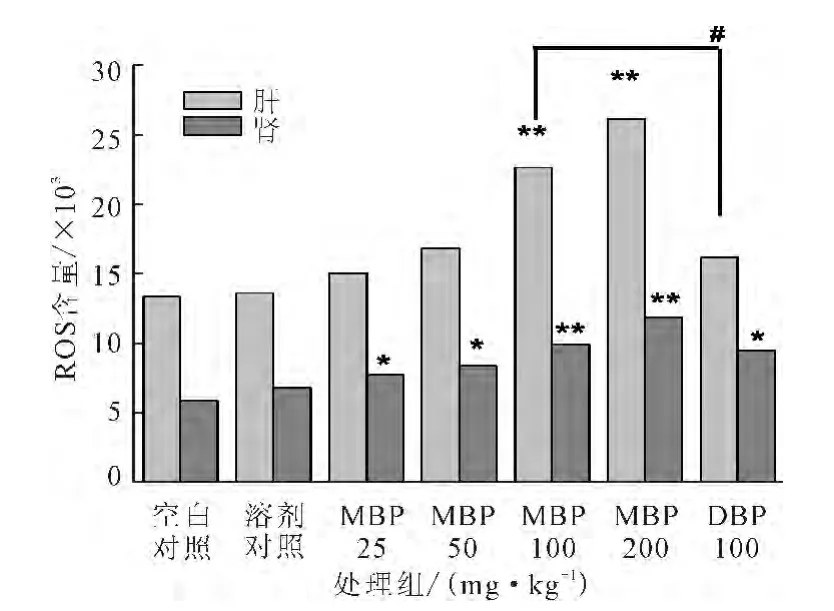
圖3 不同處理組對小鼠肝臟和腎臟組織ROS含量的影響Fig.3 Effects of different treatment groups on ROS content in liver and kidney of mice
由圖3可知:(1)MBP劑量為25mg·kg-1和50 mg·kg-1時,染毒組肝臟組織ROS含量與對照組無顯著性差異(P>0.05);劑量為100mg·kg-1和200 mg·kg-1時,染毒組肝臟組織ROS含量與對照組有極顯著性差異(P<0.01)。表明染毒劑量≥100mg·kg-1時MBP可致小鼠肝臟組織ROS含量上升;(2)MBP劑量為25mg·kg-1和50mg·kg-1時,染毒組腎臟組織ROS含量與對照組有顯著性差異(P<0.05);劑量為100mg·kg-1和200mg·kg-1時,染毒組腎臟組織ROS含量與對照組有極顯著性差異(P<0.01)。表明染毒劑量≥25mg·kg-1時MBP可致小鼠腎臟組織ROS含量上升;(3)相同劑量的MBP和DBP染毒組相比,MBP染毒組肝臟組織ROS含量顯著高于DBP染毒組(P<0.05),MBP染毒組腎臟組織ROS含量略高于DBP染毒組,但無顯著差異(P>0.05)。
2.5 小鼠肝臟和腎臟組織中GSH含量的變化
小鼠經(jīng)不同處理后,肝臟和腎臟組織中GSH含量的變化如圖4所示。

圖4 不同處理組對小鼠肝臟和腎臟組織GSH含量的影響Fig.4 Effects of different treatment groups on GSH content in liver and kidney of mice
由圖4可知:(1)MBP劑量為25mg·kg-1、50 mg·kg-1、100mg·kg-1和200mg·kg-1時,染毒組肝臟組織GSH含量與對照組均有極顯著性差異(P<0.01)。表明染毒劑量≥25mg·kg-1時MBP可致小鼠肝臟組織GSH含量下降;(2)MBP劑量達(dá)到100 mg·kg-1時,染毒組腎臟組織GSH含量與對照組出現(xiàn)顯著性差異(P<0.05);劑量增加到200mg·kg-1時,染毒組腎臟組織GSH含量與對照組出現(xiàn)極顯著性差異(P<0.01)。表明染毒劑量≥100mg·kg-1時MBP可致小鼠腎臟組織GSH含量下降;(3)相同濃度的MBP和DBP染毒組相比,肝臟和腎臟組織GSH含量均無顯著性差異(P>0.05)。
2.6 小鼠肝臟和腎臟組織中MDA含量的變化
小鼠經(jīng)不同處理后,肝臟和腎臟組織MDA含量的變化如圖5所示。

圖5 不同處理組對小鼠肝臟和腎臟組織MDA含量的影響Fig.5 Effects of different treatment groups on MDA content in liver and kidney of mice
由圖5可知:(1)MBP劑量為25mg·kg-1時,染毒組肝臟組織MDA含量與對照組無顯著性差異(P>0.05);劑量為50mg·kg-1、100mg·kg-1時,染毒組肝臟組織MDA含量與對照組有顯著性差異(P<0.05);劑量為200mg·kg-1時,染毒組肝臟組織MDA含量與對照組有極顯著性差異(P<0.01)。表明染毒劑量≥50mg·kg-1時MBP可致小鼠肝臟組織MDA含量上升;(2)MBP劑量為25mg·kg-1、50 mg·kg-1和100mg·kg-1時,染毒組腎臟組織MDA含量與對照組無顯著性差異(P>0.05),劑量為200 mg·kg-1時,染毒組腎臟組織MDA含量與對照組出現(xiàn)顯著性差異(P<0.05)。表明染毒劑量≥200mg·kg-1時MBP可致小鼠腎臟組織MDA含量上升;(3)相同劑量的MBP和DBP染毒組相比,MBP染毒組肝臟和腎臟組織的MDA含量比DBP染毒組含量略高,無顯著性差異(P>0.05)。
2.7 討論
ROS是超氧陰離子自由基、過氧化氫、羥基自由基和脂質(zhì)過氧化的不穩(wěn)定中間體的統(tǒng)稱,大部分ROS超過一定濃度時會對其它生物分子產(chǎn)生不利影響[16]。MBP引起的ROS含量上升與其對肝臟和腎臟的促炎癥效應(yīng)有直接關(guān)系,因此ROS的生成和氧化應(yīng)激反應(yīng)是解釋MBP造成肝臟和腎臟炎癥的主要方式。實驗表明,在染毒劑量≥100mg·kg-1和≥25mg·kg-1時,MBP可分別導(dǎo)致小鼠肝臟和腎臟組織ROS含量上升。
除抗氧化性的酶外,GSH提供了抵抗ROS的第一道防線,不僅能清除自由基及降低過氧化氫水平,還能修復(fù)由自由基引起的生物學(xué)損傷。當(dāng)細(xì)胞GSH含量降低到一定程度時,細(xì)胞會受到不可逆損傷[17]。因此GSH的含量是反映細(xì)胞狀態(tài)的標(biāo)志之一。實驗表明,在染毒劑量≥25mg·kg-1和≥100mg·kg-1時,MBP可分別導(dǎo)致小鼠肝臟和腎臟組織GSH含量下降。可能是由于持續(xù)的MBP的氧化應(yīng)激產(chǎn)物ROS所引起,同時GSH由于去除過氧化氫而被消耗減少[18]。
研究表明,隨著自由基的增加,細(xì)胞毒性也逐漸增大。同時,自由基引起脂類的連續(xù)氧化反應(yīng)導(dǎo)致脂質(zhì)過氧化產(chǎn)物增加。MDA是較典型的脂類氧化的分解產(chǎn)物,MDA的含量可以衡量脂類氧化的程度,間接反映引起脂類氧化的活性氧水平[19]。實驗表明,在染毒劑量≥50mg·kg-1和≥200mg·kg-1時,MBP可分別導(dǎo)致小鼠肝臟和腎臟組織MDA含量上升,使小鼠肝臟和腎臟活性氧水平上升,是MBP毒性損傷的顯著性表現(xiàn)。綜上,在MBP的濃度達(dá)到一定量的情況下,小鼠肝臟和腎臟組織中可能會產(chǎn)生過量的活性氧自由基,這些自由基可以作用于生物膜,也可以作用于蛋白質(zhì)等發(fā)揮破壞作用。與先前Prasanth等[8]報道的DBP和MBP對SOD的抑制作用削弱了自由基的清除機制,引起機體氧化損傷,對身體有不利影響的結(jié)果相吻合。
相同濃度的MBP和DBP染毒組相比,除了在肝臟中的ROS含量MBP染毒組顯著高于DBP染毒組外,GSH和MDA的含量均無顯著性差異,這證明了在100mg·kg-1的濃度下MBP在體內(nèi)的生物活性并不降低,與趙雅輝等[5]的結(jié)論是一致的。
實驗還發(fā)現(xiàn),高劑量MBP染毒組有2只小鼠的肝臟和腎臟組織MDA含量在反復(fù)測量的情況下仍有明顯下降趨勢,因此推測,小鼠肝臟和腎臟組織MDA含量的變化與ROS的變化并不完全符合對應(yīng)關(guān)系,提示在導(dǎo)致組織細(xì)胞過氧化的過程中還存在其它作用機制。
3 結(jié)論
為了探究鄰苯二甲酸單丁酯(MBP)對小鼠肝臟和腎臟的氧化損傷,將42只BALB/c小鼠隨機分為7組,每組6只,分別為25mg·kg-1、50mg·kg-1、100 mg·kg-1、200mg·kg-1的4個MBP染毒組、1個100mg·kg-1的鄰苯二甲酸二丁酯(DBP)染毒組、1個空白對照組、1個溶劑對照組。染毒期間對小鼠的體征進行觀察;14d后取其肝臟和腎臟組織,制作小鼠肝臟和腎臟組織的切片,對肝臟和腎臟的組織學(xué)形態(tài)進行觀察;制作組織勻漿液用于檢測肝臟和腎臟組織細(xì)胞的ROS、GSH、MDA的含量,以了解MBP對肝臟和腎臟組織的氧化損傷作用。結(jié)果顯示:各劑量組小鼠肝細(xì)胞和腎小管上皮細(xì)胞均出現(xiàn)不同程度的細(xì)胞核固縮、細(xì)胞水腫、空泡樣變、脂肪滴增大融合等癥狀;ROS和MDA的含量與MBP的染毒劑量呈正相關(guān),GSH的含量與MBP的染毒劑量呈負(fù)相關(guān);相同劑量的DBP與MBP染毒組相比,MBP染毒組的ROS和MDA含量較高、GSH含量較低。表明,MBP的暴露與小鼠肝臟和腎臟組織的氧化損傷存在直接聯(lián)系。
[1]MENDIS-HANDAGAMA S M L C,ARIYARATNE H B S.Differentiation of the adult Leydig cell population in the postnatal testis[J].Biology Reproduction,2001,65:660-671.
[2]游海燕.Leydig細(xì)胞睪酮合成的調(diào)節(jié)[J].中國男科學(xué)雜志,2003,17(2):138-141.
[3]柯翔鴻.鄰苯二甲酸(2-乙基己基)酯對小鼠的氧化損傷和生殖毒性分子機制研究[D].武漢:華中師范大學(xué),2008.
[4]FROMME H,BOLTE G,KOCH H M,et al.Occurrence and daily variation of phthalate metabolites in the urine of an adult population[J].Int J Hyg Environ Health,2007,210(1):21-33.
[5]趙雅輝,王小逸,林興桃,等.鄰苯二甲酸酯類化合物的體內(nèi)代謝及毒性研究進展[J].環(huán)境與健康雜志,2010,(2):184-187.
[6]SUZUKI T,YAGUCHI K,SUZUKI S,et al.Monitoring of phthalic acid monoesters in river water by solid-phase extraction and GC-MS determination[J].Environ Sci Technol,2001,35(18):3757-3763.
[7]JONSSON S,EJLERTSSON J,SVENSSON B H.Behaviour of mono-and diesters of o-phthalic acid in leachates released during digestion of municipal solid waste under landfill conditions[J].Advances in Environmental Research,2003,7(2):429-440.
[8]PRASANTH G K,DIVYA L M,SADASIVAN C.Effects of mono and di(n-butyl)phthalate on superoxide dismutase[J].Toxicology,2009,262(1):38-42.
[9]HAUSER R,MEEKER J D,DUTY S,et al.Altered semen quality in relation to urinary concentrations of phthalate monoester and oxidative metabolites[J].Epidemiology,2006,17(6):682-691.
[10]CROW J P.Dichlorodihydrofluorescein and dihydrorhodamine 123are sensitive indicators of peroxynitrite in vitro:Implications for intracellular measurement of reactive nitrogen and oxygen species[J].Nitric Oxide,1997,1(2):145-157.
[11]DUTY S M,CALAFAT A M,SILVA M J,et al.The relationship between environmental exposure to phthalates and computer-aided sperm analysis motion parameters[J].J Androl,2004,25(2):293-302.
[12]BRADBURY J.UK Panics over phthalates in baby milk formula[J].The Lancet,1996,347:1541.
[13]FREDRICSSON B,MILLER L,POUSETTE A,et al.Human sperm motility is affected by plasticizers and diesel particle extracts[J].Pharmacol Toxicol,1993,72(2):128-133.
[14]ANDERSON M E.Determination of glutathione and glutathione disulfide in biological samples[J].Methods Enzymol,1985,113:548-555.
[15]DRAPER H H,HADLEY M.Malondialdehyde determination as index of lipid peroxidation[J].Methods Enzymol,1990,186:421-431.
[16]JURCZUK M,MONIUSZKO-JAKONIUK J,BRZOSKA M M.Involvement of some low-molecular thiols in the peroxidative mechanisms of lead and ethanol action on rat liver and kidney[J].Toxicology,2006,219(1-3):11-21.
[17]PASTORE A,F(xiàn)EDERICI G,BERTINI E,et al.Analysis of glutathione:Implication in redox and detoxification[J].Clin Chim Acta,2003,333(1):19-39.
[18]YADAV P,SARKAR S,BHATNAGAR D.Action of capparis decidua against alloxan-induced oxidative stress and diabetes in rat tissues[J].Pharmacol Res,1997,36:221-228.
[19]MORIEL P,PLAVNIK F L,ZANELLA M T,et al.Lipid peroxidation and antioxidants in hyperlipidemia and hypertension[J].Biol Res,2000,33(2):105-112.

