誘導HAP結晶回收污水中磷主要影響因素分析
鄒海明 呂錫武 李 婷
(1東南大學能源與環境學院,南京210096)(2安徽科技學院城建與環境學院,鳳陽233100)
基于利比希(Liebig)最小因子定律,磷是導致水體富營養化藻類(C106H263O110N16P)生長的一個重要因子,因此許多國家對其排放濃度都有著嚴格的限制.我國國家環境保護部要求城鎮污水處理廠出水排入重點流域及湖泊、水庫等封閉、半封閉水域時(如太湖、巢湖和滇池),必須執行《城鎮污水處理廠污染物排放標準》(GB18918—2002)的一級A標準.隨著磷排放標準的提高,在新建污水處理廠或舊工藝升級改造過程中,高效率低能耗的生物除磷技術的應用尤為重要.此外,自然界中磷主要以磷酸鹽和鳥糞層巖石等形式存在[1],在生物圈中單項流動且難以再生屬于不可再生的稀缺資源[2].我國磷礦資源屬于瀕危礦產,被列為2010年后不能滿足國民經濟發展需要的主要礦產之一[3].然而,生活污水中含有“較豐富”的磷(我國生活污水中的磷含量約為5~10 mg/L[4]),回收再利用潛力巨大.目前,國內外眾多學者已將研究視點從單純地去除污水中的磷轉向去除和回收磷相結合[5-7],如歐盟等國50%工業用磷來自于污水中的回收,瑞典政府要求污水中的磷75%要回收再利用,而我國結合生活污水處理工藝進行磷回收的研究尚屬于起步階段.
相比于化學沉淀法,誘導結晶技術是目前被認為最經濟有效的磷回收技術[8].為此,本課題組設計研發一套新的工藝,在前期反硝化同步脫氮除磷工藝基礎上[9]增加誘導結晶回收柱實現磷的回收,即將厭氧釋磷后的上清液通過側流經過誘導結晶柱回收部分磷,將生物強化除磷技術和誘導結晶技術充分耦合.目前主要的結晶反應器有DHV[10],CSIR[11]和Kurita[12]等,其中流化床態的反應器因其操作簡單、磷回收率高而備受關注.誘導結晶回收污水中的磷主要采用磷酸銨鎂(MAP)結晶法和羥基磷酸鈣(HAP)結晶法,MAP適用于含氮、磷濃度較高的廢水[13-14],而HAP則適用于中低濃度含磷廢水[15],且特別適合于生化強化除磷工藝厭氧池出水中磷(濃度為20 mg/L左右)的回收.當前關于污水處理與磷回收相耦合的工藝已有相關報道,如Phostrip工藝[16-17],但該方法是通過化學沉淀的方法實現磷的回收,產品品質差、含水率高且不能直接應用于實際生產,而誘導結晶法回收的磷酸鹽產品純度高、含水率低且可直接應用于工農業生產中.
此外,要使污水處理與磷回收耦合工藝能實現較好的磷回收效果,首先需分析磷回收的影響因素以及最佳的工藝參數.為此,本文采用自行設計以曝氣為動力的流態化誘導HAP結晶磷回收柱,系統分析影響HAP結晶效果的主要因素(包括反應時間、反應溫度、晶種投加量、pH值、Ca/P摩爾比和曝氣量),以期將該誘導結晶柱與前期研究的反硝化同步脫氮除磷工藝有機地耦合來實現污水中磷的去除和部分磷的回收,同時為中試裝置設計和該技術推廣應用提供參考.
1 材料與方法
1.1 工藝流程
在前期反硝化同步脫氮除磷工藝基礎上增加一個磷回收柱(見圖1(a)),將生物除磷和磷結晶回收有機地統一.本試驗采用的流態化結晶反應柱(見圖1(b))由反應區、緩沖區、沉淀區和曝氣區組成,總容積2.5 L.① 反應區.溶液中的構晶離子Ca2+,OH-和PO43-以Ca5(PO4)3OH形式結晶在晶種(方解石,粒徑約0.2 mm)上,有效容積1.4 L.② 緩沖區.口徑增大使溶液流速降低,有助于晶種沉淀.③ 沉淀區.晶種沉淀后途徑緩沖區,再次返回反應區,進一步誘導結晶除磷,上清液進入下一個處理單元.④ 曝氣區.使晶種呈流態化,與HAP結晶物充分接觸.
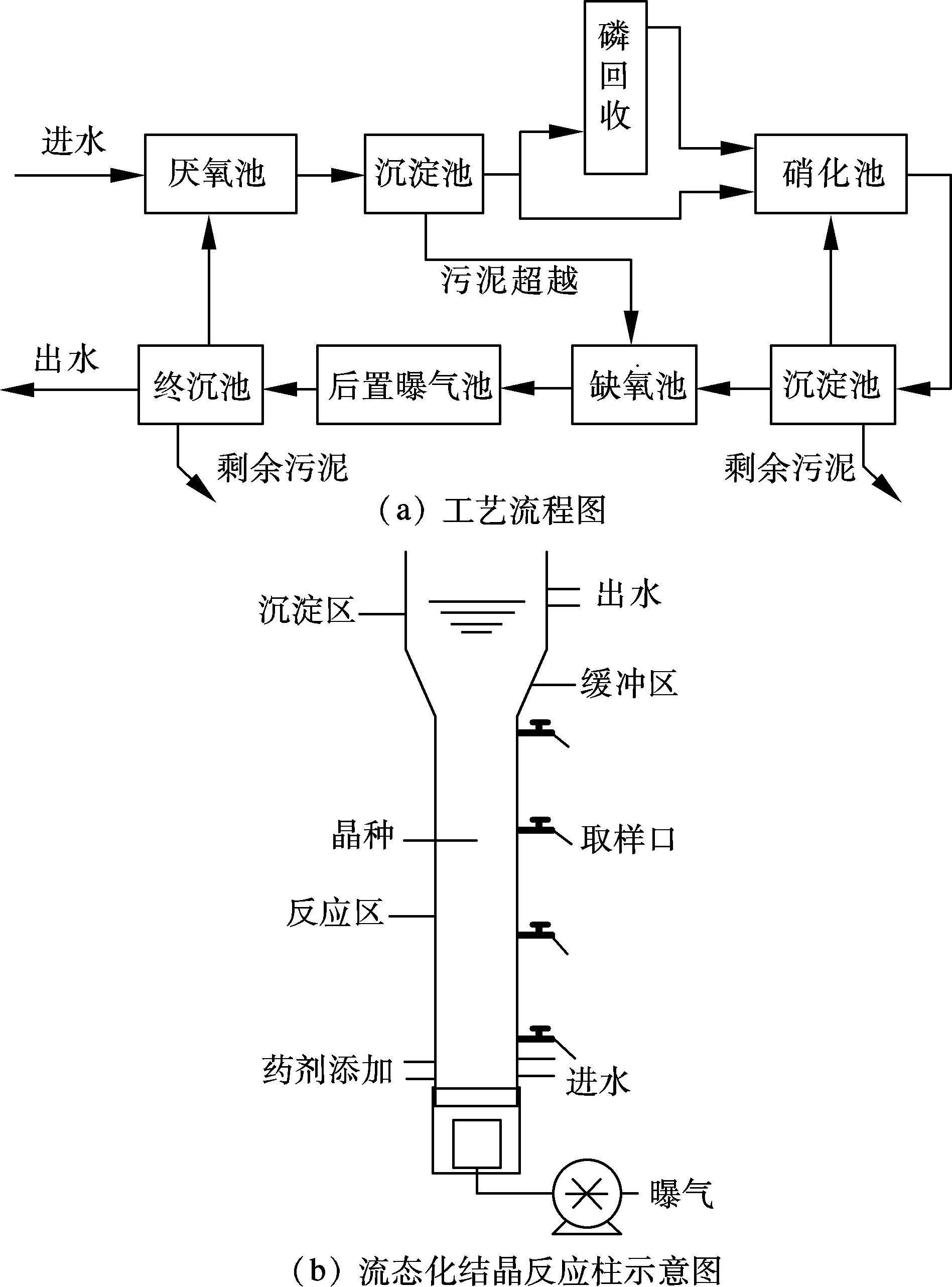
圖1 反硝化除磷-誘導結晶磷回收工藝
1.2 試驗設計
試驗中分別設計如下參數,以考察對誘導HAP結晶效果的影響:① 反應時間為10~100 min.② 反應溫度為15,25,35 ℃.③ 晶種投加量為20,40,60,80,120,140 g/L.④ pH值為3~13,7~10.⑤ Ca/P摩爾比為1.5,2.0,2.5,3.0,3.5,4.0.⑥ 曝氣量為90~780 L/h.
1.3 測定方法
采用流動分析儀(AutoAnalyzer3, SEAL, 英國)測定PO43--P;采用復合測定儀(YSI pH 100, 美國)測定pH值;采用自動恒溫控制加熱棒(佳寶3018)來控制溫度.
2 結果與分析
2.1 反應時間和溫度對HAP結晶效果的影響
在進水磷濃度為20 mg/L、pH值為8.5、晶種投加量為60 g/L、Ca/P摩爾比為2.5、曝氣量為300 L/h的條件下,考察不同反應時間(10,20,30,40,50,60,70,80,90,100 min)和不同溫度(15,25,35 ℃)對HAP結晶回收磷的影響,結果見圖2和圖3.
由反應時間和反應溫度對HAP結晶回收率的綜合影響曲面圖(見圖2)發現,反應時間對磷回收率影響較大,曲線呈弧形狀,而溫度曲面幾乎是平面,影響較小.通過誤差棒分析(見圖3(a)和(b))也可得出相類似的結果,不同溫度平均值誤差明顯小于不同時間平均值誤差,這表明該誘導結晶反應受溫度影響較小.
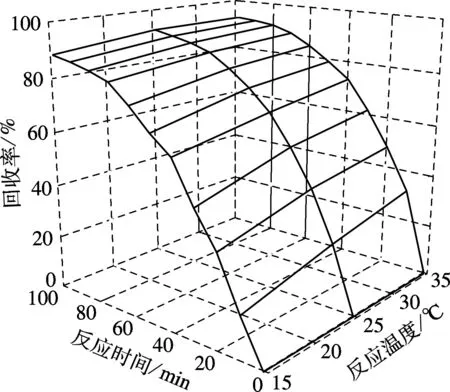
圖2 反應時間和反應溫度對HAP結晶的綜合影響
此外,通過lnC-t關系曲線(見圖3 (c))發現,不同溫度下隨時間變化的各點呈較好的線性關系,相關系數R2分別為0.991 0(15℃),0.994 6(25 ℃),0.985 0(35 ℃),表明此誘導HAP結晶回收磷反應屬于準一級反應[18],其濃度C隨時間t變化符合如下關系:

圖3 出水磷濃度隨反應時間和溫度的變化
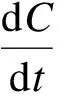
(1)
由式(1)變形得
lnC=-kt+lnC0
(2)
式中,C0為溶液初始磷濃度.因此可根據不同溫度下lnC-t擬合的關系曲線求出反應速率常數k,結果見表1.
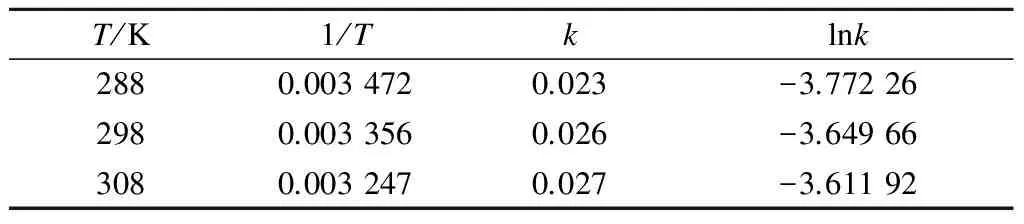
表1 不同溫度反應速率常數
根據阿侖尼烏斯(Arrhenius)公式[19](反應速率常數和溫度的關系)

(3)
式中,E為反應活化能,當E<42 kJ/mol, 表明化學反應速度很快,E>420 kJ/mol, 表明化學反應速度緩慢;R為氣體常數(8.314);T為熱力學溫度;A為常數.
通過lnk與1/T的線性回歸方程可求出活化能E,以此來判斷化學反應受溫度的影響程度.
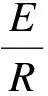
2.2 晶種投加量對HAP結晶效果的影響
在進水磷濃度為20 mg/L、pH值為8.5、Ca/P摩爾比為2.5、曝氣量為300 L/h、反應時間為100 min、室溫條件下,考察不同晶種投加量(20,40,60,80,120,140 g/L)對HAP結晶回收磷的影響,結果見表2.
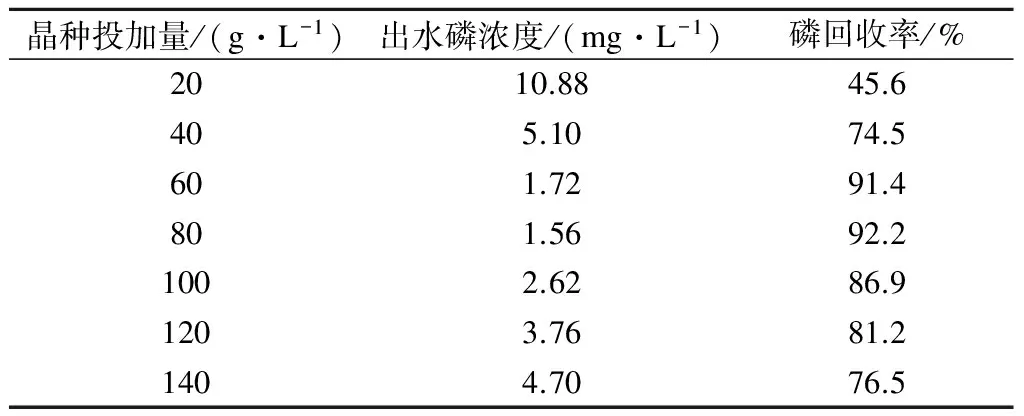
表2 晶種投加量對HAP結晶效果的影響
2.3 pH值對HAP結晶效果的影響
在進水磷濃度為20 mg/L、Ca/P摩爾比為2.5、反應時間100 min、曝氣量為300 L/h、晶種投加量為60 g/L、室溫條件下,考察不同pH值(3~13)對HAP結晶回收磷的影響,結果見圖4.
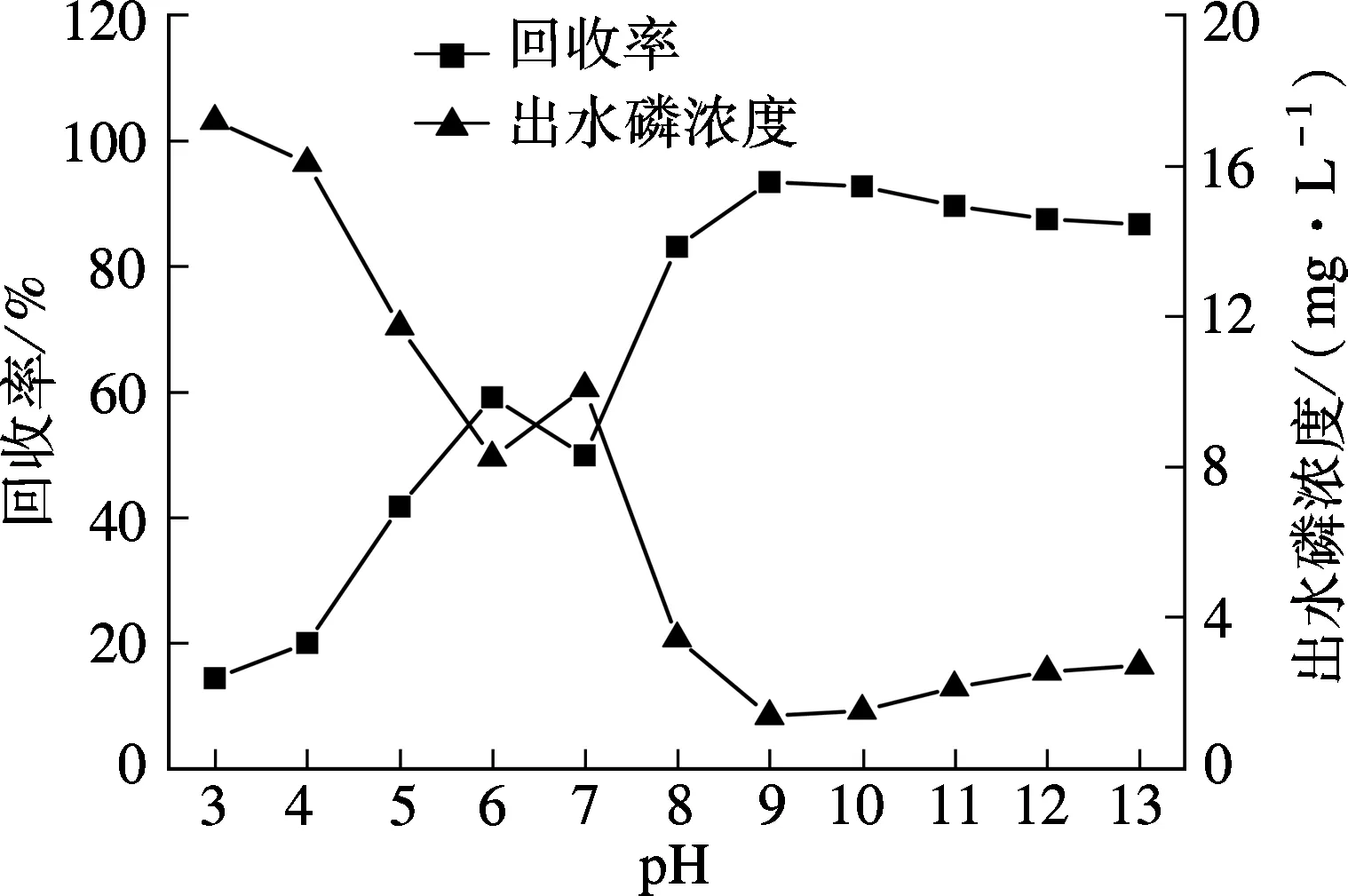
圖4 pH值對HAP結晶效果的影響
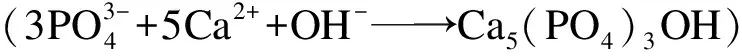
(4)
也促使了HAP結晶反應向右進行.然而,繼續增加pH值至13時,磷回收率緩慢下降至86.5%,這可能是由于溶液中OH-離子濃度的增加提高了溶液中CO3-濃度,即
(5)
為進一步研究最佳的pH值范圍,選取pH值7~10研究其對HAP結晶效果的影響(見圖4).當pH值從8.5增加至10時,磷回收率變化趨勢為:由89.7%(pH=8.5)增加到92.9%(pH=9)又降低至91.9%(pH=10),變化幅度較小.這表明利用誘導HAP結晶法回收污水中的磷,溶液pH值存在一個臨界值,當達到此臨界值時會顯著增加HAP的結晶效果.這可能是當溶液中Ca2+和PO43-離子濃度一定時,pH值達到某個臨界值,Ca2+,OH-和PO43-離子濃度積超過HAP溶度積(Ksp=55.9, 25℃),則誘導HAP結晶效果明顯增強.
2.4 Ca/P摩爾比對HAP結晶效果的影響
在進水磷濃度為20 mg/L、pH值為9、反應時間100 min、晶種投加量為60 g/L、曝氣量為300 L/h、室溫條件下,考察不同Ca/P摩爾比(1.5,2.0,2.5,3.0,3.5,4.0)對HAP結晶回收磷的影響,結果見表3.
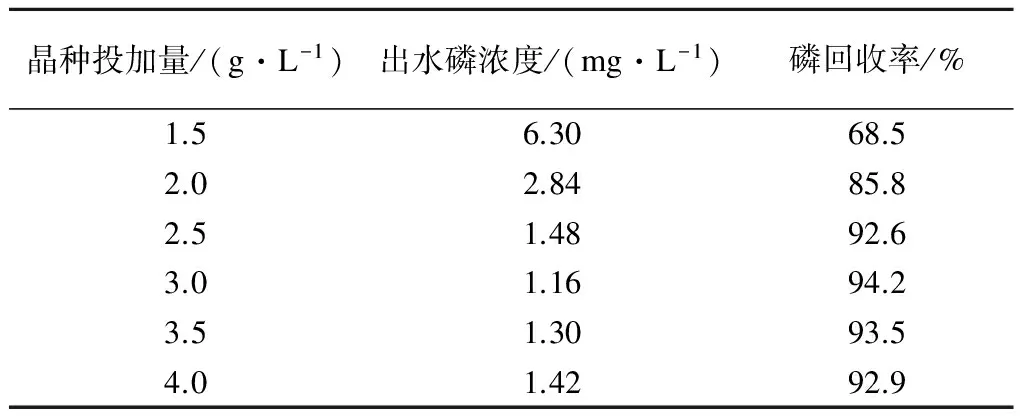
表3 Ca/P摩爾比對HAP結晶效果的影響
HAP結晶的前提是溶液中構晶離子的濃度積要大于溶度積,只要提高其中一種離子濃度就可以導致過飽和現象的發生,促使HAP結晶于晶種上.由表3可知,在進水磷濃度一定的情況下,增大Ca/P摩爾比有助于提高溶液中磷的回收率.當Ca/P摩爾比從1.5增加3.0時磷回收率由68.5%上升到94.2%,這是由于Ca2+濃度的增加使得溶液中結晶體系的過飽和度加大、結晶反應驅動力增強,促進了HAP結晶的形成.當Ca/P摩爾比為1.5時,磷回收率較低,這主要因為這個比例并不能滿足HAP組成的比例(1.67)要求,沒有足夠數量的Ca2+與溶液中PO43-結合.當Ca/P摩爾比大于2.5時,磷回收率均大于92%,且變化幅度不大.
2.5 曝氣量對HAP結晶效果的影響
在進水磷濃度為20 mg/L、pH值為9、反應時間100 min、Ca/P摩爾比2.5、晶種投加量為60 g/L、室溫條件下,考察不同曝氣量(90,120,…,780 L/h)對HAP結晶回收磷的影響,結果見圖5.
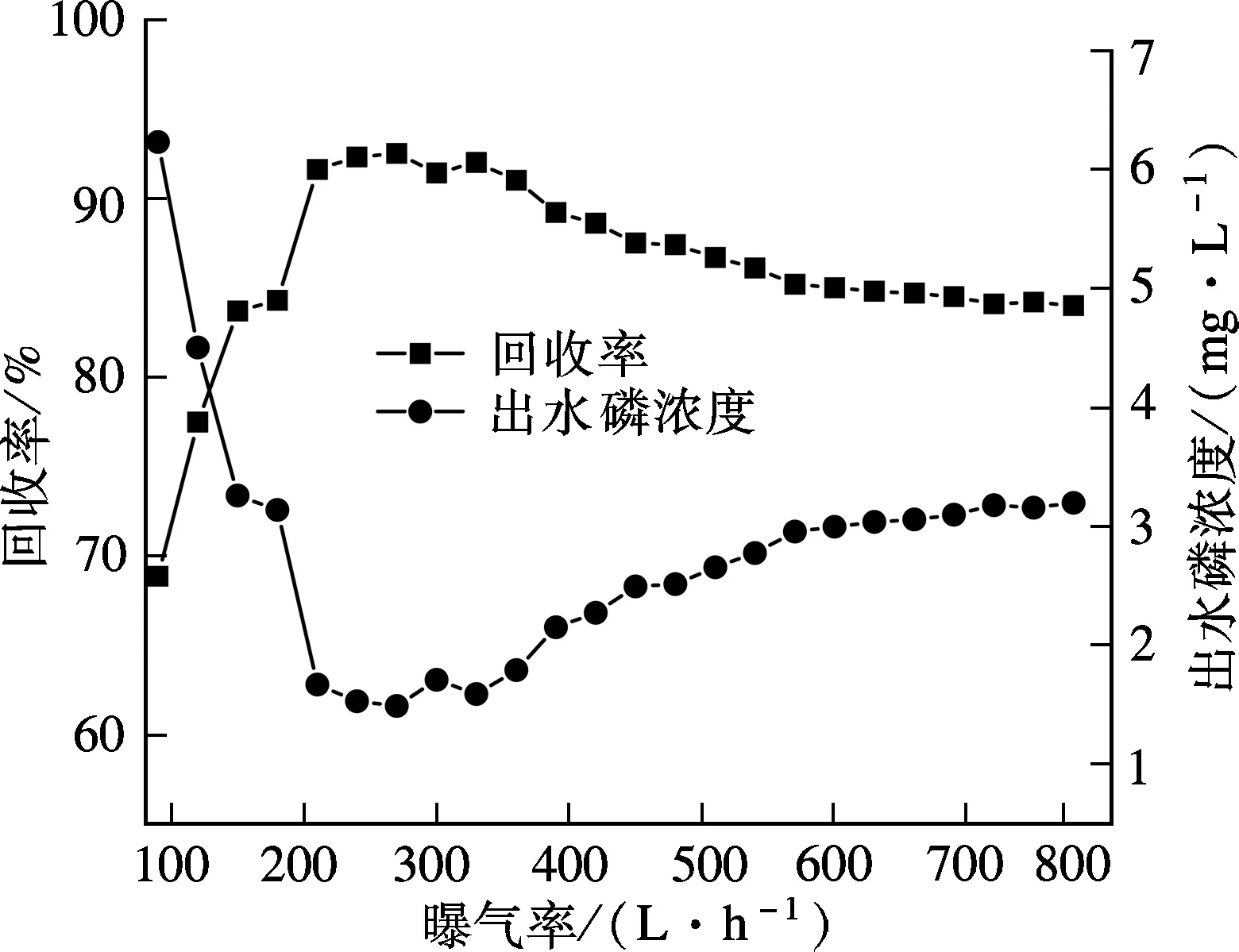
圖5 曝氣量對HAP結晶效果的影響
誘導結晶柱底部曝氣是柱內晶種和構晶離子呈流態化的主要動力,同時通過曝氣吹脫溶液中的CO2,可提高溶液的pH值,有助于HAP的結晶反應.曝氣量的大小決定了晶種及HAP晶體流態、運行形式和摩擦強度,進而影響晶核形成和生長,此外曝氣產生的液體剪切力也影響著晶體在晶種上的附著.由圖5可知,當曝氣量從90 L/h上升到780 L/h時,誘導結晶除磷量先快速上升后緩慢下降,磷回收率從68.9%增加到最大值92.5%,后又降至84.0%.當曝氣量過小時,晶種流態化程度差,構晶離子不能充分地接觸,試驗中發現此時晶種不能充滿整個反應區,表明動力不足,嚴重影響了HAP的結晶效果.而曝氣量過大(大于360 L/h)時,磷回收率低于90%且隨著曝氣量增加呈緩慢下降趨勢,這主要因為:當曝氣量過大時,水的擾動動力強,結晶柱內液體湍流加劇,晶種及其附著在晶種上的HAP晶體顆粒間摩擦力大,使得部分HAP晶體脫落隨著出水流失,降低了磷的回收效果.此外,曝氣量過大,液體剪切力增加不利于晶核的生長且有可能造成長大的晶體破碎.通過試驗發現,當曝氣量在210~360 L/h之間時,磷回收率可達到90%以上,最大值92.5%出現在曝氣量為270 L/h時.
3 結論
1) 溶液中磷濃度隨時間的變化呈準一級反應形式,反應時間為100 min時磷回收率達到最大(91.0%);誘導HAP結晶反應速度快、受溫度影響較小,其反應的活化能為5.96 kJ/mol,因而該方法增強了在實際應用中的實用性.
2) pH值對HAP誘導結晶回收磷效果影響較大,當pH>8.5時,可明顯提高溶液中的磷回收率,且在一個較寬的pH值范圍(8.5~10)內可保持較高的磷回收率(大于89.7%),這為該方法的實際應用提供了可操作性.此外,晶種投加量為60~80 g/L、Ca/P摩爾比為2.5~3.0、曝氣量為210~360 L/h時,均可獲得較高的磷回收率.
3) 當進水磷濃度為20 mg/L、pH值為9、反應時間為100 min、Ca/P摩爾比2.5、晶種投加量為60 g/L、曝氣量為270 L/h、室溫條件下,誘導結晶反應柱回收磷的比例可達92.5%.
4) 試驗證實了通過誘導HAP結晶回收污水中的磷是可行的,但本試驗采用的是模擬含磷廢水,當將該誘導結晶反應柱嵌入反硝化同步脫氮除磷工藝中時,其進水是厭氧池的上清液,需要進一步考察溶液中的有機物對HAP誘導結晶的影響.
)
[1] Kim E H, Lee D W, Hwang H K, et al. Recovery of phosphates from wastewater using converter slag: Kinetics analysis of a completely mixed phosphorus crystallization process[J].Chemosphere, 2006,63(2): 192-201.
[2] de-Bashan L E, Bashan Y. Recent advances in removing phosphorus from wastewater and its future use as fertilizer (1997—2003)[J].WaterResearch, 2004,38(19): 4222-4246.
[3] 張衛峰,馬文奇,張福鎖,等. 中國、美國、摩洛哥磷礦資源優勢及開發戰略比較分析[J]. 自然資源學報, 2005, 20(3): 378-386.
Zhang Weifeng, Ma Wenqi, Zhang Fusuo, et al. Comparative analysis of the superiority of China’s phosphate rock and development strategies with that of the United States and Morocco[J].JournalofNaturalResources, 2005,20(3): 378-386. (in Chinese)
[4] 郭杰. 誘導結晶法處理含磷廢水[D]. 長沙:湖南大學環境科學與工程學院, 2006.
[5] Cornel P, Schaum C. Phosphorus recovery from wastewater: needs, technologies and costs[J].WaterScienceandTechnology, 2009,59(6): 1069-1076.
[6] 徐微,呂錫武. 誘導結晶磷回收技術處理低濃度含磷廢水研究[J].環境科學與技術, 2011, 34(12): 119-123.
Xu Wei,Lü Xiwu. Inducing crystallization phosphorus recovery technology used in treatment of wastewater with low phosphorus concentration[J].EnvironmentalScience&Technology, 2011,34(12): 119-123. (in Chinese)
[7] Chen Xuechu, Kong Hainan, Wu Deyi, et al. Phosphate removal and recovery through crystallization of hydroxyapatite using xonotlite as seed crystal[J].JournalofEnvironmentalSciences, 2009,21(5): 575-580.
[8] Suzuki K, Tanaka Y, Kuroda K, et al. Removal and recovery of phosphorous from swine wastewater by demonstration crystallization reactor and struvite accumulation device[J].BioresourceTechnology, 2007,98(8): 1573-1578.
[9] 史靜,呂錫武,張懷玉,等. 缺氧段碳源濃度對反硝化聚磷的影響[J]. 東南大學學報:自然科學版, 2011, 41(4): 788-792.
Shi Jing, Lü Xiwu, Zhang Huaiyu, et al. Effect of carbon source concentration on denitrifying phosphorus removal under anoxic condition[J].JournalofSoutheastUniversity:NaturalScienceEdition, 2011,41(4): 788-792. (in Chinese)
[10] van Houwelingen G, Bond R, Seacord T, et al. Experiences with pellet reactor softening as pretreatment for inland desalination in the USA[J].DesalinationandWaterTreatment, 2010,13(1/2/3): 259-266.
[11] Randall D G, Nathoo J, Lewis A E. A case study for treating a reverse osmosis brine using eutectic freeze crystallization:approaching a zero waste process[J].Desalination, 2011,266(1): 256-262.
[12] Moriyama K, Kojima T, Minawa Y, et al. Development of artificial seed crystal for crystallization of calcium phosphate[J].EnvironmentalTechnology, 2001,22(11): 1245-1252.
[13] 郝曉地, 蘭荔, 王崇臣, 等. MAP沉淀法目標產物最優形成條件及分析方法[J]. 環境科學, 2009, 30(4):1120-1125.
Hao Xiaodi, Lan Li, Wang Chongchen, et al. Optimal formation conditions and analytical methods of the target product by MAP precipitation[J].EnvironmentalScience, 2009,30(4):1120-1125. (in Chinese)
[14] Carballa M, Moerman W, de Windt W, et al. Strategies to optimize phosphate removal from industrial anaerobic effluents by magnesium ammonium phosphate (MAP) production[J].JournalofChemicalTechnologyandBiotechnology, 2009,84(1): 63-68.
[16] Bl?cher C, Niewersch C, Melin T. Phosphorus recovery from sewage sludge with a hybrid process of low pressure wet oxidation and nanofiltration[J].WaterResearch, 2012,46(6): 2009-2019.
[17] Sartorius C, von Horn J, Tettenborn F. Phosphorus recovery from wastewater—expert survey on present use and future potential[J].WaterEnvironmentResearch, 2012,84(4): 313-322.
[18] Barca C, Gerente C, Meyer D, et al. Phosphate removal from synthetic and real wastewater using steel slags produced in Europe[J].WaterResearch, 2012,46(7): 2376-2384.
[19] Gutierrez O, Park D, Sharma K R, et al. Iron salts dosage for sulfide control in sewers induces chemical phosphorus removal during wastewater treatment[J].WaterResearch, 2010,44(11): 3467-3475.

