脂肪酶降解幾丁質的研究
尚利明,陳小龍
(浙江工業大學發酵工程研究所,浙江杭州 310014)
幾丁質 (Chitin)又名甲殼素,是一種由1 000~3 000個乙酰葡萄糖胺殘基通過β-1,4糖苷鏈相互連接而成的天然氨基多糖高分子聚合物[1]。幾丁質來源豐富,且有良好的生物相容、生物降解、無毒和易成膜等特性,是目前世界上唯一含陽離子的可食性動物纖維,已廣泛應用于農業、醫藥和環保等領域。由于幾丁質分子量大,具有緊密的晶體結構,分子間有較強的氫鍵作用,不溶于水和一般的有機溶劑,使其在應用方面受到很大限制。相比之下,幾丁寡糖水溶性好,易被分散和吸收,且具有誘導植物抗病性反應[2]、調控植物生長發育[3]、抗菌、抑制腫瘤生長、提高機體免疫機能、促進腸道功能、在宿主體內累積效應弱等優點,可廣泛應用于農業、醫藥和食品等領域。因此,幾丁寡糖的研究引起了國內外的重視[4]。
利用高分子量的幾丁質制備低分子量的幾丁寡糖的方法主要有化學降解和酶法降解2種。傳統的化學降解法對反應條件要求高,難以控制,且后處理繁瑣,不易得到低聚糖,尤其是在反應過程中會消耗大量的濃酸和濃堿,對環境造成嚴重污染[5-6]。酶法降解幾丁質因其具有條件溫和、易于控制、不發生副反應、無污染及產物均一性好等特點而備受關注[7]。專一性水解酶在幾丁質水解中效果明顯,但由于獲取困難且價格昂貴從而限制了其廣泛應用。因此,研究者將視線轉向來源廣、價格低、效果較好的非專一性水解酶[8]。常用的非專一性水解酶主要有纖維素酶[9]、蛋白酶[10-11]、溶菌酶[12]和脂肪酶[13]。與其他水解酶相比,目前對于脂肪酶降解幾丁質的研究較少,而脂肪酶生產成本更低。本文利用豬胰脂肪酶水解幾丁質,旨在為利用脂肪酶催化幾丁質制備幾丁寡糖提供理論依據。
1 材料與方法
1.1 脂肪酶與主要試劑
豬胰脂肪酶,北京凱泰新世紀生物技術有限公司;幾丁質,浙江金殼生物化學有限公司;3,5-二硝基水楊酸 (分析純,后同),國藥集團化學試劑有限公司;NaOH,上海試四赫維化工有限公司;酒石酸鉀鈉,上海美興化工股份有限公司;苯酚,杭州雙林化工試劑廠;亞硫酸鈉,浙江省永嘉縣化工試劑廠;乙酰氨基葡萄糖,阿拉丁。
1.2 膠體幾丁質制備
將5 g幾丁質溶于88 mL濃鹽酸中,磁力攪拌器200 r·min-1攪拌1 h后,4℃下靜置24 h,然后加入500 mL去離子水,混勻后于4 000 r·min-1下離心5 min,移去上清液,將沉淀物洗至中性,再用去離子水定容至250 mL,即成2%膠體幾丁質,在4℃下保存。
1.3 DNS配制
將3,5-二硝基水楊酸溶液1.575 g和2 mol·L-1NaOH溶液65.2 mL添加到125 mL含有46.25 g酒石酸鉀鈉的熱水溶液中,加入1.25 g結晶苯酚和1.25 g亞硫酸鈉,攪拌至溶解,冷卻后加蒸餾水定容至250 mL,儲存在棕色瓶中備用。
1.4 脂肪酶水解幾丁質酶活力測定
取脂肪酶0.03 g,2%膠體幾丁質2 mL放入25 mL具塞試管中,40℃水浴反應60 min,然后沸水浴1 min終止酶反應,10 000 r·min-1離心5 min,取1 mL上清液加入2 mL DNS,置沸水浴中反應10 min后迅速冷卻,加蒸餾水定容至10 mL,對照加滅活后的脂肪酶,540 nm測D值。根據N-乙酰氨基葡萄糖標準曲線計算出酶活力。
酶活力單位 (U):40℃下每分鐘產生相當于1 μmol N-乙酰氨基葡萄糖的還原糖量所需的酶量。
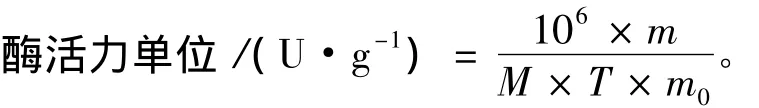
式中:m為生成的還原糖的質量 (g);M為乙酰氨基葡萄糖的分子質量 (221.21 g·mol-1);m0為酶液質量 (g);T為反應時間 (min);106為比例系數。
1.5 反應體系
反應在25 mL錐形瓶中進行,初始反應體系為膠體幾丁質溶液2 mL(2%,pH值7.4),豬胰脂肪酶0.03 g。在40℃恒溫水浴140 r·min-1搖床中反應1 h。
2 結果與分析
2.1 酶加量對酶促反應的影響
取膠體幾丁質溶液2 mL(2%,pH值7.4),分別添加0.01,0.02,0.03,0.04和0.05 g豬胰脂肪酶,40℃下水浴1 h。不同酶加量對酶促反應的影響如圖1所示。
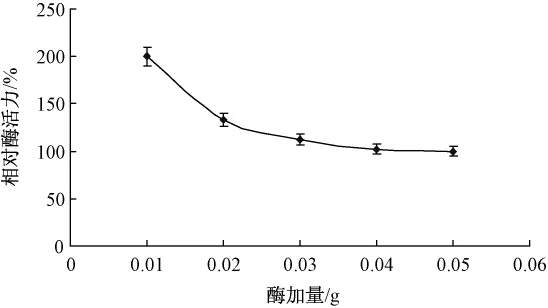
圖1 酶加量對酶促反應的影響
隨著脂肪酶添加量的增多,反應體系的粘度不斷增加,使得酶不能充分溶解于底物溶液中,活性中心不能完全暴露出來與底物充分接觸,導致酶促反應速率開始降低。綜合考慮最適酶量為0.01 g。
2.2 底物濃度對酶促反應的影響
酶加量0.01 g,分別添加濃度為1%,2%,3%,4%和5%的膠體幾丁質溶液2 mL(pH 7.4),40℃下水浴1 h。具體影響如圖2所示。
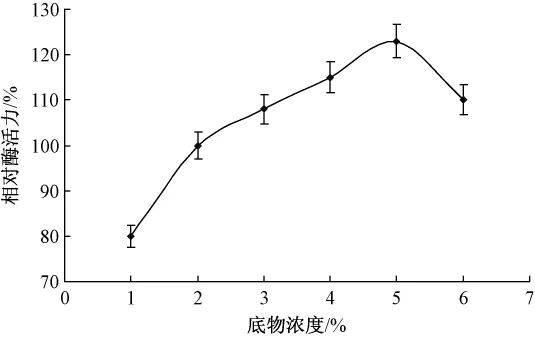
圖2 底物濃度對酶促反應的影響
隨著底物濃度的增加,酶的活性中心與底物的接觸面積逐漸增大,酶促反應速率也隨之加快。但當底物濃度超過5%時,開始限制酶促反應的進行,這是因為過高的溶液黏度會大大限制酶分子的自由移動,故最適底物濃度為5%。
2.3 溫度對酶促反應的影響
酶量0.01 g,膠體幾丁質溶液2 mL(5%,pH值7.4),分別在35℃,40℃,45℃,50℃,55℃,60℃,65℃和70℃條件下水浴1 h。不同溫度對酶促反應的影響如圖3所示。
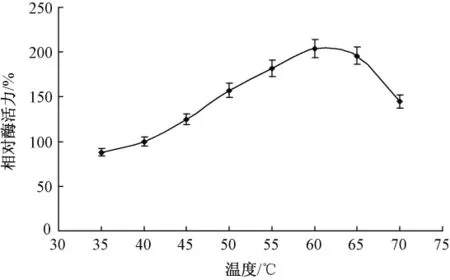
圖3 溫度對酶促反應的影響
溫度的升高使反應物分子獲得能量,使一部分原來能量較低分子變成活化分子,增加了活化分子的百分數,使得有效碰撞次數增多,故酶促反應速率加大。當然,由于溫度升高,使分子運動速率加快,單位時間內反應物分子碰撞次數增多,這也使酶促反應速率相應加快。但當溫度超過60℃后,酶促反應速度開始降低,主要原因是酶本質上是一種蛋白質,遇熱易變性。當超過其最適溫度后,隨著溫度的升高,酶促反應速度加快,但同時酶開始變性失活,從而使活性酶的濃度大為降低,因此,酶促反應最適溫度為60℃。
2.4 pH對酶促反應的影響
酶量0.01 g,5%膠體幾丁質溶液2 mL,溶液pH分別調節為6.0,6.5,7.0,7.5和8.0,60℃下水浴1 h,不同pH對酶促反應的影響如圖4所示。
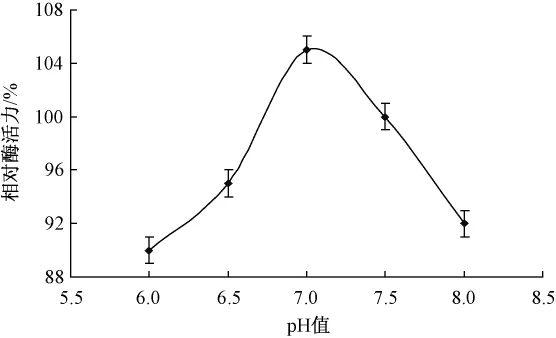
圖4 pH對酶促反應的影響
在酸性條件下,隨著pH值的升高,酶促反應速度也隨之逐漸升高;當pH超過值7.0后,酶促反應速度隨著pH值的升高開始降低,但酶活力變化不大,說明在pH值6.0~8.0范圍內,脂肪酶活力保持相對穩定,最適值pH為7.0。
pH值對酶促反應速度的影響主要表現在兩方面:一是環境過酸、過堿會影響酶蛋白的構象,使酶本身變性失活;二是pH值的改變會影響酶分子側鏈上極性基團的解離,改變其帶電狀態,從而使酶活性中心的構象發生變化。在最適pH值條件時,酶分子活性中心上的有關基團的解離狀態最適于與底物結合,表現為酶促反應達到最高。當pH值低于或高于最適pH值時,活性中心上有關基團的解離狀態發生改變,酶和底物的結合力降低,因而酶促反應速度降低。同時,pH值也能影響底物分子的解離。底物分子上某些基團只有在一定的解離狀態下才適于與酶結合發生反應。pH值的改變偏離了最適條件,則會影響這些基團的解離,使之與酶的結合能力降低,酶促反應速度也隨之減慢。因此,pH值的改變會影響酶與底物的結合,也會影響酶促反應中間產物的生成,從而影響酶促反應速度。
2.5 反應時間對轉化率的影響
酶加量0.01 g,膠體幾丁質溶液2 mL(5%,pH值7.0),60℃下反應不同時間,結果如圖5所示。隨著時間的延長,酶促反應速率逐漸降低,轉化率也在增高,當超過30 h后,酶促反應趨于停滯,轉化率也趨于穩定。原因可能是酶在長時間高溫作用下,穩定性變差,活性逐漸減弱,酶活性部位與底物的結合能力變差,導致酶促反應趨于停滯。反應30 h后,幾丁質轉化率為6%,與初始條件下相比,轉化率提高了2倍。
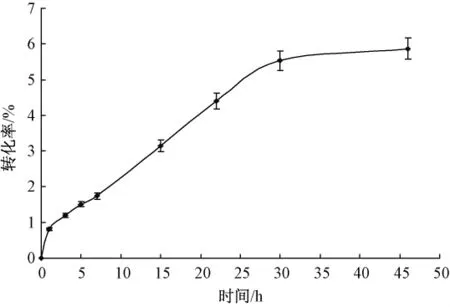
圖5 反應時間對轉化率的影響
3 小結與討論
通過對豬胰脂肪酶水解幾丁質的條件研究認為,在反應體系為2 mL,酶加量0.01 g,膠體幾丁質濃度5%,pH值7.0,60℃條件下反應30 h后,幾丁質轉化率達到最高 (6%)。為了進一步提高酶法水解幾丁質的轉化效率,可考慮采用流加廉價脂肪酶的方法。同時,作為非專一性水解酶,豬胰脂肪酶的活性中心不能與幾丁質分子完全契合,這也是導致其轉化率不高的原因之一。因此,可考慮對脂肪酶的活性中心進行改造。
同化學法降解幾丁質相比,利用脂肪酶降解幾丁質具有對環境無污染、反應條件溫和、易于操作、產物易于分離純化、脂肪酶成本低廉且可以重復利用等多重優點。因此,隨著對環境保護越來越重視,利用脂肪酶制備幾丁寡糖將具有良好的應用前景。
[1] 張燦,黃德智,李豐碩,等.海洋產幾丁質酶菌株的篩選及發酵優化 [J].吉林農業大學學報,2012,34(2):141-146.
[2] 唐勇軍,彭麗莎,鄒俊,等.幾丁質酶產生菌發酵液對水稻生長及防御酶活性的影響 [J].熱帶作物學報,2011,32(3):393-397.
[3] 徐翠蓮,楊楠,楊國玉,等.殼寡糖膦酸酯對煙草花葉病毒抗性及其機理的初步研究 [J].中國煙草學報,2012,18(1):58-1901.
[4] 喬興忠,李永嫻,湯熙翔.發酵法產酶生產幾丁寡糖的工藝研究[J].廈門大學學報,2010,49(2):251-255.
[5] Allan G G,Peyron M.Molecular weight manipulation of chitosan I:kinetics of depolymerization by nitrous acid[J].Carbohydrate Research,1995,277(2):257-272.
[6] Allan G G,Peyron M.Molecular weight manipulation of chitosan II:prediction and control of extent of depolymerization by nitrous acid [J].Carbohydrate Research,1995,277(2):273-282.
[7] Jeon Y J, Kim S K. Continuous production chitin oligosaccharides using a dual reactor system [J].Process Biochemistry,2000,35(1):623-632.
[8] Jeon Y J,Shahidi F,Kim S K.Preparation of chitin and chitosan oligomersand theirapplicationsin physiological functional foods [J].Food Reviews International,2000,16(2):159-176.
[9] Qin C Q,Zhou B,Zeng L T,et al.The physicochemical properties and antitumor activity of cellulose-treated chitosan[J].Food Chemistry,2004,84:107-115.
[10] Kumar A B,Gowda L R,Tharanathan R N.Non-specific depolymerization of chitosan by pronase and charac terization of the resultant products [J].European Journal of Biochemistry,2004,271(4):713-723.
[11] Kumar A B,Varadaraj M C,Lalitha R G,et al.Low molecular weight chitosans:preparation with the aid of papain and characterization [J].Biochimica et Biophysica Acta,2004,1670(2):137-146.
[12] Masaki A,Fukamizo T.Lysozyme catalyzed reaction of chitin oligosaccharides [J]. Journal of Biochemistry, 1981(90):527.
[13] Xia W S,Muzzarelli R A A.Depolymerization of chitosan and substuted chitosans with the aid of lipase[C].Proceedings of the second international.Wuxi:Conference on Food Science and Technology,1994:147-157.

