狗牙根與牛鞭草在三峽庫區消落帶水淹結束后的抗氧化酶活力
李兆佳,熊高明,鄧龍強,謝宗強,樊大勇,*
(1.中國科學院植物研究所植被與環境變化國家重點實驗室,北京 100093;2.中國科學院大學,北京 100049;3.湖北神農架國家級自然保護區管理局,湖北神農架 442400)
三峽水庫運行后,在庫區沿岸海拔145—175 m之間形成落差高達30 m的消落帶,原來的陸生生態系統演變為季節性濕地生態系統。生長環境的巨大變化和反季節水淹的頻繁干擾導致原有的大部分植物種類因不適應而逐漸消亡[1]。三峽水庫消落帶將面臨生物多樣性減少,污染加劇,生態系統更為脆弱等問題[2]。因此,三峽水庫消落帶植被的生態治理對維持三峽庫區生態環境的穩定具有十分重要的意義[3]。
對三峽水庫消落帶植被的生態治理首先需要研究的問題就是消落帶適宜植物的水淹耐受機理。對水淹脅迫耐受能力的強弱直接決定了植物是否適宜在消落帶環境生長。淹沒條件下,植物通過增加通氣組織、伸長生長、調節葉片形態結構等方式增強水下氣體交換和水下光合[4]。克隆植物特有的克隆整合機制并有助于整個克隆片段抵御水淹脅迫[5]。此外,水淹前的碳水化合物儲存能力[6]、水淹過程中對碳水化合物的分配[7-8]以及水淹過后積極恢復的能力[9]被認為是構成植物水淹耐受能力的重要組分。
水淹結束后積極恢復的能力有利于消落帶的多年生植物占據空間生態位,在出露周期內迅速恢復生長很可能使植株在水淹周期前儲存更多碳水化合物。多年野外調查結果發現,三峽庫區消落帶形成后狗牙根和牛鞭草是適合當地生境的多年生草本植物[1,10]。長期模擬水淹研究結果表明狗牙根和牛鞭草能夠在水淹結束后迅速恢復生長[11]。6個月水淹處理后狗牙根在15 d以內開始恢復生長,且蓋度迅速增加[12]。Luo等[13]經過30 d模擬水淹處理顯示,牛鞭草在水淹結束后10—20 d就開始恢復生長,且光合生理恢復領先于生長恢復。然而,目前是何種生理生態過程決定了恢復過程的快慢仍需要進一步的研究。
長期水淹脅迫導致無氧呼吸替代有氧呼吸、細胞內還原勢增加等一系列細胞生理狀態變化[14]。消落帶適宜物種要重新適應水淹結束后正常的生長條件,其中一個問題是水淹過后植物與空氣的重新接觸可能會導致其受到的氧化脅迫程度明顯增高[15],即使植物可以忍耐長期的水淹脅迫,但在恢復期內卻可能因為不耐受高水平氧化脅迫而死亡[16],這可能是河岸帶和消落帶植物分布的重要限制因子[17]。大量研究表明植物體內抵御氧化脅迫的體系非常完備,其中超氧化歧化酶(SOD,EC 1.15.1.1)、抗壞血酸過氧化物酶(APX,EC 1.11.1.11)、過氧化氫酶(CAT,EC1.11.1.6)是清除活性氧(ROS)、降低氧化脅迫的關鍵酶[18-19]。因此,水淹后的恢復階段,狗牙根和牛鞭草的恢復動態是否會與其體內清除ROS的SOD、APX、CAT的活性動態相關?
目前,有關三峽消落帶適宜植物的水淹耐受機理的研究大部分采用模擬水淹方式[11,13,20]。由于模擬水淹實驗不能完全對應自然狀況(自然狀況下水壓、水深、光照等條件與模擬淹水實驗條件差別很大),采用野外采樣、對比測定的手段,研究了三峽庫區消落帶生長的狗牙根和牛鞭草的根系在水淹后恢復過程中清除ROS的關鍵酶的活性動態,以期回答上述科學問題,并為消落帶人工植被恢復重建提供理論依據。
1 材料與方法
1.1 實驗地點
實驗地位于重慶市忠縣石寶鎮共和村三峽水庫消落帶(30°24′22″N,108°24′26″E)。屬暖濕亞熱帶山地氣候,溫熱寒涼,四季分明,雨量充沛,日照充足。
1.2 實驗材料
狗牙根,Cynodon dactylon(L.)Pars,禾本科多年生草本植物,具根狀莖或匍匐莖,匍匐莖節上生根及分枝;對Cu、Cd、Sb等重金屬具有較強富集能力①陶星星,兩個典型礦區植物積累重金屬調查與研究(碩士論文).2008,湖南農業大學.,可作為牧草或草坪草;在國內分布于華南、黃河流域及以南地區、長江流域及以南地區和新疆等地。
牛鞭草,Hemarthria altissima,禾本科多年生草本,有長而橫走的根莖。牛鞭草在我國分布較廣,東北、華北、華中、華南、西南各地皆有存在,多生于田地、水溝、河灘等濕潤處,常用作牧草。
兩者均具有克隆習性,能較快擴張占領生境,在長江中上游地區牛鞭草常與狗牙根等相伴而生[21]。
1.3 實驗設計
2008年3—6月劃定5 m×30 m樣地4塊,其中2塊位于海拔158 m,作為水淹及恢復處理組;另外2塊樣地位于海拔175 m,作為對照組。每個海拔的樣地按照20 cm×30 cm株行距分別移栽當地種源的狗牙根和牛鞭草,移栽后只作簡單的除雜草維護。
2009年春三峽水庫水位下降,158 m樣地出露前一天(第0天)進行第1次取樣,此后每8d②本研究取樣間隔根據參考文獻以及實地觀察結果確定:檢測水淹(或缺氧)條件下抗氧化酶活力的取樣間隔根據處理時間長短從數十分鐘到數天不等;水淹處理長達數個月的文獻報道表明植株在水淹結束后3—10d內開始恢復生長;據實地觀察,三峽庫區消落帶冬季水淹結束后,植株在1周內基本開始復蘇,在1個月內生長至正常水平取樣一次:分別在4塊樣地上各挖取植株,每塊樣地取4棵作為重復,迅速洗凈根系,吸干水分后稱取0.5—1.0 g(鮮重)根部組織放入液氮中保存,用于檢測SOD、APX、CAT酶活力。為盡力保證植物樣品一致性,減少因日間光照、溫度、水分的日變化引起的生理狀態差異,每次取樣均在清晨5:00—8:00之間進行。
根據長江水文網(http://www.cjh.com.cn)的三峽水庫忠縣水位記錄,實驗期間海拔175 m樣地水淹共0 d,海拔158 m樣地水淹共195 d。
1.4 根系取樣與粗酶提取
取樣時,把植株完整挖出,輕柔洗凈根上的土,并用蒸餾水沖洗3遍。稱取根系0.5—1 g,立即置于液氮中急凍,并于-70℃下保存,用于酶活力檢測。酶提取與活力檢測方法在Jiang和Zhang[22]基礎上作修改[23]:在預冷的研缽中放入剪碎的根系樣本,加入液氮,將樣本研磨至粉末,加入適量粗酶提取液,勻漿液4℃下以15000 g離心20 min,上清液為粗酶液。
1.5 SOD(EC 1.15.1.1)活力檢測
在盛有3 mL SOD反應混合液(預熱至25℃)的試管中,加入100 μL粗酶液。終濃度分別為50 mmol/L磷酸鉀緩沖液(pH值7.8),13 mmol/L甲硫氨酸,75 μmol/L氮藍四唑(NBT),2 μmol/L 核黃素,0.1 mmol/L EDTA-Na2。混合后放在單排透明試管架上,在光照培養箱(25℃,12000lx)內照光10 min,迅速測定OD560。以加粗酶液但不照光的反應液為空白、蒸餾水代替粗酶液的照光管做對照。以抑制反應50%的酶量為一個SOD酶活力單位。
1.6 APX(EC 1.11.1.11)活力檢測
2.5 mL APX反應混合液(預熱至20℃)中依次加入100 μL粗酶液、0.4 mL H2O2稀釋液(預熱至20℃)。終濃度分別為50 mmol/L磷酸鉀緩沖液(pH值7.0),0.1 mmol/L EDTA-Na2,0.03 mmol/L AsA(抗壞血酸,ascorbate),0.06 mmol/L H2O2。加入H2O2后立即測定0—5 min內的OD290值變化,每30 s記錄1次讀數,計算單位時間內AsA減少量(AsA比吸光系數2.8 mmol·L-1·cm-1)并計算酶活性(1個酶活定義為1U=1μmol AsA/s減少量)。蒸餾水作空白,對照用蒸餾水代替酶液。
1.7 CAT(EC 1.11.1.6)活力檢測
2.8 mL反應液(預熱至20℃)中加入200 μL粗酶液,終濃度分別為50 mmol/L磷酸鉀緩沖液(pH值7.0),10 mmol/L H2O2。混合后立即測定0—2 min內的OD240值變化,每30 s記錄1次讀數,計算單位時間內H2O2減少量(H2O2比吸光系數39.4 mmol·L-1·cm-1)及酶活性(1個酶活定義為1U=1 μmol H2O2/s減少量)。蒸餾水作空白,對照用蒸餾水代替酶液。
1.8 統計分析方法
數據的統計分析使用SPSS 16.0,采用t檢驗分析海拔175 m與158 m之間對應指標的差異顯著性;用二元相關分析方法確定指標之間的相關關系。用Origin 8.0作圖。
2 結果
長期水淹脅迫(圖1,海拔158 m,第0天)條件下,狗牙根和牛鞭草根部SOD、APX酶活力均高于對照(圖1,海拔175 m,第0天)且大部分呈顯著差異,與此相反,處理組CAT均顯著低于對照。
水淹結束后(圖1,第8天,第16天),SOD、APX酶活性均維持或上升到較高水平。狗牙根CAT稍低于對照而牛鞭草CAT上升幅度較大,但差異不顯著。
酶活力的變化反映了物種間的差異。牛鞭草SOD、APX、CAT酶活力相對值(處理/對照)均在8—16 d達最高,分別為對照的3.9倍、9.3倍、3.6倍,而狗牙根3個酶活力的變化逐漸趨向于對照值(圖1)。
盡管起始特征、恢復期變化動態各有特點,但恢復階段后期(第24天)兩個物種所有酶活力均與對照水平相近,沒有顯著差異。
相關分析表明,實驗觀察過程中3個酶活力兩兩正相關。這種相關性在很大程度上與受脅迫然后逐漸恢復的植株有關,因為若按照海拔劃分數據,相關顯著性完全集中于158 m處理組;不同物種之間則以牛鞭草根系各酶活力之間的相關性為主,狗牙根根系只有SOD-APX之間顯著相關(圖2)。
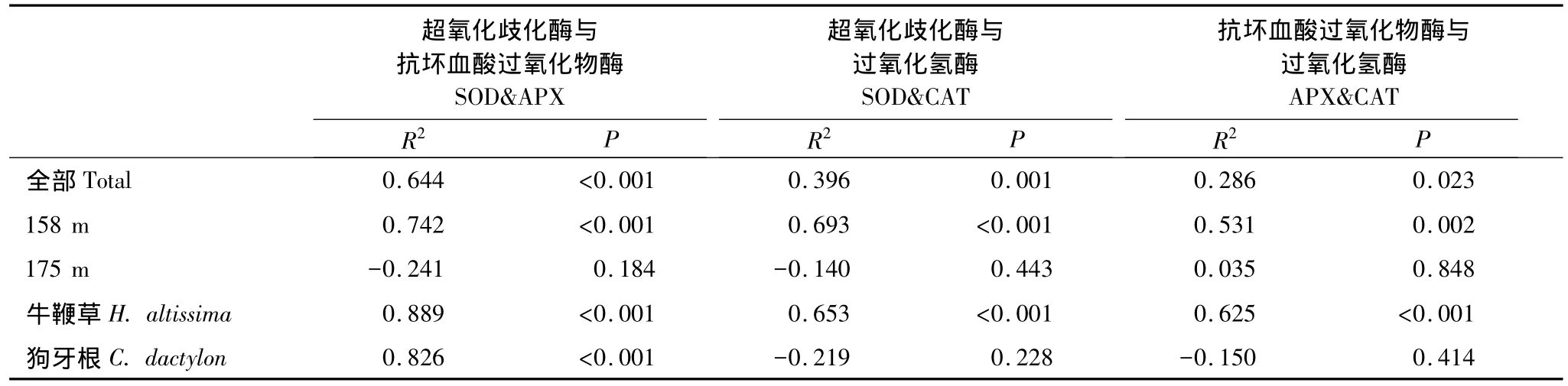
表1 基于檢測個體數據的SOD、APX、CAT酶活力Pearson相關系數及p值Table 1 Pearson correlation coefficient and p value of correlation analysis among antioxidant enzyme activities based on plant individuals
3 討論
3.1 長期水淹脅迫導致SOD、APX酶活力增強而CAT酶活力降低
長期水淹脅迫導致細胞內ROS過度積累:細胞缺氧引起的高還原勢條件下NAD(P)H/NAD(P)+循環受阻、線粒體電子傳遞鏈飽和,電子在傳遞過程中泄漏并還原氧分子[14,24]。植物體可以通過提高ROS清除酶的活力以清除過度積累的ROS,降低氧化脅迫程度[25]。長期水淹脅迫后(圖1,第0天)狗牙根、牛鞭草的根部SOD、APX活力普遍顯著高于對照。這與一些研究報道相近:復氧階段羽扇豆(Lupinus luteus L.,cv.Juno)根系SOD、CAT活力上升,但POD只受到輕微影響[26];黃菖蒲(Iris pseudacorus L.)與德國鳶尾(Iris germanica L.)在缺氧處理和恢復階段的SOD酶活性均高于對照,且耐受性越高其增加幅度越大[27];缺氧增加了小麥根系SOD在非變性凝膠電泳中的條帶數量,導致SOD總活力上升并持續至復氧階段[28]。而狗牙根與牛鞭草的根部CAT起始活力均低于對照(圖1),這可能是受到對CAT活力的抑制作用影響。這種作用在體外實驗中得到證實,因而CAT在體內條件下很可能也受影響[29]。
3.2 水淹結束后恢復期間清除ROS的關鍵酶活性發生了動態變化
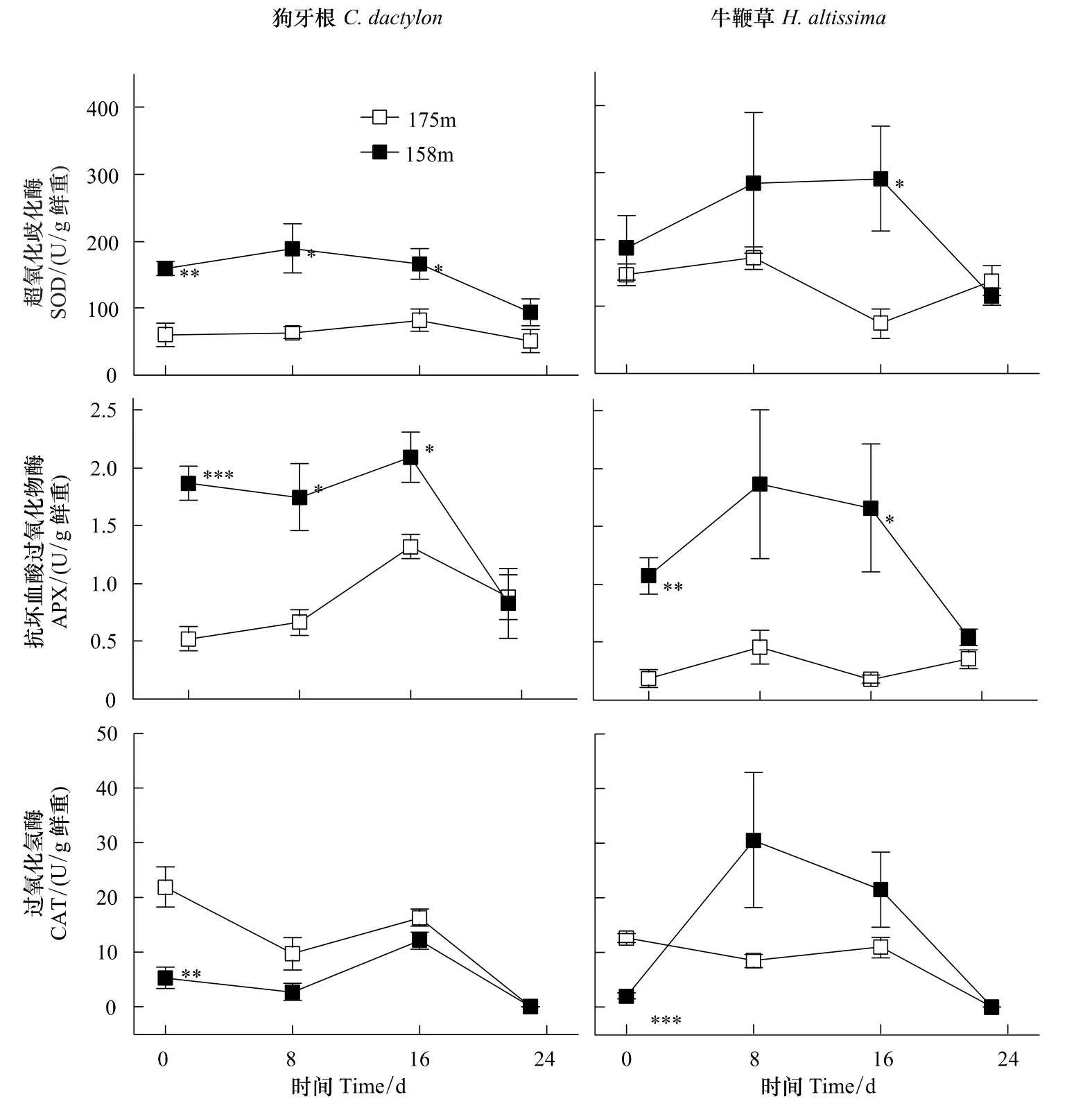
圖1 狗牙根與牛鞭草根系SOD、APX和CAT酶活力動態Fig.1 Activity dynamics of SOD,APX and CAT from roots of C.dactylon and H.altissima
Unger等[30]對土壤化學特性的研究顯示,水淹結束后土壤孔隙的O2濃度與水淹期間相比存在顯著躍升。植物體與空氣重新接觸,水淹脅迫導致的處于過還原狀態的根際和細胞環境將O2還原為[31],這將會誘導或者加重(水淹脅迫引起的)氧化脅迫[32],并誘導清除ROS的關鍵酶的活性上升[33]。研究結果表明:相對于對照,這兩個物種在恢復階段的SOD和APX均保持了較高水平(圖1,第8天,第16天),說明恢復階段確實出現了較高水平的氧化脅迫。
水淹結束一段時間后,植物根部受脅迫誘導的無氧呼吸途徑關鍵酶活力下降[34]。可以認為呼吸代謝逐漸恢復到正常的有氧代謝模式,O2重新作為電子最終受體,因而植物細胞內ROS生產水平較恢復起始階段下降,ROS清除酶活力也可能因此隨之下降(圖1,第24天)。結果表明:狗牙根和牛鞭草根部的酶活力在24 d左右完全回復至對照水平,可以認為細胞內的ROS代謝已經趨于穩定平衡,植株已基本處于未受氧化脅迫的狀態。這個結果與長期模擬水淹實驗的結果[12-13,20]吻合,說明恢復期內氧化脅迫水平與恢復生長狀態緊密相關。
3.3 恢復過程中兩個物種酶活力動態并不一致
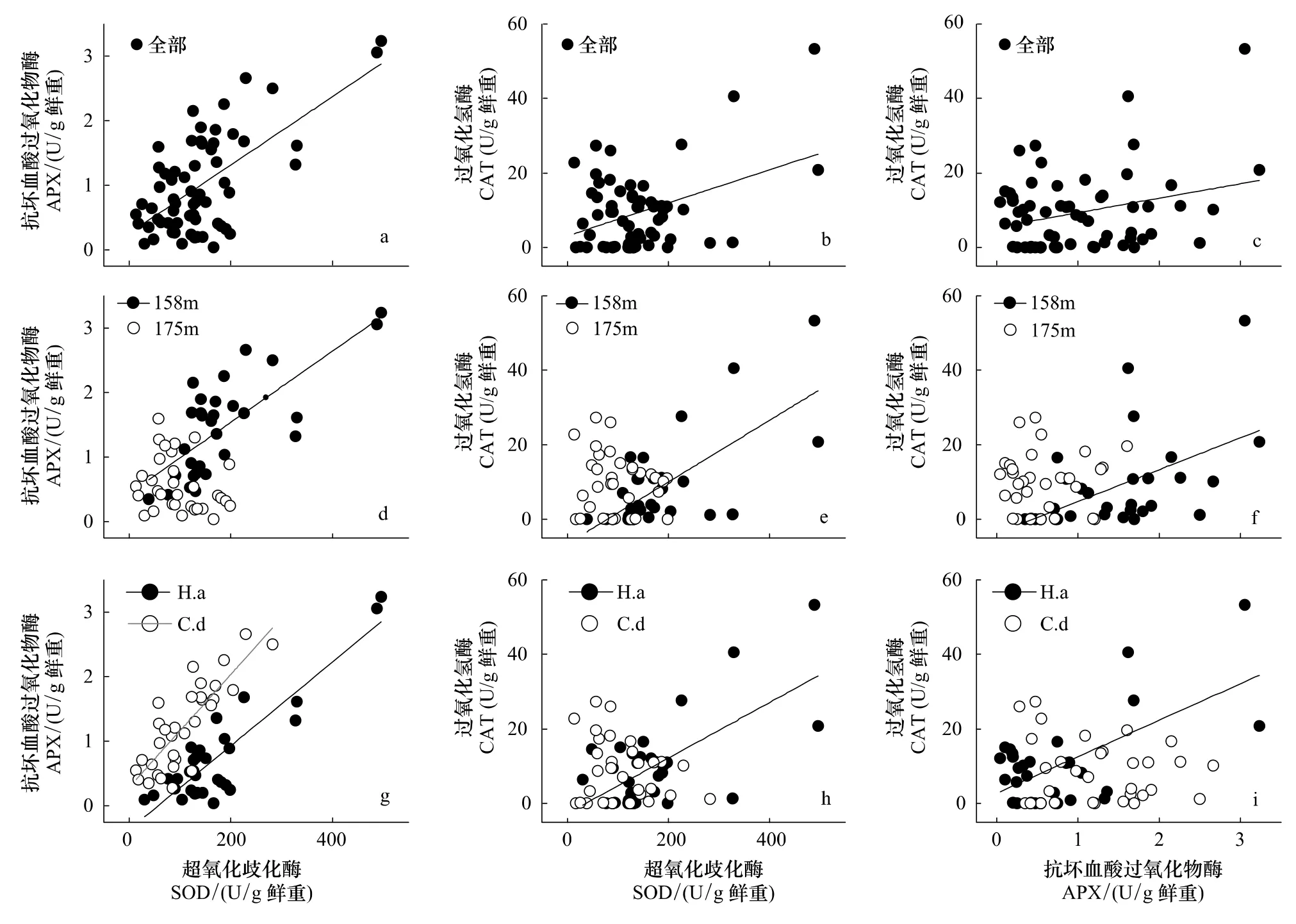
圖2 基于植株個體數據的SOD、APX和CAT酶活力相關分析Fig.2 Activity-correlation between SOD,APX and CAT based on plant individuals
本實驗中,狗牙根CAT活力迅速恢復到對照水平,而牛鞭草CAT活力迅速增至較高水平,只因波動較大而與對照未形成顯著差異(圖1)。這個差別可能源于兩個物種細胞中ROS調節途徑的不同響應。在功能上,CAT、AsA-GSH循環(抗壞血酸-谷胱甘肽循環)以及GPX(谷胱甘肽過氧化物酶)均能催化分解H2O2,在維持細胞氧化還原狀態穩定方面,三者在一定程度上互為冗余、互相補充[35-37],因此,可能兩個物種在催化分解H2O2途徑上存在差異。此外,牛鞭草在恢復過程中3-個酶與對照組的相對活性均有不同程度的增加,而狗牙根3個酶的相對活性基本維持不變。這可能說明牛鞭草在恢復階段處于更高水平的氧化脅迫下;或其它機制也參與了對狗牙根的ROS清除過程。
3.4 消落帶位點恢復過程中3個酶的活性顯著正相關
海拔158 m位點的植物在恢復過程中抗氧化酶活力之間出現顯著相關(圖2),可能是植物細胞維持ROS代謝內穩態的體現。SOD分布于所有細胞器內,能夠催化超氧陰離子自由基()發生歧化反應,產生H2O2及O2[18],而APX和CAT則進一步清除H2O2[19]。研究報道顯示,對細胞有潛在毒性的ROS同時也具有信號傳導作用[38-39],低濃度下,H2O2作為信號分子參與出發各種脅迫響應[40],高濃度下則發出細胞程序性死亡[41]。因此,恢復期植物可以通過調節酶活力以及加強各關鍵酶的協作作用(相關關系)[32],最大能力清除過量積累的ROS,以避免細胞遭受不可逆轉的損傷。而對照組3個抗氧化酶活力之間沒有顯著相關性,原因可能是非氧化脅迫狀態下其他代謝途徑與ROS代謝的相互作用加強,ROS代謝過程可能不是制約植物生存生長的唯一關鍵生理生態過程。
總之,我們采用野外采樣、對比測定的方法研究了三峽庫區消落帶生長的狗牙根和牛鞭草的根系在水淹后恢復過程中的ROS清除的關鍵酶的活性動態。發現:長期水淹脅迫導致SOD、APX酶活增強而CAT酶活降低;淹水后恢復期,清除ROS的關鍵酶活性發生了動態變化,這可能與水淹過后的積極恢復生長能力有密切關系;恢復過程中兩個物種酶活動態并不一致;恢復過程中3個酶的活性呈顯著相關。盡管有關ROS代謝與恢復生長之間的關系還需要進一步的直接證據,本文的研究結果有助于揭示消落帶植物適應的生理生態機制,也為消落帶生態恢復治理實踐提供了重要的理論基礎。
致謝:感謝重慶大學郭勁松教授、夏玉仙教授和曾德玉老師提供檢測設備支持。
[1] Lu Z J,Li L F,Huang H D,Tao M,Zhang Q F,Jiang M X.Preliminary effects of impounding on vegetation in drawdown zone of the Three Gorges Reservoir region.Journal of Wuhan Botanical Research,2010,28(3):303-314.
[2] Tan S D,Wang Y,Zhang Q F.Environmental challenges and countermeasures of the water-level-fluctuation zone(WLFZ)of the Three Gorges Reservoir.Resources and Environment in the Yangtze Basin,2008,17(S1):101-105.
[3] Su W C.Main ecological and environmental problems of water-level-fluctuation zone(WLFZ)in Three Gorges reservoir and their controlling measures.Journal of Yangtze River Scientific Research Institute,2004,21(2):32-34.
[4] Voesenek L A C J,Colmer T D,Pierik R,Millenaar F F,Peeters A J M.How plants cope with complete submergence.New Phytologist,2006,170(2):213-226.
[5] Zhang X Y,Fan D Y,Xie Z Q,Xiong G M,Li Z J.Clonal integration enhances performance of Cynodon dactylon subjected to submergence.Chinese Journal of Plant Ecology,2010,34(9):1075-1083.
[6] Sarkar R K.Saccharide content and growth parameters in relation with flooding tolerance in rice.Biologia Plantarum,1997,40(4):597-603.
[7] Angelov M N,Sung S J S,Doong R L,Harms W R,Kormanik P P,Black C C.Long-and short-term flooding effects on survival and sink-source relationships of swamp-adapted tree species.Tree Physiology,1996,16(5):477-484.
[8] Islam M A,Macdonald S E.Ecophysiological adaptations of black spruce(Picea mariana)and tamarack(Larix laricina)seedlings to flooding.Trees-Structure and Function,2004,18(1):35-42.
[9] Gibbs J,Greenway H.Mechanisms of anoxia tolerance in plants.I.Growth,survival and anaerobic catabolism.Functional Plant Biology,2003,30(1):1-47.
[10] Wang J C,Zhu B,Wang T.Characteristics of restoration of natural herbaceous vegetation of typical water-level fluctuation zone after flooding in the Three gorges Reservoir area.Resources and Environment in the Yangtze Basin,2011,20(5):603-610.
[11] Wang H F,Zeng B,Li Y,Qiao P,Ye X Q,Luo F L.Effects of long-term submergence on survival and recovery growth of four riparian plant species in Three Gorges Reservoir region,China.Journal of Plant Ecology,2008,32(5):977-984.
[12] Liu Y F,Liu Z X.Adaptability test of Cynodon dactylon(L.)Pers.in the ebb and flow zone of the Three Gorges Reservoir under extreme conditions.Journal of Southwest Agricultural University:Natural Science,2005,27(5):661-663.
[13] Luo F L,Nagel K A,Zeng B,Schurr U,Matsubara S.Photosynthetic acclimation is important for post-submergence recovery of photosynthesis and growth in two riparian species.Annals of Botany,2009,104(7):1435-1444.
[14] Blokhina O,Virolainen E,Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:a review.Annals of Botany,2003,91(2):179-194.
[15] Crawford R M M,Braendle R.Oxygen deprivation stress in a changing environment.Journal of Experimental Botany,1996,47(2):145-159.
[16] Nabben R H M,Blom C W P M,Voesenek L A C J.Resistance to complete submergence in Rumex species with different life histories:the influence of plant size and light.New Phytologist,1999,144(2):313-321.
[17] Yi Y H,Fan D Y,Xie Z Q,Chen F Q.The effects of waterlogging on photosynthesis-related eco-physiological processes in the seedlings of Quercus variabilis and Taxodium ascendens.Acta Ecologica Sinica,2008,28(12):6025-6033.
[18] Bowler C,Vanmontagu M,Inze D.Superoxide-dismutase and stress tolerance.Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:83-116.
[19] May M,Vernoux T,Leaver C,Van Montagu M,Inze D.Glutathione homeostasis in plants:implications for environmental sensing and plant development.Journal of Experimental Botany,1998,49(321):649-667.
[20] Tan S D,Zhang S J,Zhang K R,Dang H S,Li M,Zhang Q F.Effect of long-time and deep submergence on recovery growth and photosynthesis of three grass species in Three Gorges Reservoir area.Journal of Wuhan Botanical Research,2009,27(4):391-396.
[21] Yang C H,Zhang X Q,Li X L,Du Y,Wu Y Q.Hemarthria germplasm resources and breeding.Acta Prataculturae Sinica,2004,13(2):7-12.
[22] Jiang M,Zhang J.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves.Journal of Experimental Botany,2002,53(379):2401-2410.
[23] Li Z J,Yu J,Fan D Y,Xie Z Q,Xiong G M,Zhang X Y.Clonal integration enhances the ability to scavenge reactive oxygen species in root of Cynodon dactylon subjected to submergence.Acta Ecologica Sinica,2011,31(17):4992-4999.
[24] Mittler R.Oxidative stress,antioxidants and stress tolerance.Trends in Plant Science,2002,7(9):405-410.
[25] Monk L S,Fagerstedt K V,Crawford R M M.Oxygen-toxicity and superoxide-dismutase as an antioxidant in physiological stress.Physiologia Plantarum,1989,76(3):456-459.
[26] Garnczarska M,Bednarski W.Effect of a short-term hypoxic treatment followed by re-aeration on free radicals level and antioxidative enzymes in lupine roots.Plant Physiology and Biochemistry,2004,42(3):233-240.
[27] Monk L S,Fagerstedt K V,Crawford R M M.Superoxide dismutase as an anaerobic polypeptide:a key factor in recovery from oxygen deprivation in iris pseudacorus?Plant Physiology,1987,85(4):1016-1020.
[28] Biemelt S,Keetman U,Mock H P,Grimm B.Expression and activity of isoenzymes of superoxide dismutase in wheat roots in response to hypoxia and anoxia.Plant,Cell and Environment,2000,23(2):135-144.
[29] Kono Y,Fridovich I.Superoxide radical inhibits catalase.Journal of Biological Chemistry,1982,257(10):5751-5754.
[30] Unger I M,Motavalli P P,Muzika R M.Changes in soil chemical properties with flooding:a field laboratory approach.Agriculture,Ecosystems and Environment,2009,131(1/2):105-110.
[31] Sairam R K,Kumutha D,Ezhilmathi K,Deshmukh P,Srivastava G.Physiology and biochemistry of waterlogging tolerance in plants.Biologia Plantarum,2008,52(3):401-412.
[32] Hossain Z,López-Climent M F,Arbona V,Pérez-Clemente R M,Gómez-Cadenas A.Modulation of the antioxidant system in citrus under waterlogging and subsequent drainage.Journal of Plant Physiology,2009,166(13):1391-1404.
[33] Veselova T V,Veselovsky V A,Turovetsky V B,Galchuk S V,Vanyushin V F,Aleksandrushkina N I,Rubin A B.Post-hypoxic oxidative stress after radicle protrusion as a possible cause for the production of abnormal seedlings in pea.Seed Science and Technology,2004,32(2):283-296.
[34] Dubey H,Grover A.Respiratory pathway enzymes are differentially altered in flood tolerant and sensitive rice types during O2deprivation stress and post-stress recovery phase.Plant Science,2003,164(5):815-821.
[35] Willekens H,Chamnongpol S,Davey M,Schraudner M,Langebartels C,Van Montagu M,Inze D,Van Camp W.Catalase is a sink for H2O2and is indispensable for stress defence in C3plants.The EMBO Journal,1997,16(16):4806-4816.
[36] Vanderauwera S,Zimmermann P,Rombauts S,Vandenabeele S,Langebartels C,Gruissem W,Inzé D,Van Breusegem F.Genome-wide analysis of hydrogen peroxide-regulated gene expression in Arabidopsis reveals a high light-induced transcriptional cluster involved in anthocyanin biosynthesis.Plant Physiology,2005,139(2):806-821.
[37] Mhamdi A,Hager J,Chaouch S,Queval G,Han Y,Taconnat L,Saindrenan P,Gouia H,Issakidis-Bourguet E,Renou J P,Noctor G.Arabidopsis glutathione reductase1 plays a crucial role in leaf responses to intracellular hydrogen peroxide and in ensuring appropriate gene expression through both salicylic acid and jasmonic acid signaling pathways.Plant Physiology,2010,153(3):1144-1160.
[38] Jabs T,Dietrich R A,Dangl J L.Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide.Science,1996,273(5283):1853-1856.
[39] Foreman J,Demidchik V,Bothwell J H F,Mylona P,Miedema H,Torres M A,Linstead P,Costa S,Brownlee C,Jones J D G,Davies J M,Dolan L.Reactive oxygen species produced by NADPH oxidase regulate plant cell growth.Nature,2003,422(6930):442-446.
[40] Mittler R,Vanderauwera S,Gollery M,Van Breusegem F.Reactive oxygen gene network of plants.Trends in Plant Science,2004,9(10):490-498.
[41] Dat J,Vandenabeele S,Vranová E,Van Montagu M,Inzé D,Van Breusegem F.Dual action of the active oxygen species during plant stress responses.Cellular and Molecular Life Sciences,2000,57(5):779-795.
參考文獻:
[1] 盧志軍,李連發,黃漢東,陶敏,張全發,江明喜.三峽水庫蓄水對消漲帶植被的初步影響.武漢植物學研究,2010,28(3):303-314.
[2] 譚淑端,王勇,張全發.三峽水庫消落帶生態環境問題及綜合防治.長江流域資源與環境,2008,17(S1):101-105.
[3] 蘇維詞.三峽庫區消落帶的生態環境問題及其調控.長江學院院報,2004,21(2):32-34.
[5] 張想英,樊大勇,謝宗強,熊高明,李兆佳.克隆整合有助于狗牙根抵御水淹.植物生態學報,2010,34(9):1075-1083.
[10] 王建超,朱波,汪濤.三峽庫區典型消落帶淹水后草本植被的自然恢復特征.長江流域資源與環境,2011,20(5):603-610.
[11] 王海鋒,曾波,李婭,喬普,葉小齊,羅芳麗.長期完全水淹對4種三峽庫區岸生植物存活及恢復生長的影響.植物生態學報,2008,32(5):977-984.
[12] 劉云峰,劉正學.三峽水庫消落區極限條件下狗牙根適生性試驗.西南農業大學學報:自然科學版,2005,27(5):661-663.
[17] 衣英華,樊大勇,謝宗強,陳芳清.模擬淹水對池杉和栓皮櫟光合生理生態過程的影響.生態學報,2008,28(12):6025-6033.
[20] 譚淑端,張守君,張克榮,黨海山,黎明,張全發.長期深淹對三峽庫區三種草本植物的恢復生長及光合特性的影響.武漢植物學研究,2009,27(4):391-396.
[21] 楊春華,張新全,李向林,杜逸,吳彥奇.牛鞭草屬種質資源及育種研究.草業學報,2004,13(2):7-12.
[23] 李兆佳,喻杰,樊大勇,謝宗強,熊高明,張想英.克隆整合提高淹水脅迫下狗牙根根部的活性氧清除能力.生態學報,2011,31(17):4992-4999.

