基于雙層電極的介電電泳微流控芯片的設計和制備
國世上,黃慧明,李美亞
(武漢大學 物理科學與技術學院,湖北 武漢430072)
1 引 言
微流控芯片是20世紀90年初發展起來的重要技術平臺,因其分析速度快、樣品耗量少、檢測通量高、便攜性能好和易于自動化等優點而受到人們普遍關注[1-3].它以微流控技術和微機電加工技術(MEMS)為基礎,制備出小尺度(從μm到nm)的流體器件,研究小尺度上流體的特異性質,控制小尺度流體的物理和化學變化[4-6].該研究領域是在物理、化學、生物等多個基礎學科上發展起來的一門全新的交叉學科,涉及到材料制備、機械加工、生化分析及生物工程等技術領域.伴隨著微流控芯片的蓬勃發展,數值仿真也逐漸成為微流控芯片學科中的重要部分.數值仿真在微流控芯片中有很多優勢,比如可以幫助驗證實驗現象,有助于研究人員更好地理解實驗的物理機制,有助于優化實驗及其器件,還可以幫助驗證假設,等等.
在微流控芯片中,介電電泳技術由于自身優異性而受到人們的重點關注,其最大特點是利用不均勻電場對微粒進行物理分離.該技術不需要添加抗體,生物顆粒(如細胞)不會在分離過程中因抗體反應而發生生物性質改變;所用交變電場對細胞的作用是“非破壞性”的,電場強度、頻率、相位都容易調控;同時,該技術還可與熱、光、聲等其他物理手段結合使用,以達到最佳的微粒操縱效果.例如,Das等利用多組不同頻率的微陣列平行電極進行了細胞篩選[7].由于癌細胞和正常細胞大小不同,所受的介電電泳力不同,據此可將淋巴瘤細胞從血液混合液中分離出來.這種方法可進一步用于外周血中脫落癌細胞的檢測,為腫瘤轉移的診斷提供了一種有效途徑.
近年來,本課題組在對本科生業余科研及研究生教學過程中,進行了一系列介電電泳微流控芯片的研制和演示工作.在傳統電極制備的基礎上,結合光刻工藝設計了新型微流控芯片,利用在玻璃基底上下兩面制備金屬電極的方法,與閉合溝道的硅膠溝道鍵合在一起,通過施加交流電壓的底部電極產生的非均勻電場提供基本的介電電泳力來抓捕顆粒,根據微粒的物理性質實現有效操縱.該微流控芯片可以在充滿液體的微流溝道中反復使用,沒有明顯的電熱現象,操縱簡單、可靠性高,非常有利于學生加深對實驗物理現象的認識和理解.
2 實驗原理與芯片制備
介電電泳(dielectrophoresis,DEP)是指放置于非均勻電場下的電中性顆粒產生誘導極化并且與電場相互作用而產生的電泳現象[8-10].當溶液的極化率大于顆粒的極化率時,產生負向介電泳,顆粒向場強最低的區域移動;反之,則為正向介電泳,顆粒向場強最高的區域移動.在非均一電場下,根據不同微粒所受到的介電電泳力不同而實現分離,介電電泳力的大小和方向主要與外加電場的頻率、溶液和微粒的介電特性、電導率及微粒的大小有關.作用在球形顆粒上的介電電泳力為

其中
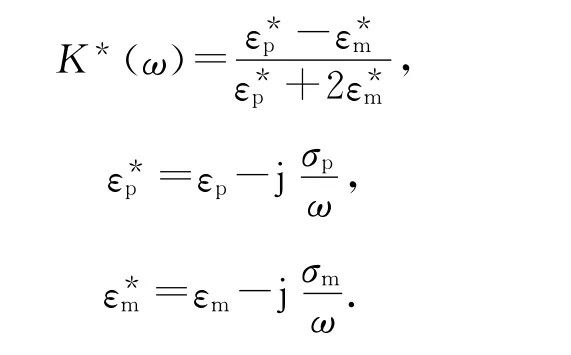
式中r,εp,σp,εm和σm分別為顆粒半徑、顆粒電容率、顆粒電導率、介質電容率和介質電導率.由(1)式可以看出,介電電泳力與電場強度平方的梯度呈線性關系.
利用傳統lift-off技術進行介電電泳芯片電極的制備.該工藝簡述如下:使用三氯乙烯、丙酮、異丙醇、去離子水依次清洗玻璃基底(100μm厚),利用正光刻膠(AZ5214E)在玻璃基底上旋涂1μm厚度薄層,使用高精度的透明掩膜在UV光源下進行光刻.顯影后通過磁控濺射制備鉻/金叉指電極.最后利用丙酮去除光刻膠制備出所需電極圖案.微流溝道的制作采用標準光刻技術,配置交聯劑(A組分)與固化劑(B組分)體積比為10:1的聚二甲基硅氧烷(PDMS),澆注在硅片陽膜上,80℃固化1h從硅片上剝離,然后將PDMS溝道和玻璃基底進行氧等離子體處理后實現鍵合.芯片設計和制備如圖1~3所示,可見該電泳芯片具有良好的雙層電極結構,從而具備靈活的電場操縱性.
實驗裝置如圖4所示,介電電泳芯片放于正置顯微鏡(SZX7,Olympus)上進行觀察,顯微鏡連接有高速CCD攝像頭,用于觀察與記錄微粒的運動過程,通過專業的圖像分析軟件(IPP)進行圖像分析.利用雙通道信號發生器(Agilent 81150A)經高頻放大器(Model 25A250)施加1MHz的交流信號在底電極上,雙通道信號發生器的一路信號加到一列叉指電極,另一路峰值相同相差180°的信號加到另一組叉指電極上,利用數字示波器進行監測.配制質量分數為0.3%葡萄糖和質量分數為8.5%蔗糖的去離子水低導電性介電溶液,把聚苯乙烯小球(10μm直徑)分散其中形成懸浮液,溶液的電導率使用阻抗分析儀(Agilent 4294A)在1MHz頻率時測得.

圖1 介電電泳芯片設計示意圖

圖2 制備好的芯片實物照片

圖3 叉指電極放大圖

圖4 實驗裝置示意圖
3 結果分析與討論
微流控芯片與宏觀實驗不同之處在于其尺寸已經達到μm級別,有許多實驗現象或者遇到的問題與在宏觀尺度中有很大的不同,這就給研究帶來了一定的困難,而模擬仿真可以從理論上幫助人們更好地理解物理機制,理解實驗現象.
利用有限元軟件(COMSOL multiphysics)對該介電電泳芯片進行了三維模擬,建模時采用的幾何結構與芯片實際尺寸一致.介電電泳芯片頂電極的電勢能和電場平方的梯度幅值如圖5所示.從圖中可以看到雙層電極產生的電場為非均勻電場,且電場強度在頂電極中心處最低,在兩電極中間處最強.電場平方的梯度幅值隨著電極的周期性變化呈現周期性的變化,且在每個頂電極上的幅值變化為拋物線變化,在相鄰電極中心達到最大值,表明此處介電電泳力最大.通過分析電勢能和介電電泳力等物理問題,可以有效地預測實驗進程及結果,從而生動呈現實驗中的物理機制.

圖5 介電電泳芯片垂直于頂電極切面的電勢能和電場平方的梯度幅值
根據介電特性,聚苯乙烯微球在非均勻電場中進行負向介電泳,微球將會聚集在電場最弱的電極中心區域.圖4為該介電電泳芯片對聚苯乙烯微球的操縱實驗結果.粒子數密度為2.28×107mL-1的懸浮聚苯乙烯顆粒懸浮液以體積流量5μL/h注入到PDMS通道,溶液的電導率為3.3μS.施加的交流電頻率為1MHz,峰值電壓為120V.由圖6可知,大部分聚苯乙烯球在5s內聚集到了頂電極的中心.當流體的最大體積流量提高到30μL/h時,被捕獲的聚苯乙烯微球仍然聚集在電極中心.實驗現象說明,通過控制底電極電場,可有效進行芯片中的介電電泳,微粒所受介電電泳力與模擬結論相符.通過圖像處理計算出顆粒的平均體積流量為(16.7±2.5)μm/s,作用在聚苯乙烯微球上的介電泳力約為1.4pN,該介電泳力遠大于單層電極芯片結果(約為0.26 pN[7]),從而證實通過雙層電極的設計實現了一種更有效的介電電泳操控方式.

圖6 在電場作用下聚苯乙烯微球的分布顯微鏡照片
4 結束語
介電電泳在微流控芯片中具有極大的應用潛力,本文提出了基于雙層金屬電極的介電電泳微流控芯片設計,并且利用光刻、等離子體鍵合等微加工工藝制備了基于該設計的芯片.在此基礎上進行了聚苯乙烯介質微球的介電電泳捕獲實驗研究和數值模擬,實驗與數值模擬結果相吻合,結果表明本文提出的基于雙層金屬電極的介電電泳芯片能更有效地實現對電介質顆粒操控.這些工作有助于加深學生對介電電泳物理現象、微流控芯片加工設計及工程應用等方面的理解,也是將科研成果轉化應用到實驗教學所做的有益嘗試.
[1]Harrison D J,Fluri K,Seiler K,et al.Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip [J].Science,1993,261(5123):895-897.
[2]Chou Hou-pu,Spence C,Scherer A,et al.A microfabricated device for sizing and sorting DNA molecules[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(1):11-13.
[3]Whitesides G M,Ostuni E,Takayama S,et al.Soft lithography in biology and biochemistry [J].Annu.Rev.Biomed.Eng.,2001,3:335-373.
[4]方肇倫.微流控分析芯片[M].北京:科學出版社,2003:1-5.
[5]邢婉麗,程京.生物芯片技術[M].北京:清華大學出版社,2004:77-79.
[6]林炳承,秦建華.微流控芯片實驗室[M].北京:科學出版社,2006:1-3.
[7]Das C M,Becker F,Vernon S,et al.Dielectrophoretic segregation of different human cell types on microscope slides[J].Anal.Chem.,2005,77(9):2708-2719.
[8]林炳承,秦建華.圖解微流控芯片實驗室[M].北京:科學出版社,2008:238-239.
[9]de Gasperis G,Yang Jun,Becker F F,et al.Microfluidic cell separation by 2-dimensional dielectrophoresis[J].Biomedical Microdevices,1999,2(1):41-49.
[10]Pohl H A.Dieletrophoresis[M].Cambridge:Cambridge University Press,1978.

