紅細(xì)胞生成素對(duì)慢性腎衰竭大鼠外周血內(nèi)皮祖細(xì)胞SDF-1及其受體表達(dá)的影響*
萬建新, 崔 炯, 高 娜, 楊 霞, 李鎮(zhèn)洲, 陳 俊, 鄒臻寰, 尤丹瑜
(福建醫(yī)科大學(xué)附屬第一醫(yī)院腎內(nèi)科,福建福州350005)
血管內(nèi)皮祖細(xì)胞(endothelial progenitor cells,EPCs)是成熟血管內(nèi)皮細(xì)胞的前體細(xì)胞。我們前期的研究表明紅細(xì)胞生成素(erythropoietin,EPO)能促進(jìn)5/6腎大部切除大鼠外周血EPCs的動(dòng)員和增殖,改善外周血EPCs黏附能力和形成血管腔樣結(jié)構(gòu)的能力,促進(jìn)腎小球毛細(xì)血管內(nèi)皮功能的修復(fù)、減輕腎臟的病理改變和改善腎功能[1-2]。但外周血EPCs如何被動(dòng)員的確切機(jī)制尚不清楚。有研究表明EPO可顯著提高健康人群和腎衰竭患者EPCs的數(shù)量與功能,并可能與提高EPCs中Akt蛋白激酶的活性有關(guān)[3]。最近我們的研究表明EPO可激活5/6腎大部切除大鼠殘腎組織歸巢因子及其受體的表達(dá),這可能也是EPCs參與損傷腎臟修復(fù)的重要機(jī)制之一[4]。本文觀察EPO干預(yù)慢性腎衰竭(chronic renal failure,CRF)大鼠后,外周血EPCs歸巢因子——基質(zhì)細(xì)胞衍生因子1(stromal cell-derived factor 1,SDF-1)及其受體CXC趨化因子受體4(CXC chemokine receptor 4,CXCR4)的表達(dá)是否受到影響。
材料和方法
1 材料
1.1 動(dòng)物 成年雄性6周齡SD大鼠(體重200~250 g),購自吳氏動(dòng)物中心(編號(hào)為2007000521321)。
1.2 主要試劑 M199培養(yǎng)基和胎牛血清(Gibco),血管內(nèi)皮生長因子(vascular epithelial growth factor,VEGF;PeproTech),重組牛堿性成纖維細(xì)胞生長因子(珠海億勝生物制藥),人纖維連接蛋白(Chemicon),F(xiàn)ITC標(biāo)記的荊豆凝集素1(Ulex europaeus agglutinin 1,UEA1;Sigma),DiI標(biāo)記乙酰化低密度脂蛋白(acetylated DiI-labeled low density lipoproteins,acLDL-DiI;Molecular Probe),人重組EPO(益比奧,三生制藥),PE標(biāo)記的血管內(nèi)皮生長因子受體2(vascular epithelial growth factor receptor 2,VEGFR2;R&D),PE標(biāo)記的CD133單克隆抗體(BD),PE標(biāo)記的CD34單克隆抗體(Miltenyi Biotec),F(xiàn)ITC標(biāo)記的抗大鼠Ⅱ抗(北京中山),Trizol(Invitrogen),PCR試劑盒(TaKaRa),EPO抗體(Santa Cruz),紅細(xì)胞生成素受體(erythropoietin receptor,EPOR)抗體(Santa Cruz),SDF-1α抗體和CXCR4抗體(Abcam)。
2 方法
2.1 動(dòng)物模型制備及分組 采用分階段5/6腎切除制備大鼠慢性腎衰竭模型:10%水合氯醛腹腔麻醉后,經(jīng)側(cè)腹部切口,暴露左側(cè)腎臟,分離腎動(dòng)脈及其分支,結(jié)扎其中的左上支和中支并剪斷,使左腎梗死約2/3,3 d后再將大鼠右腎摘除。21只SD大鼠隨機(jī)分為3組(每組7只):假手術(shù)組、CRF模型組和EPO治療組。假手術(shù)組僅分離腎動(dòng)脈及其分支,不予結(jié)扎;EPO治療組于第2次手術(shù)后3周開始皮下注射30 U/kg EPO,每周3次,連用6周。所有大鼠均于造模后8周處死。
2.2 外周血EPCs分離、培養(yǎng)與鑒定 SD大鼠處死后心臟采血5 mL,采用Ficoll密度梯度離心法分離出單核細(xì)胞,并進(jìn)行細(xì)胞培養(yǎng)。EPCs鑒定采用DiIAcLDL和FITC-UEA1雙熒光染色法。EPCs培養(yǎng)和鑒定的方法參見本課題組前期工作[1]。
2.3 實(shí)時(shí)熒光定量PCR 各組大鼠外周血EPCs總RNA的提取和cDNA的合成按試劑盒的說明書進(jìn)行。所用的引物序列及擴(kuò)增長度見表1(由TaKaRa公司協(xié)助設(shè)計(jì)并合成)。定量擴(kuò)增用 ABI PRISM 7500 Fast熒光PCR儀,采用SYBR Green PCR方法進(jìn)行。PCR反應(yīng)條件為:95℃預(yù)變性30 s,95℃ 5 s,60℃ 30 s,72 ℃ 30 s,共30個(gè)循環(huán)。反應(yīng)結(jié)束后確認(rèn)PCR擴(kuò)增曲線和融解曲線。以GAPDH為內(nèi)參照,采用比較Ct法相對(duì)定量,結(jié)果以兩組間目的基因拷貝數(shù)比值(relative quantification,RQ)表示。每個(gè)cDNA模板標(biāo)本重復(fù)檢測3次,結(jié)果取平均值,每次反應(yīng)3個(gè)基因各設(shè)陰性空白對(duì)照1個(gè)。
2.4 Western blotting檢測 各組大鼠外周血EPCs用裂解緩沖液處理,按Bradford蛋白定量試劑盒說明書測定蛋白含量。并按經(jīng)典方法配制10%SDSPAGE分離膠和5%濃縮膠進(jìn)行蛋白電泳。將電泳的凝膠以相同大小的NC膜進(jìn)行轉(zhuǎn)膜。將封閉好的NC膜分別放入用封閉液稀釋的Ⅰ抗中孵育,用增強(qiáng)化學(xué)發(fā)光使膠片顯影,掃描后用 White/Ultraviolet Transilluminator系統(tǒng)軟件分析,蛋白表達(dá)量用積分吸光度(integrated absorbance,IA)值來表示。以β-actin為內(nèi)參照,進(jìn)行半定量分析,比值表示其相對(duì)含量。
3 統(tǒng)計(jì)學(xué)處理
數(shù)據(jù)用均數(shù)±標(biāo)準(zhǔn)差(mean±SD)表示,經(jīng)方差齊性檢驗(yàn)和組內(nèi)的方差分析。用 SPSS 15.0統(tǒng)計(jì)軟件包分析,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。

表1 引物序列Table 1.Sequences of the primers
結(jié) 果
1 EPO對(duì)外周血EPCs歸巢因子及其受體表達(dá)影響
實(shí)時(shí)熒光定量PCR結(jié)果顯示,與CRF組比較,治療組外周血EPCs SDF-1和CXCR4 mRNA表達(dá)顯著增高(均P <0.05),見圖1。Western blotting結(jié)果顯示,與模型組比較,治療組外周血EPCs SDF-1和CXCR4蛋白表達(dá)顯著增高(均P<0.05),見圖2。
2 EPO對(duì)外周血EPCs EPO及EPOR的影響
實(shí)時(shí)熒光定量PCR結(jié)果顯示,與CRF組比較,治療組外周血EPCs EPO及EPOR mRNA表達(dá)顯著增高(均 P <0.05),見圖 3。Western blotting結(jié)果顯示,與模型組比較,治療組外周血 EPCs EPO及EPOR蛋白表達(dá)顯著增高(均P<0.05),見圖4。
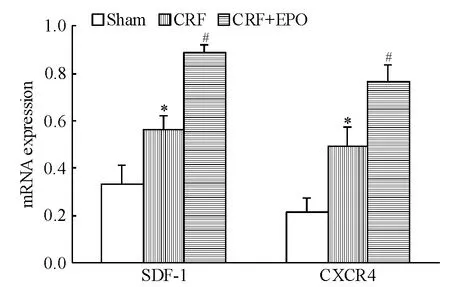
Figure 1.Effects of EPOon mRNA expression of SDF-1 and CXCR4 in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.圖1 SDF-1和CXCR4 mRNA在各組大鼠外周血EPCs中的表達(dá)
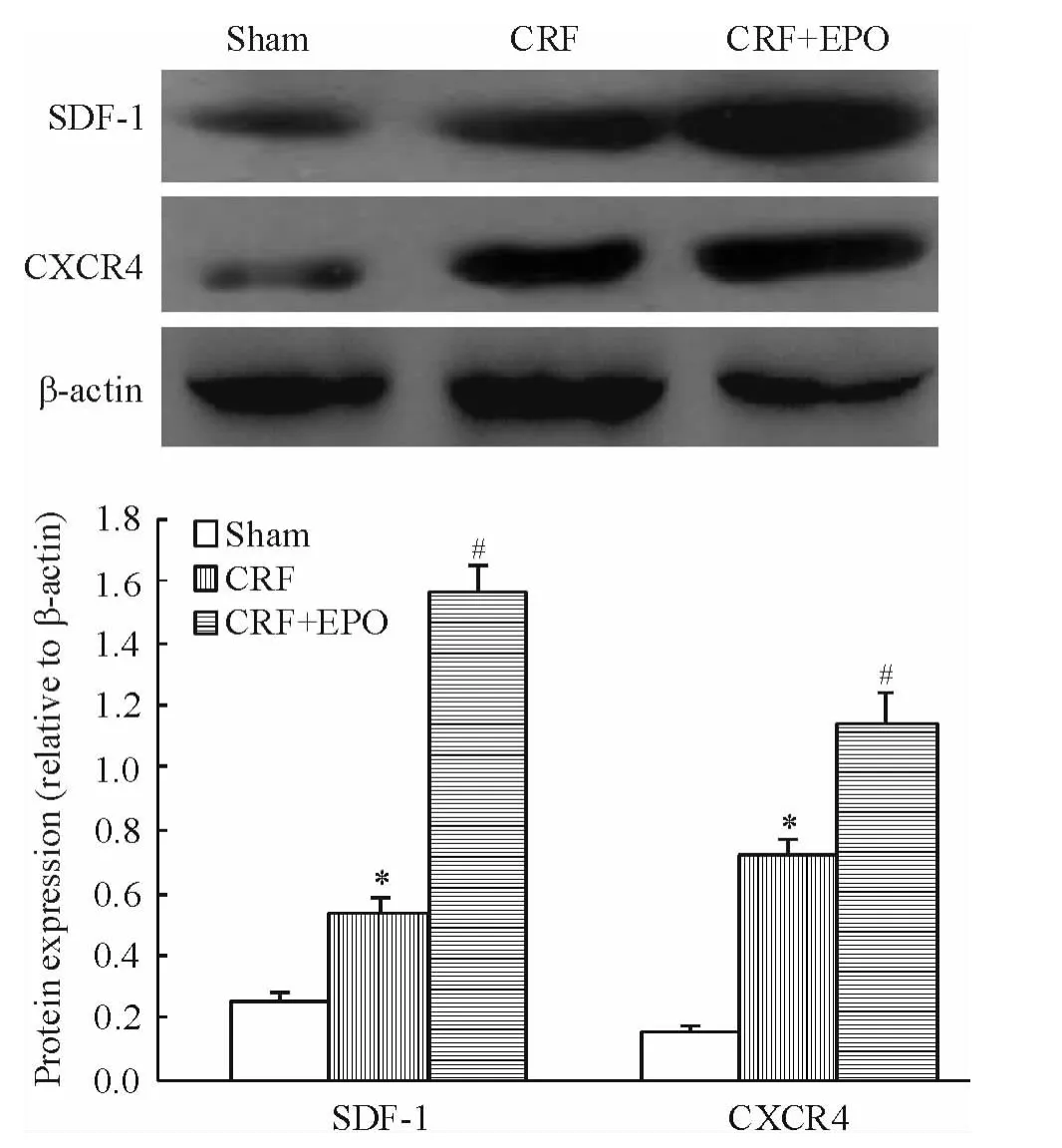
Figure 2.Effects of EPOon protein expression of SDF-1 and CXCR4 in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.圖2 SDF-1和CXCR4蛋白在各組大鼠外周血EPCs中的表達(dá)
討 論
EPCs是成熟血管內(nèi)皮細(xì)胞的前體細(xì)胞,起源于骨髓的原始細(xì)胞。骨髓中的EPCs增殖后進(jìn)入血液循環(huán),參與血管新生和器官修復(fù)。近年的研究發(fā)現(xiàn),刺激骨髓動(dòng)員EPCs,使循環(huán)EPCs數(shù)量增加,可能是促進(jìn)慢性腎臟病修復(fù)的一種有效手段[5-6]。EPCs通過自身分化、增殖而形成的新生血管不受原有血管內(nèi)皮細(xì)胞功能的影響,且受損的內(nèi)皮層可由循環(huán)EPCs重生。這一現(xiàn)象為EPCs在腎缺血、缺氧導(dǎo)致進(jìn)行性腎損害中的治療作用提供了新的理論依據(jù)。慢性腎衰竭患者體內(nèi)EPCs數(shù)量、遷移和融合能力都有所下降[7-8]。外周血 EPCs數(shù)量主要決定于骨髓中EPCs的動(dòng)員,在EPCs動(dòng)員過程中,EPO是一個(gè)重要的細(xì)胞因子[9]。但EPCs的動(dòng)員過程有哪些因素參與目前尚不清楚。
近年的研究表明靶組織中某些與歸巢相關(guān)的因子表達(dá)上調(diào)與EPCs的動(dòng)員與歸巢有關(guān)[10]。SDF-1是CXC趨化因子家族成員,CXCR4是其特異性受體。有研究表明CXCR4在EPCs表面高度表達(dá)[5]。SDF-1通過與 CXCR4結(jié)合,促進(jìn) CD34+造血干/祖細(xì)胞逆SDF-1濃度梯度移行和增殖,抑制CD34+造血干/祖細(xì)胞凋亡,誘導(dǎo)新生血管形成[11]。SDF-1還能促進(jìn)內(nèi)皮細(xì)胞和EPCs的存活與增殖,誘導(dǎo)EPCs的定向遷移并參與新血管形成[12-14]。Yin等[15]發(fā)現(xiàn)在動(dòng)脈損傷后,SDF-1可作為獨(dú)立因素動(dòng)員和歸巢EPCs參與損傷血管的再內(nèi)皮化。Kuliszewski等[16]發(fā)現(xiàn)在應(yīng)用通過超聲破壞微泡技術(shù)聯(lián)合SDF-1基因質(zhì)粒轉(zhuǎn)染治療肌肉缺血?jiǎng)游锬P秃螅浦驳腅PCs能特異歸巢到SDF-1表達(dá)的損傷組織。國內(nèi)近年的研究發(fā)現(xiàn)中藥當(dāng)歸補(bǔ)血湯可能通過提高循環(huán)VEGF和SDF-1水平來促進(jìn)兔動(dòng)脈粥樣硬化模型外周血EPCs的活性[17]。
近年的研究發(fā)現(xiàn)EPOR廣泛表達(dá)于許多非造血組織細(xì)胞中[18]。EPO本身就是一種低氧誘導(dǎo)因子,在低氧和紅細(xì)胞生成素的協(xié)同作用下可誘導(dǎo)EPOR的表達(dá)[19]。Lin 等[20]研究證實(shí)在低氧條件下,EPO/EPOR可通過增強(qiáng)SDF-1表達(dá),加強(qiáng)干/祖細(xì)胞的動(dòng)員。
綜上所述,我們的研究初步表明EPO對(duì)慢性腎衰竭大鼠外周血EPCs的動(dòng)員可能與其上調(diào)外周血內(nèi)皮祖細(xì)胞SDF-1及其受體表達(dá)有關(guān)。

Figure 3.Effects of EPO on mRNA expression of EPO and EPOR in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.圖3 EPO和EPOR mRNA在各組大鼠外周血EPCs中的表達(dá)
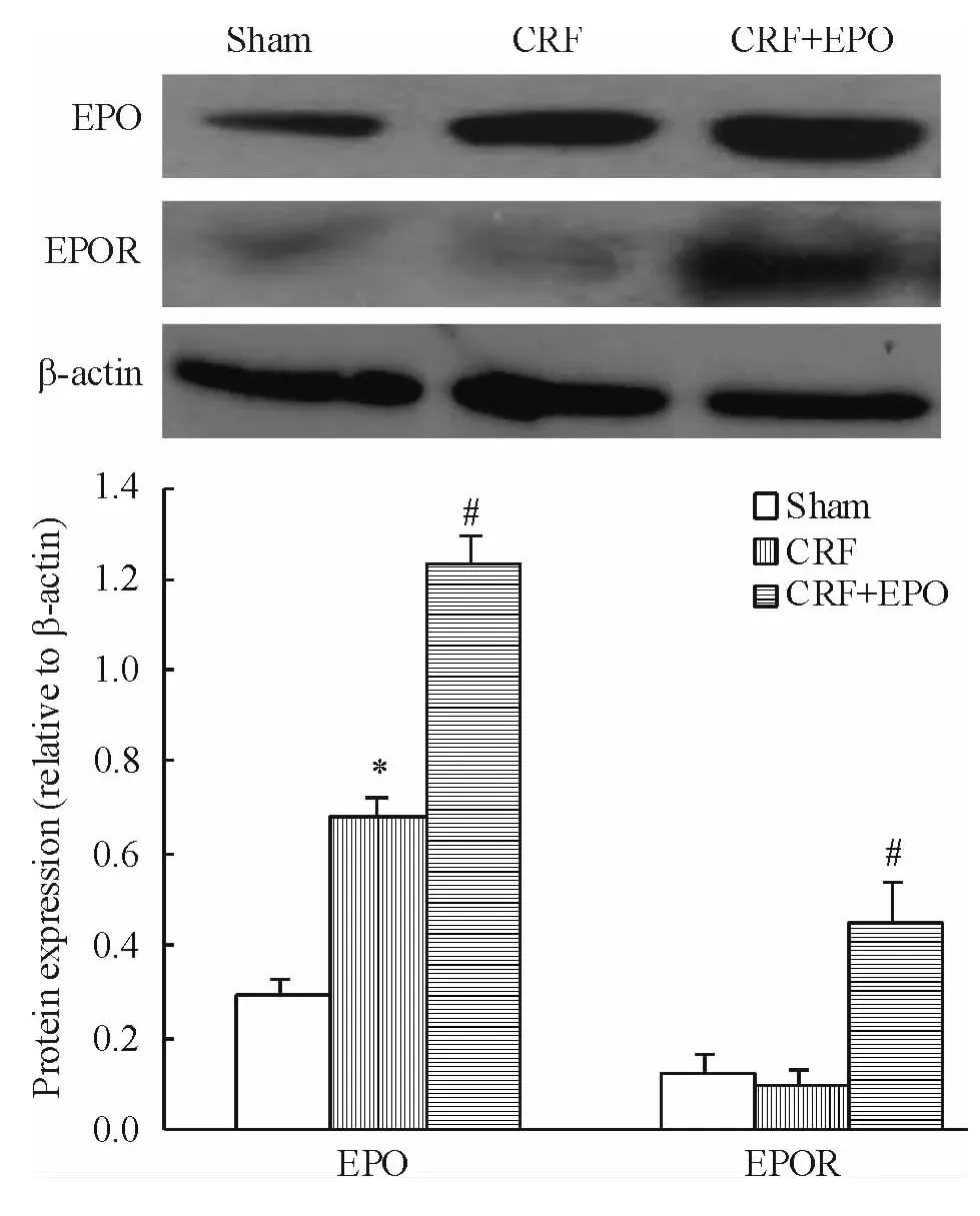
Figure 4.Effects of EPO on protein expression of EPO and EPOR in peripheral blood endothelial progenitor cells from rats.Mean ± SD.n=7.*P < 0.05 vs sham group;#P <0.05 vs CRF group.圖4 EPO和EPOR蛋白在各組大鼠外周血EPCs中的表達(dá)
- 中國病理生理雜志的其它文章
- 人腎小管上皮細(xì)胞necroptosis模型的構(gòu)建*
- 去胰島素的乳腺癌干細(xì)胞培養(yǎng)及雌激素誘導(dǎo)的作用*
- 左旋門冬酰胺酶與鹽霉素聯(lián)合作用對(duì)急性T淋巴細(xì)胞白血病Jurkat細(xì)胞株增殖凋亡的影響*
- SB203580在電壓依賴性鉀離子通道阻斷劑4-氨基吡啶增強(qiáng)大鼠低氧高二氧化碳性肺血管收縮中的作用*
- 葛根素注射液對(duì)糖尿病KKAy小鼠腎小管上皮細(xì)胞的影響*
- 新生SD大鼠血常規(guī)各項(xiàng)與發(fā)育時(shí)間的相關(guān)性分析及其與血清鐵濃度變化的機(jī)制*

