4 5 12血清型副豬嗜血桿菌外膜蛋白提取及分析
臧瑩安,李婉雁,龐木生,李 淼,宋 帥,李春玲
(1.仲愷農業工程學院動物科學系,廣東 廣州510225;2.廣東省農業科學院獸醫研究所,廣東 廣州510640;3.廣東省獸醫公共衛生公共實驗室,廣東 廣州510640)
副豬嗜血桿菌病是近年來嚴重危害世界養豬業的疾病,并已證實在中國絕大多數豬場存在和流行,且流行的主要血清型為4型、5型、12型[1-2]。目前對Hps致病機理的研究日益受到國內外學者的重視。然而,對這些致病因子在致病過程中的作用機制還缺乏系統深入的了解和認識[3-4]。外膜蛋白(OMP)是重要的致病因子之一,具有良好的免疫原性,不僅可刺激機體產生良好的體液免疫反應,也可產生細胞免疫反應[5],但OMP是否為主要的免疫原仍需進一步研究[6]。且由于OMP的疏水特性,其分離和分析較為困難,從而成為當今微生物界的一個研究重點和難點。本研究通過蛋白質組學相關技術,探索4、5、12血清型副豬嗜血桿菌OMP的提取方法,為OMP的深入研究奠定基礎。
1 材料與方法
1.1 菌株 4、5、12型Hps由廣東省農業科學院獸醫研究所豬病研究室保存。
1.2 主要儀器 SCIENTZ-ⅡD超聲波細胞粉碎機,購自上海蘭科儀器;Mycycler PCR儀,購自TaKaRa公司;BIO-RAD Model 680酶標儀,購自上海天呈科技有限公司;DYY-5型穩壓穩流電泳儀,購自北京六一儀器廠;Tanon全自動凝膠圖像分析系統,購自上海天能公司。
1.3 主要試劑 牛血清蛋白、過硫酸銨、β巰基乙酸均購自北京鼎國昌盛生物技術有限責任公司;Protein MW Marker,購自TaKaRa公司;考馬斯亮藍R-250、丙烯酰胺、N,N-甲叉雙丙烯酰胺、十二烷基磺酸鈉(SDS)、十二烷基肌氨酸鈉、甘氨酸,N,N,N,N-四甲基乙二胺(TEMED),均購自河南華美生物工程有限公司;BCA蛋白濃度測定試劑盒,購自北京索萊寶生物技術有限公司。
1.4 試驗方法
1.4.1 細菌外膜蛋白的提取 利用十二烷基肌氨酸鈉結合超速離心法提取Hps的OMP。參考空腸彎曲桿菌OMP的提取方法[15],前期超聲波裂解條件為:功率400W,超聲3s,間隙5s,超聲5min;降低超聲波功率和相對延長循環時間進一步優化裂解條件,功率分別為:300、200、100、50W,循環時間分別為:10、20、30、40min。多次嘗試后重新確定超聲波破碎條件。
1.4.2 外膜蛋白濃度的測定 根據BCA蛋白濃度測定試劑盒的檢測方法測定OMP濃度。方法如下:配制工作液,稀釋標準品,然后分別加20μL樣品到96孔板樣品孔中,再于各孔加入200μL BCA工作液,37℃放置15~30min后用酶標儀測定OD570,以標準蛋白質濃度為縱坐標,OD570為橫坐標建立標準曲線,根據標準曲線計算出蛋白濃度。待測樣品蛋白濃度=待測樣品OD值在標準曲線上對應的蛋白質濃度×外膜蛋白稀釋倍數。
1.4.3 外膜蛋白SDS-PAGE電泳 按常規方法操作,觀察結果并拍照。
2 結果與分析
2.1 外膜蛋白濃度測定結果 見圖1和表1。
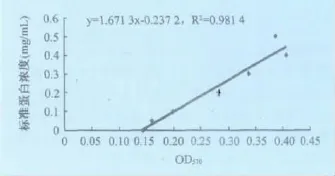
圖1 蛋白濃度標準曲線
由圖1可見,標準曲線的方程是:y=1.6173x-0.2372,R2=0.9814,依公式換算出4、5、12三種血清型OMP的平均濃度分別為0.163mg/mL、0.163 mg/mL、0.167mg/mL。
表1顯示3種血清型(4、5、12)的OMP的蛋白濃度差異不顯著(P>0.05)。可以說明,通過此方法提取這3種血清型的OMP的蛋白濃度差異不顯著,這個提取方法具有參考價值。
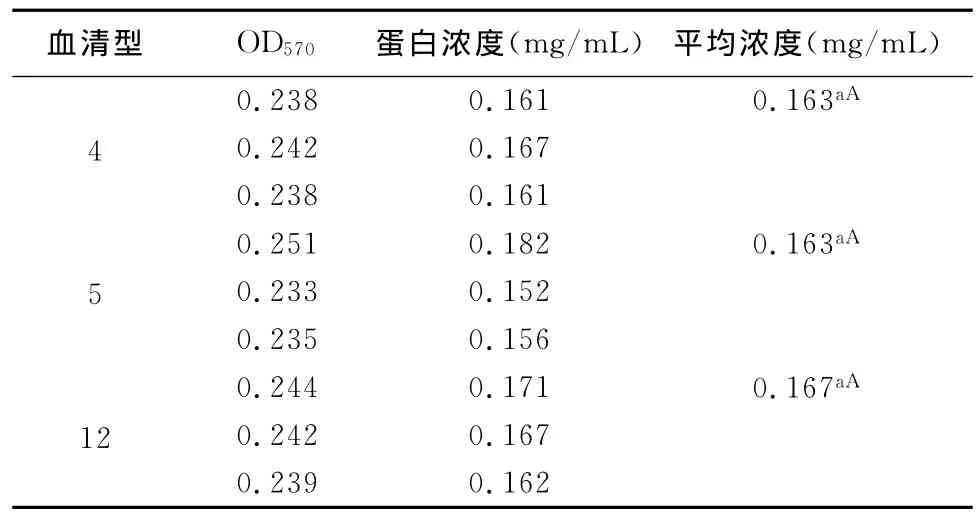
表1 待測蛋白OD570值及其對應的蛋白濃度
2.2 外膜蛋白SDS-PAGE凝膠電泳檢測結果 本試驗共提取了Hps的3個主要血清型(4、5、12)的OMP,前期參考空腸彎曲桿菌OMP的提取方法[15],凝膠電泳無清晰可見的蛋白條帶。后多次調整,將超聲波條件調整為功率96W超聲破碎時間3s,間隔時間5s,循環作用30min,凝膠電泳顯示蛋白條帶清晰。如圖3,每個血清型的OMP都有多個分子量大小不同的蛋白條帶,且條帶的粗細和顏色深淺不一致,說明每個血清型的OMP有多種不同的蛋白質構成,且每種蛋白質的含量都不同。不同血清型的SDS-PAGE圖譜有大小相同或相近的條帶,也有差距較大的條帶,如4型和5型Hps的OMP條帶都集中在分子質量大小60kDa~97.2 kDa之間,而12型Hps的OMP條帶則集中在分子質量大小66.4kDa~200kDa之間。4型 Hps的OMP條帶中,分子質量大小60kDa和62kDa為高表達蛋白;5型Hps的OMP條帶中,分子質量大小60kDa、62kDa和70kDa的蛋白質為高表達蛋白;12型Hps的OMP條帶中,分子質量大小70kDa、116kDa和200kDa的蛋白質為高表達蛋白。

圖2 探索超聲波條件試驗結果的SDS-PAGE分析圖

圖3 Hps 3種血清型(4、5、12)的外膜蛋白SDS-PAGE分析圖
3 討論
3.1 關于外膜蛋白的提取方法 常用的OMP提取方法主要有等密度梯度離心法、Sarkosyl法和碳酸鈉法,這些方法耗時長,設備儀器要求高,提取步驟繁多,同時很難嚴格地將同屬膜結構的質膜與外膜區分開來[7-9]。目前,對大腸桿菌OMP的提取一般采用超聲波裂解,再用膜裂解劑十二烷基肌氨酸(Sarkosyl)提取其 OMP組分[10-11],但有研究發現使用8%的Triton X-114處理3h能有效提高OMP的提取效率[9]。沙門菌外膜蛋白的提取,成進等[12]采用尿素、EDTA作為鰲合劑,粗提品再經過丙酮沉淀和硫酸銨分級沉淀進行提純,若需不同分子量的蛋白質組分,可在SDS-PAGE后用洗脫法制備;夏文浪等[13]在研究空腸彎曲菌67kDa OMP對淋巴細胞的多克隆激活作用時,首先將菌液超聲裂解,然后用40%飽和度的(NH4)2SO4沉淀,最后再用DEAE-52離子交換層析進一步提純。有研究顯示采用甘氨酸提取、SephadexG-75純化空腸彎曲菌28kDa~31kDa OMP系一種穩定可靠的分離層析方法[14]。本試驗參考空腸彎曲桿菌OMP的提取方法[15],采用超聲波裂解,再用膜裂解劑十二烷基肌氨酸提取其OMP組分。按照原來的超聲波裂解條件為:功率400 W,超聲3s,間隙5s,超聲5min,但是結果顯示,這樣的超聲波破碎條件所提取出來的OMP在SDS-PAGE凝膠電泳結果上沒有清晰可見的蛋白條帶。這可能是由于超聲波功率過大的原因。所以嘗試降低超聲波功率并相對延長循環時間的方法重新確定超聲波裂解條件為:功率96W超聲破碎時間3s,間隔時間5s,循環作用30min,SDS-PAGE凝膠電泳顯示蛋白條帶清晰,結果顯示良好。
3.2 關于外膜蛋白濃度的測定 用Bradford檢測方法測定副豬嗜血桿菌3種血清型(4、5、12),OMP的平均濃度分別為0.163mg/mL、0.163mg/mL、0.167mg/mL。標準方程的決定系數是R2=0.981 4,說明此次測定結果與真實值較接近,測定結果的準確性較高。測定OMP的濃度,對于進一步分析全菌中OMP的含量有重要作用,而OMP是Hps的毒力因子之一,是分析Hps致病性的重要因素之一。因此,測定OMP的濃度,也是推測Hps致病力強弱的重要依據。
3.3 關于SDS-PAGE凝膠電泳 本次SDS-PAGE凝膠電泳采用的是傳統的方法。結果顯示,每個血清型的OMP并不僅僅有一種蛋白質,而是有多種不同的蛋白質,且每種蛋白質的含量都不同,不同血清型Hps的OMP有分子量大小相同的蛋白,也有分子量大小不同的蛋白,且不同血清型副豬嗜血桿菌的膜蛋白結果有相似性。但各血清型膜蛋白的具體情況和差異還有待于進一步研究。分析OMP的分子質量大小,是進一步掌握OMP結構和組成的基礎,也是研究和分析OMP免疫功能的前提條件。
目前的大多數研究中,還是以全菌研究為主,也許是由于半菌的毒力不足以達到相應的毒力,進而影響到試驗結果[16]。某些細菌的不同血清型間有相同的OMP免疫原性,可以產生交叉保護作用,這不僅為開發OMP亞單位疫苗提供了理論基礎,而且為疾病的診斷提供了特異性抗原,今后必將成為細菌領域的研究重點之一。
[1] 陸承平.獸醫微生物學[M].4版.北京:中國農業出版社,2007:144-146.
[2] 萬世平,王建,葛菲菲,等.副豬嗜血桿菌主要毒力因子和致病機理的研究進展[J].畜牧與獸醫,2010,42(10):101-104.
[3] Handfield M,Levesque R C.Strategies for isolation of in vivo expressed genes from bacteria[J].FEMS Microbiol.Rev,1999,23:69-91.
[4] Morozumi T ,Nicolet J.Some antigenic properties ofHaemophilusparasuisand a proposal for serological classification[J].J Clin Microbiol,1986b,23(6):1022-1025.
[5] Kielstein P,Rapp Gabrielson V J.Designation of 15serovars ofHaemophilusparasuison the basis of immunodiffusion using heat stable antigen extract s[J].J Clin Microbiol,1992,30(4):862-865.
[6] Zhang L J,Xie J Y,Wang X E.Proteomic analysis of mouse liver plasema membrance,use of differential extraction to enrich hydrophobic membrance proteins[J].Proteomics,2005,5(17):4510-4524.
[7] Neidhardt L,Gasca S,Herrmann B G,etal.Large scale screen for genes controlling mammalian embroygenesis,using high-throughput gene expression analysis in mouse embryos[J].Mech Dev,2000,98(1-2):77-94.
[8] Ruiz A,Oliveira S,Torremorell M,etal.Outer membrane protein in strains ofHaemophilusparasuisrecovered from systemic and respiratory sites[J].J Clin Microbial,2001,39:1757-1762.
[9] 夏金蘭,歐陽敘東,張成桂,等.大腸桿菌外膜蛋白的分離及其雙向電泳圖譜的建立[J].現代生物醫學進展,2009,9(2):201-215.
[10]高崧,劉秀梵,張如寬.一種快速提取禽源性大腸埃希氏菌外膜蛋白的方法[J].微生物學通報,1996,23(2):122-124.
[11]Kapur V,White D G,Richard A,etal.0uter menbrane protein patterns mark clones of Escherichia coli O2and O78 strains that cause avian septicemia[J].Infection and Immunity,1992,60(4):1687-1691.
[12]成進,李文蓉,谷文喜,等.雞沙門氏菌外膜蛋白的免疫效果觀察[J].中國預防獸醫學報,2000,22(1):21-24.
[13]夏文浪,馬寶驪,黃冬生,等.空腸彎曲菌67kD外膜蛋白的提取及其對淋巴細胞的多克隆激活作用[J].中國免疫學雜志,1992,8 (1):14-17
[14]馮勝軍,孫萬邦,姚新生,等.空腸彎曲菌28kDa-31kDa外膜蛋白的初步提取及鑒定[J].中國衛生檢驗雜志,2005,15(2):129-131.
[15]曹江,賈振宇.蛋白組學與人類疾病研究[J].中國實驗診斷學,2001,5(5):277-279.
[16]張婧,張東霞,王玉.副豬嗜血桿菌研究進展[J].中國動物保健,2010(5):33.

