塞來昔布通過ERK1/2信號通路對肝癌細胞株SMMC-7721增殖、凋亡的影響
西安交通大學醫學院第一附屬醫院(西安710061) 李 琛 于 良
肝癌是臨床最常見的惡性腫瘤之一,其起病隱匿,病死率高,預后極差。肝癌在全球發病率呈逐步上升趨勢,但目前臨床尚無有效治療藥物。研究表明[1],長期服用非甾體類抗炎藥物可降低消化道惡性腫瘤的發生率。本研究觀察塞來昔布對肝癌SMMC-7721細胞增殖、凋亡及COX-2、VEGF和ERK1/2表達的影響,并探討該作用與ERK1/2信號通路之間的關系,為其用于肝癌的治療提供理論依據。
材料與方法
1 試劑和儀器 主要試劑:人肝癌細胞株SMMC-7721購自第四軍醫大學細胞所;塞來昔布購自美國希爾大藥廠;新生胎牛血清購自杭州四季青公司;二甲基亞砜(DMSO)、四氮噻唑鹽(MTT)、胰蛋白酶、瓊脂糖均購自美國Sigma公司;雙抗購自山東魯抗制藥公司;兔抗人COX-2、ERK1/2多克隆抗體、羊抗人VEGF多克隆抗體購自SantaCruz公司;Trizol購自美國Invitrogen公司;逆轉錄試劑盒購自美國Fermentas公司;SYBR?Premix Ex TaqTM試劑盒TaKa-Ra公司;PCR引物由上海生工公司合成。主要儀器:實時熒光定量PCR擴增儀購自美國 MJ公司;YCP-200CO2培養箱購自上海易亮醫療器械有限公司;電泳儀、轉移電泳槽和轉移電泳儀購自美國Bio-Rad公司;酶標儀(ELX800)購自美國BioTek公司;流式細胞儀購自BD公司。
2 細胞培養 人肝癌細胞株SMMC-7721置于含有10%的胎牛血清、100U/ml青霉素及100U/ml鏈霉素的DMEM培養基中,于37℃、5%CO2的培養箱內培養。倒置顯微鏡下觀察細胞的生長,待細胞鋪滿瓶底的80%時進行傳代。實驗選用對數生長期細胞。
3 細胞生長抑制實驗 采用MTT比色法。SMMC-7721細胞接種于96孔板,培養24h后加無血清培養液常規培養24h,換含塞來昔布的培養液,終濃度分別為0、25、50、75和100μmol/L,0μmol/L組為對照組。每濃度4個復孔。分別在加藥后24、48和72h后,避光下加入新配制的 20μl MTT(5mg/ml),置37℃、5%二氧化碳培養箱內培養4h,棄培養液,加入二甲基亞砜(DMSO),10min后酶標儀測490nm處吸光度(A)值,根據公式計算細胞生長抑制率(IR)。IR的計算公式為:IR(%)=(對照組A值-實驗組A值)/對照組A值×100%。以上實驗均重復3次。
4 流式細胞術檢測細胞凋亡 細胞生長至對數生長期時,倒掉舊的培養液。設對照組與實驗組共5個組別。孵箱內細胞培育48h后終止培養,胰酶消化后分別制成單細胞懸液。調整待測細胞密度為5×105個/ml后上機檢測。
5 RT-PCR檢測SMMC-7721細胞COX-2、VEGF和ERK1/2mRNA表達 取對數生長期的SMMC-7721細胞,按照5×105/孔接種于6孔板中,24h待細胞貼壁后,每孔分別加入不同濃度塞來昔布,不加入藥物的孔為對照組。細胞培養48h后,吸去培養液,PBS沖洗3次,用Trizol法提取細胞總RNA,按反轉錄反應試劑盒說明進行反轉錄為cDNA,以cDNA為模板PCR擴增COX-2、VEGF和ERK1/2mRNA,GAPDH 為內參。各自引物序列分別是:COX-2F:5’-TCAAGTCCCTGAGCATCTAC-3’R:5’-CATTCCTACCACCAGCAACC-3’,ERK1/2 F:5’-GGCTTTCTGACCGAGTATGTG-3’,R:5’-GGGTGTCTGTTCTTGTT AGGG-3’,VEGF F:5’-CCT GGT GGA CAT CTT CCA GGA GTA CC-3’R:5’-GAA GCT CAT CTC TCC TAT GTG CTG GC-3’,GAPDH F:5’-TCATCCCTGCCTCTACTG-3’R:5’-TGCTTCACCACCTTCTTG-3’。PCR反應條件為:94℃預變性5min,然后94℃變性30s,退火溫度56℃30s,72℃延伸40s,上述3步驟進行30個循環后,再94℃ 繼續延伸5min,置4℃ 保存。PCR產物進行瓊脂糖凝膠電泳,紫外凝膠成像系統拍照用Quantity One軟件對照片進行灰度值掃描,以目的條帶與其相應內參GAPDH的光密度比代表目的基因mRNA的相對水平,實驗重復3次。
6 Western blot法檢測 COX-2、VEGF和ERK1/2蛋白表達 收集各組細胞,用細胞裂解液裂解細胞并提取總蛋白。BCA法測蛋白濃度后,取40ug蛋白樣品進行10%SDS-聚丙烯酰胺凝膠電泳。將電泳后的蛋白轉移至硝酸纖維素膜,5%脫脂奶粉封閉1h后加入抗體孵育過夜。次日TBST洗膜后加入二抗,室溫1h后TBST洗膜3次。ECL浸泡后X片曝光,分析結果。所用內參為GAPDH。
7 統計學處理 所有數據以均數±標準差表示,采用SPSS 13.0軟件進行統計處理,應用單因素方差分析,以P<0.05作為差異有統計學意義標準。
結 果
1 不同濃度塞來昔布對SMMC-7721細胞增殖的影響 見附表。不同濃度塞來昔布處理SMMC-7721細胞24、48、72h后,用MTT法測定細胞增殖,與對照組相比,各實驗組A值均有所降低,其中100μmol/L組A值降低更為明顯;抑制率隨藥物濃度增高、作用時間的延長而增高,同一時間點不同濃度組的抑制率之間的差異有統計學意義(P<0.05)。表明塞來昔布能有效抑制SMMC-7721細胞的增殖,且抑制作用呈時間和劑量依賴性。
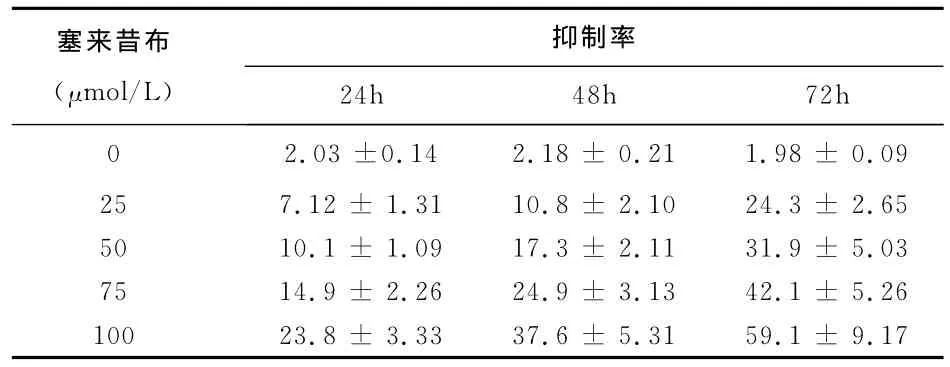
附表 細胞生長抑制試驗結果
2 塞來昔布對SMMC-7721細胞凋亡的影響見圖1。使用流式細胞術檢測細胞凋亡。流式細胞儀分析結果顯示,25、50、75和100μmol/L塞來昔布孵育SMMC-7721細胞后出現了明顯的凋亡,各實驗組的凋亡率與對照組相比,其差異有統計學意義(P<0.05);不同濃度塞來昔布處理后各組細胞凋亡率之間的差異有統計學意義(P<0.05),SMMC-7721細胞的凋亡率隨著塞來昔布濃度的增加而增加。
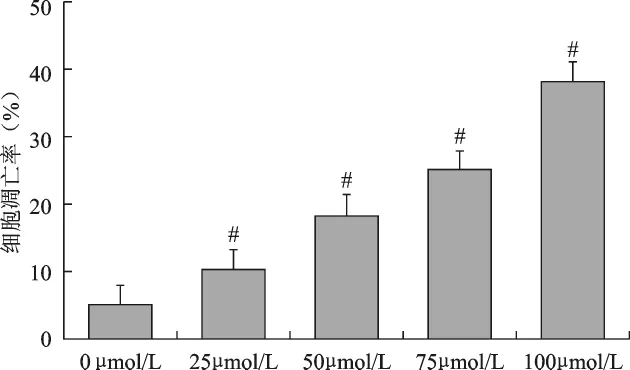
圖1 不同濃度塞來昔布對SMMC-7721細胞凋亡率的影響
3 塞來昔布對SMMC-7721細胞COX-2、VEGF和ERK1/2mRNA表達的影響 見圖2。不同濃度的塞來昔布(25、50、75和100μmol/L)作用于SMMC-7721細胞24h后,與對照組相比,COX-2、VEGF和ERK1/2mRNA的表達均明顯下調,差異有統計學意義(P<0.05),且隨塞來昔布濃度的增加,三者的表達均呈逐漸下調趨勢。

圖2 不同濃度塞來昔布對SMMC-7721細胞COX-2、VEGF和ERK1/2mRNA表達的影響
4 塞來昔布對SMMC-7721細胞COX-2、VEGF和ERK1/2蛋白表達的影響 見圖3。Western blot結果顯示,實驗組與對照組比較COX-2、VEGF和ERK1/2蛋白表達明顯下降,差異具有統計學意義(P<0.05);不同濃度塞來昔布組之間的差異也有統計學意義。
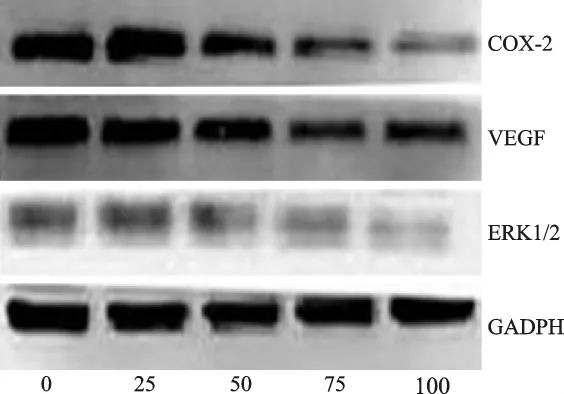
圖3 不同濃度塞來昔布對SMMC-7721細胞COX-2、VEGF和ERK1/2蛋白表達的影響
討 論
肝癌是目前臨床上最常見的惡性腫瘤之一,但缺乏有效防治藥物。臨床肝癌化療藥物的有效率均不足20%,因此,尋找高效低毒的藥物成為肝癌治療的熱點。塞來昔布是近年來出現的特異性COX-2抑制劑,Harris等[2]發現其具有預防乳腺癌發生的作用。隨后的研究發現,塞來昔布對胃癌、結腸癌、膽管癌、白血病、膀胱癌等多種惡性腫瘤細胞均有抑制生長和促進凋亡的作用[3-4]。在腫瘤侵襲、轉移的過程中,MAPK信號通路起著重要作用,其中ERK1/2信號途徑具有重要地位。ERK1/2對腫瘤的作用主要體現在促進細胞增殖方面,活化的ERK激酶可作用于其他信號轉導途徑的關鍵效應分子,調節細胞周期相關因子和凋亡分子的表達,最終促進細胞增殖和向惡性轉化。Schuierer等[5]人研究發現肝癌細胞中ERK1/2活性較正常細胞明顯增強。
本實驗以既往相關文獻報道塞來昔布能夠抑制腫瘤細胞增殖、誘導腫瘤細胞凋亡為依據,以塞來昔布能否抑制體外培養的SMMC-7721細胞增殖、誘導細胞凋亡為切入點,通過觀察塞來昔布對人肝癌SMMC-7721細胞增殖、凋亡及 COX-2、VEGF和 ERK1/2 mRNA和蛋白表達的影響,探討其可能機制。
本實驗通過不同濃度塞來昔布處理SMMC-7721細胞后發現,塞來昔布可抑制SMMC-7721細胞增殖,且呈時間和濃度依賴性。在此基礎上應用流式細胞儀檢測,發現不同濃度塞來昔布處理的SMMC-7721細胞出現了明顯的凋亡現象。這些結果與國內外的相關研究結果相一致[6-7]。
本實驗在觀察塞來昔布具有抑制肝癌SMMC-7721細胞增殖、誘導細胞凋亡作用的同時,對其機制作了進一步的探討。目前,COX-2抑制劑誘導腫瘤細胞凋亡的途徑主要有兩個方面,即COX-2依賴性途徑和非COX-2依賴性途徑。COX-2依賴性途徑主要包括通過抑制COX-2減少前列腺素合成,從而抑制腫瘤細胞增殖,促進腫瘤細胞凋亡[8-9]。非COX-2依賴性途徑抗腫瘤機制目前多家說法不一[10]。本實驗結果顯示,不同濃度的塞來昔布作用于SMMC-7721細胞后,其細胞中ERK1/2和VEGF的表達均明顯下調,且呈濃度依賴性,表明其作用機制可能與ERK1/2信號通路及抑制腫瘤新生血管形成有關。
綜上所述,本實驗證實了塞來昔布具有抑制肝癌SMMC-7721細胞增殖及誘導凋亡的作用,為臨床上治療肝癌提供了新的思路。同時揭示塞來昔布抑制肝癌SMMC-7721細胞增殖及誘導凋亡的作用機制除了與抑制COX-2的活性相關外,還可能與下調ERK1/2信號通路及抑制腫瘤新生血管形成有關,但具體分子機制仍需要進一步深入研究。
[1]Richter M,Weiss M,Weinberger I,et al.Growth inhibition and induction of apoptosis in colorectal tumor ells by cyclooxygenase inhibitors[J].Carcinogenesis,2001,22(1):7-25.
[2]Harris RE,Lhafie GA,bouissa H,et al.hemoprevention of breast cancer in rats by Celecoxib,cyclooxygenase 2inhibitor[J].Cancer Res,2000,60(8):101-2103.
[3]冉俊濤,周永寧,唐承薇,等.塞來昔布誘導人胃癌細胞凋亡控制新生血管形成[J].中華腫瘤雜志,2008,30(6):48-451.
[4]Muller AC,Adrick R,lsaesser SJ,et al.Importance of Bak for celecoxib-induced apoptosis[J].Iochem Pharma-co,2008,76(9):1082-1096.
[5]Schuierer MM,Aaille F,Weissm TS,et al.Raf kinase inhibitor protein is down regulated in hepatocellular carcinoma[J].On cot Rep,2006,16(3):51-456.
[6]Chen PY,Long QC.Effects of cyclooxygenase-2inhibitors on biological traits of nasopharyngeal a cells[J].Acta Pharmacol Sin,2004,25(7):43-949.
[7]Catalano A,Graciotti L,Rinaldi L,et al.P reclinical evaluation of the nonsteroidal anti inflammatory agent celecoxib on malignant mesotheliom a chemo prevention[J].Int J Cancer,2004,109(3):22-328.
[8]Basu GD,Pathangey LB,Tinder TL,et al.Mechanisms underlying the growth inhibitory effects of the cyclooxygenase-2inhibitor celecoxib in human breast cancer cells[J].Breast Cancer Res,2005,7(4):422-435.
[9]Naruse T,Nishida Y,Hosono K,et al.Meloxicam inhibits osteosarcoma growth,invasiveness and metastasis by COX-2-de-pendent and independent routes[J].Carcinogenesis,2006,27(3):84-592.
[10]Lee A,Frischer J,Serur A,et al.Inhibition of cyclooxygenase-2disrupts tumor vascular mural cell recruitment and survival signaling[J].Cancer Res,2006,66(4):4378-4384.

