螺旋藻優良藻株的選育
吳曉娟,鐘華,劉海燕,顧繼銳,羅國強
(通威股份有限公司,四川 成都,610041)
螺旋藻是一種多細胞的絲狀藍藻,屬藍藻門、藍藻綱、顫藻目、顫藻科、螺旋藻屬[1]。螺旋藻的蛋白質含量高達60% ~70%,氨基酸種類齊全,其中8 種營養必需氨基酸組成平衡,除蛋氨酸含量略低外,其他氨基酸的含量均超過了FAO 推薦的標準[2]。此外,螺旋藻還含有豐富的維生素、生物色素、微量元素、不飽和脂肪酸等物質[2],具有極高的營養和保健價值。因此,螺旋藻在醫藥保健、食品、飼料添加、水產養殖、化妝品、精細化工、廢水處理等方面得到廣泛的應用。
目前螺旋藻已進入大規模養殖和開發利用階段,養殖基地主要分布在中國、墨西哥、美國、泰國、日本、以色列等國家和地區。我國有螺旋藻養殖基地60 余家,養殖面積約7 500 000 m2,年產量約為9 600 t,年產值估計超過40 億元[3]。
但螺旋藻生產中仍存在著藻種混雜退化、生長慢、單位面積產量低、質量不穩定、加工程度低和產后的廢水難于處理等問題,嚴重阻礙螺旋藻產業的發展。在相同的培養條件下,不同的螺旋藻藻株的生長速度和營養物質的含量都會有差異[4-6]。目前國內外學者采用馴化、自然選擇、物理或化學誘變、基因工程等方法已篩選出一些新品系。譚桂英等[4]通過逐級稀釋法,獲得了不同形態大小的鈍頂螺旋藻藻絲體6 株,其中S6 具有個體大,易上浮,生長速度快(生長率0.2137),蛋白質含量高(69.1%),經海水馴化,能在海水中良好生長等特點。殷春濤等[5]等將5 個鈍頂螺旋藻品系進行單種分離和擴大培養,篩選出1 株耐高溫且溫度適應范圍廣(9 ~45 ℃)、蛋白質(63.37%)和不飽和脂肪酸含量高的優良螺藻品系。宋玉鳳等[6]通過富集和稀釋平板分離出9 株螺旋藻,篩選出1 株生長較快、藻體粗壯的螺旋藻藻種(SP06),在最佳條件下培養8 d 每升養殖水可收獲濕藻46 ~48 g。因此,在螺旋藻工業化生產中,篩選高產優質的螺旋藻藻種是當前提高螺旋藻產業發展的一個重大課題,也是提高產量和改善產品質量的基礎。
本研究考察了不同來源的5 株螺旋藻藻株在生長速率、光能利用率、上浮性、色素、蛋白質以及藻藍蛋白含量等的差異,以蛋白質含量和生長速率為評價指標,采用綜合評分法,篩選較為理想的螺旋藻藻株,以期獲得可供開發利用的螺旋藻株系,并提供篩選方法。
1 實驗材料與方法
1.1 藻種
螺旋藻:所用螺旋藻藻株為S1、S2、S3、S4、S5。其中S1、S5 分離自山東威海的極大螺旋藻,S2 為汕頭大學所贈的鈍頂螺旋藻,S3 為引自中國科學院武漢水生生物研究所的極大螺旋藻,S4 為引自中國科學院武漢水生生物研究所的鈍頂螺旋藻。
1.2 培養基
培養基為Zarrouk 配方[7]。
1.3 培養方法
將處于對數期的不同螺旋藻藻株接種到Zarrouk培養液中,以500 mL 的錐形瓶培養300 mL 螺旋藻液,在光照培養箱中靜置培養,調整接種密度OD5600.1,溫度30 ℃,光照強度7 000 Lx,光照周期L∶D=12 h∶12 h,每天搖動培養瓶4 次。
1.4 細胞濃度以及生物量的測定
取定量的藻液過濾到已知干重的濾膜上,用蒸餾水沖洗掉藻體上附著的鹽分,放入烘箱中經80 ℃烘干24 h,放在干燥皿中冷卻至少20 min 后,經電子天平稱重并減掉濾紙重量后,即得到藻細胞的生物量[8]。以新鮮培養基為空白,將藻液混勻后測定其560 nm 波長下的吸光度OD560,即得到藻細胞的濃度。
1.5 光能利用率
根據能量守恒定律確定藻細胞的能量轉換關系確定光能利用率Ψ 的計算[9]:
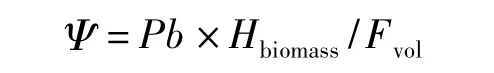
其中,Pb:單位體積增加干重;Hbiomass:藻細胞燃燒熱值;Fvol:單位體積接收的光能(球狀PAR 輻射測量儀測定光量子后計算)。
1.6 藻細胞蛋白質含量的測定
采用考馬斯亮藍法[10]。取一定量的藻液過濾,無菌水沖洗后進行冷凍干燥。精確稱取一定量的螺旋藻冷凍干燥粉,加1 mL 水用研缽進行研磨,然后置-20 ℃冰箱中冷凍后30 ℃解凍,然后再研磨,如此3次(直至顯微鏡下觀察全部細胞破碎為止),最后定容至20 mL,離心(5 500 r/min,10 min),取上清液。取樣品提取液0.1 mL 放入具塞試管中,加入0.9 mL蒸餾水稀釋10 倍,再加入5 mL 考馬斯亮藍G -250試劑,充分混合,放置5 min 后用1 cm 光徑比色杯在595 nm 下比色,記錄OD595,并通過標準曲線計算待測樣品提取液中蛋白質的含量。
1.7 藻膽蛋白的測定
精確稱取一定量的螺旋藻冷凍干燥粉,加入1 mL 磷酸緩沖液(含0.2 mol/L NaCl,pH 6.7),用研缽進行研磨,然后置-20 ℃冰箱中冷凍后30 ℃解凍,然后再研磨,如此3 次(直至顯微鏡下觀察全部細胞破碎為止),最后定容至20 mL,離心(5 500 r/min,10 min),取上清夜測定其吸收光譜,根據公式計算藻藍蛋白PC、別藻藍蛋白APC 含量,螺旋藻藻膽蛋白PBP 含量為藻藍蛋白PC、別藻藍蛋白APC 之和,然后再換算成單位質量藻粉的含量。
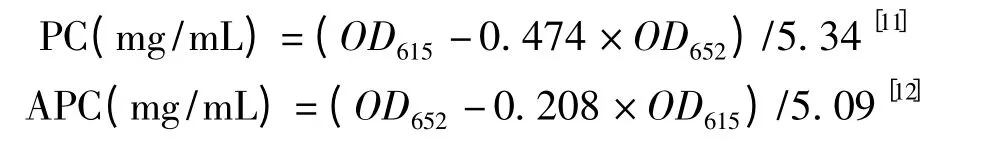
1.8 藻絲浮性
為了估算不同藻株藻絲的浮性,每個處理取8 ~10 mL 藻液倒進透明的試管中,混合均勻后在室內條件下靜置1 h。然后測定上下半部的吸光度(以水柱中線為準,位于以上的為上部,否則認為位于下部),分別記為DU 和DL,而藻絲的浮性(flotation activity,FA)則根據下式計算[13]:
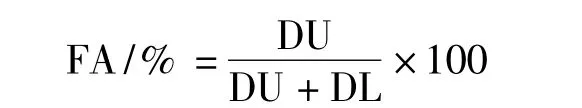
1.9 色素
取一定量的藻液過濾,加入純甲醇溶液置于4℃的低溫條件下過夜,離心(4 000 r/min,10 min),取上清液,用分光光度計測定特定波長的吸光度值,根據公式計算葉綠素a(chl a)含量、類胡蘿卜素(Car)含量,然后再換算成單位質量藻粉的色素含量。
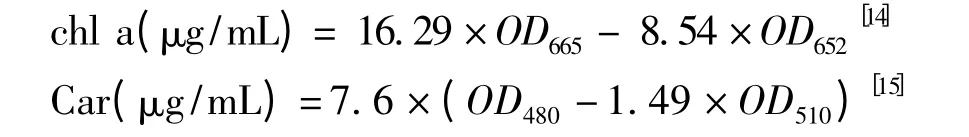
1.10 數據統計與分析
用單因素方差分析(one-way ANOVA)和多重比較中的T-test 對所得數據進行分析,以0.05 和0.01為差異顯著水平。
2 結果與分析
2.1 5 株螺旋藻的生長特性
各藻株均經過3 d 的延滯期后進入對數生長期,在培養的9 d 內,各藻株一直在快速地生長;各螺旋藻藻株S1、S2、S3、S4、S5,其吸光度值OD560從開始的0.1 分別上升至1.52、1.20、1.68、1.54、1.52,其中以S3 的吸光度值最高(圖1)。螺旋藻藻株S3 和S5 的生長速率最高,為0.11 g/(L·d),其次為S1,達到0.087 g/(L·d)(表1),其中S3、S5 的生長速率分別為S1、S2、S4 的1.22、1.57、1.38 倍,各組間差異極其顯著(One - way ANOVA,P<0.01)。吸光度值OD560、生長速率的高低反應了藻的生長繁殖快慢。從生長特性看,螺旋藻藻株S3、S5 的生長最快,具有生長優勢。

圖1 5 株螺旋藻藻株的生長曲線Fig.1 The growth curve of 5 Spirulina strains
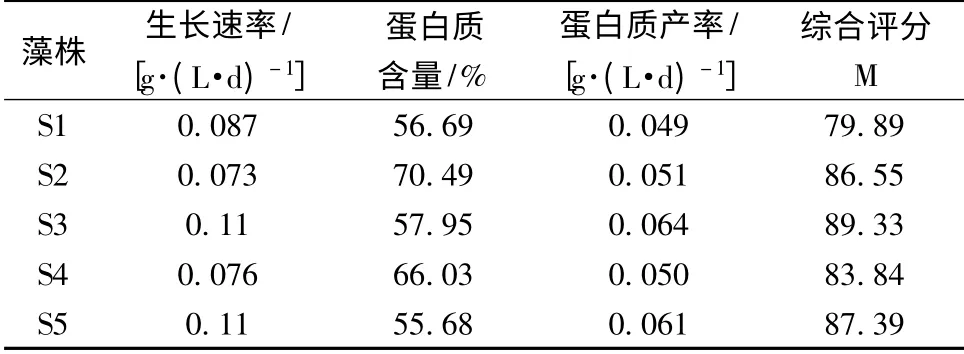
表1 5 株螺旋藻藻株的生長和蛋白質含量Table 1 The growth rate and protein content of 5 Spirulina strains
2.2 5 株螺旋藻的光能利用率
就光合自養生物而言,限制其生長量的最終的因素是光能利用率[16]。因此,光能利用率是衡量微藻生長能力的一個重要指標。本實驗中,各螺旋藻藻株S1、S2、S3、S4、S5,9 d 平均的光能利用率分別為1.51%、1.26%、1.91%、1.32%、1.94% (圖2)。其中S3、S5 光能利用率最高。這說明在這5 株螺旋藻中,螺旋藻S3、S5 可以更為有效的利用光能,降低工業化生產過程中的能耗成本。

圖2 5 株螺旋藻藻株的光能利用率Fig.2 The light use efficiency of 5 Spirulina strains
2.3 5 株螺旋藻的蛋白質含量
螺旋藻在食品、飼料添加等方面已得到廣泛的應用,主要是由于螺旋藻的蛋白質含量高達60% ~70%[2],而食用螺旋藻粉要求蛋白質含量高于55%[17],因此螺旋藻的蛋白質含量是評價其產品質量的最重要的參數之一。5 株螺旋藻的蛋白質含量比較見表1。由表1 可知,5 株螺旋藻的蛋白質含量均高于55%,其中螺旋藻藻株S2 在5 株螺旋藻藻種的含量最高,S4 次之,其他3 株無顯著差異。
2.4 5 株螺旋藻藻膽蛋白含量的比較
藻膽蛋白(PBP)是強熒光的色素-蛋白絡合物,是螺旋藻中重要的捕光色素蛋白,既可作為天然色素,也可以用作制造熒光探針的原料,還具有一些獨特的藥用價值。因此,螺旋藻中藻膽蛋白含量是衡量螺旋藻藻株性能的優良指標。螺旋藻藻膽蛋白主要為藻藍蛋白和別藻藍蛋白。各螺旋藻藻株S1、S2、S3、S4、S5 的藻藍蛋白(PC)含量分別為3.13%、2.94%、2.81%、3.37%、2.99%,別藻藍蛋白(APC)含量分別為3.08%、5.69%、5.28%、4.59%、4.77%(圖3)。藻藍蛋白、別藻藍蛋白含量最高的分別為S4、S2。S3 的藻藍蛋白含量最低,但其別藻藍蛋白含量較高。而藻膽蛋白含量最高的是S2,其次為S3。
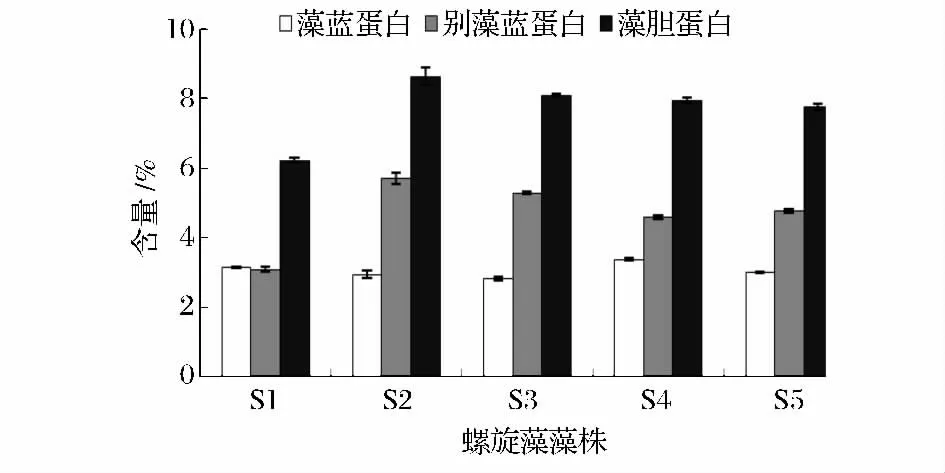
圖3 5 株螺旋藻藻株的藻膽蛋白含量Fig.3 The phycobiliprotein content of 5 Spirulina strains
2.5 5 株螺旋藻藻絲浮性的比較
藻絲浮性對藻絲調節其在水體中的位置非常重要,并且在其養殖采收過程中也扮演著重要的角色[18]。靜置前,各種螺旋藻的藻絲均勻分布于藻液中,而靜置1h 后,可看到有較多的藻絲互相纏繞,呈絮狀聚集于藻液的上層及液面。各螺旋藻藻株S1、S2、S3、S4、S5 的藻絲浮性分別為67.32%、70.69%、86.82%、64.17%、74.86%(圖4)。S3 的藻絲浮性分別是的1.29、1.23、1.35、1.16 倍,具有極其顯著的差異(T-test,P<0.01)。可見,在采收過程中S3 將更具有優勢。
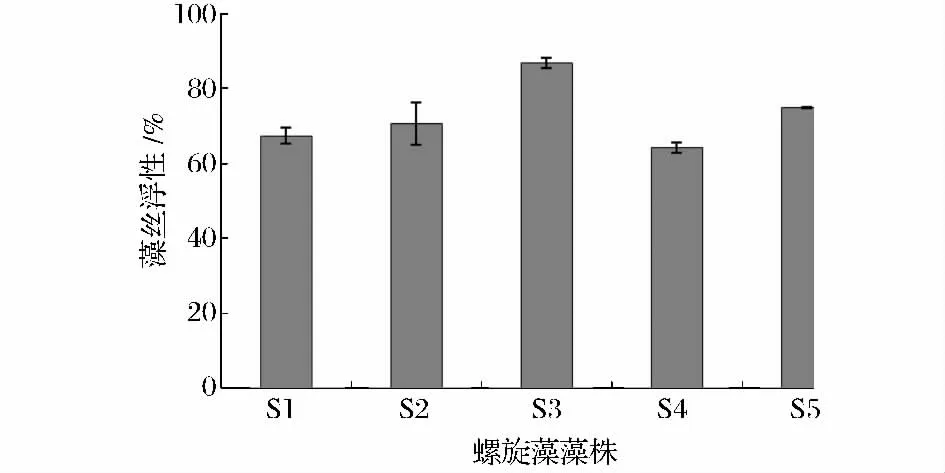
圖4 5 株螺旋藻藻株的藻絲浮性Fig.4 The flotation activity of 5 Spirulina strains
2.6 5 株螺旋藻色素含量的比較
螺旋藻細胞中的色素能作為食品、飼料和化妝品等的色素添加劑,可以使觀賞魚的體色鮮艷。因此,螺旋藻細胞中的色素積累是衡量螺旋藻藻株品質優劣的重要指標,而且食用螺旋藻粉要求類胡蘿卜素(Car)含量高于2 mg/g[17]。各螺旋藻藻株S1、S2、S3、S4、S5 的葉綠素a(chl a)含量分別為25.67、22.69、26.85、29.60、19.02 mg/g,類胡蘿卜素(Car)含量高于3.67 mg/g,均超過食用螺旋藻粉的國家標準要求(圖5)。其中葉綠素a(chl a)、類胡蘿卜素(Car)含量最高的分別為S4、S2,而S3 的葉綠素a(chl a)、類胡蘿卜素(Car)含量均較高。
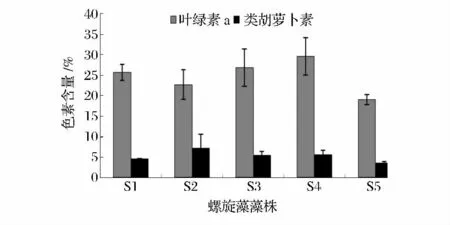
圖5 5 株螺旋藻藻株的色素含量Fig.5 The pigments content of 5 Spirulina strains
2.7 綜合評價
綜合評分法是當評價指標無法用統一的量綱進行定量分析時使用的一種分析方法。評分時以各指標的最大值為參照將數據進行歸一化,再給每個指標一個權重,權重的大小根據各指標在總體中的貢獻比重給定。參照胡海燕等[19]的綜合評價方法,以螺旋藻的蛋白質含量和生長速率為評價指標,權重系數分別設為0.6 和0.4,綜合評分M=0.6 ×蛋白質含量×100/蛋白質含量最大值+0.4 ×生長速率×100/生長速率最大值。
由表1 的實驗結果可以看出,螺旋藻S3 的生長速率、蛋白質產率和綜合評分最高,分別為0.11 g/(L·d)、0.064 g/(L·d)、89.33。因此,螺旋藻S3可以作為工業化培養的藻株。
3 結論
本實驗通過比較各螺旋藻株的主要生長性能和品質(生長、光能利用率、蛋白質、藻藍蛋白、別藻藍蛋白、藻絲浮性、色素),并采用綜合評分法,從5 株螺旋藻中篩選出1 株優質藻株S3。此藻株主要具有以下特點:
(1)生長速度快。體現在其OD560吸光度值、生長速率、光能利用率均最高。
(2)蛋白質、藻膽蛋白含量較高。干重的增長速率和蛋白質含量的綜合評分最高。
(3)上浮性好。由于藻絲螺旋形,互相纏繞,呈絮狀漂浮在水面,較易采收。
(4)色素含量較高。
[1] 胡鴻鈞,魏印心. 中國淡水藻類- 系統、分類及生態[M]. 北京:科學出版社,2006:142 -143.
[2] 陳峰,姜悅. 微藻生物技術[M]. 北京:中國輕工業出版社,1999:106 -111.
[3] 張學成,薛命雄. 我國螺旋藻產業的現狀和發展潛力[J]. 生物產業技術,2012,2(3):47 -53.
[4] 譚桂英,周百成.鈍頂螺旋藻優良品系S6 的生長特性及光合特性的研究[J].海洋學報(中文版),1993,15(3):89 -93.
[5] 殷春濤,龔小敏,胡鴻鈞,等.適合于咸寧基地生產的螺旋藻品系的選育研究[J]. 應用生態學報,1998,9(2):222 -224.
[6] 宋玉鳳,馬光庭,韓宇. 螺旋藻的分離篩選及培養條件的選擇[J]. 基因組學與應用生物學,2009,28(2):335-338.
[7] Zarrouk. Contribution a letude d’une cyanophycee,Influence de divers factours physiques. et chimiques sur la croissance et la phytosynthese doSpirulina maxima[M].Paris:University of Paris,1966.
[8] Gao Kun-sun,Ma Zeng-ling. Photosynthesis and growth ofArthrospira(Spirulina)platensis(Cyanophyta)in response to solar UV radiation,with special reference to its minor variant[J]. Environmental and Experimental Botany,2008,63(1 -3):123 -129.
[9] Hall D O,Cién Fernández F G,anizares Guerrero E,et al. Outdoor helical tubular photobioreactors for microalgal production:Modeling of fluid-dynamics and mass transfer and assessment of biomass productivity[J]. Biotechnology Bioengineering,2003,82(1):62 -73.
[10] 王孝平,邢樹禮. 考馬斯亮藍法測定蛋白含量的研究[J]. 天津化工,2009,23(3):40 -41.
[11] Siegelman H W,Chapman D J,Cole W J. The bile pigments of plants[J]. Biochemical Society Symposium,1968,28:107 -120.
[12] Bennet A,Bogard L. Complementary chromatic adaptation in a filamentous blue-green alga[J]. Journal of Cell Biology,1973,58(2):419 -435.
[13] Ma Zeng-ling,Gao Kun -sun. Photosynthetically active and UV radiation act in an antagonistic way in regulating buoyancy ofArthrospira(Spirulina)platensis(cyanobacterium)[J]. Environmental and Experimental Botany,2009,66(2):265 -269.
[14] Porra R J. The chequered history of the development and use of simultaneous equations determination of chlorophylls a and b[J]. Photosynthesis Research,2002,73(1-3):149 -156.
[15] Parsons T R,Strickland J D H. Discussion of spectrophotometric determination of marine plant pigments,with revised equation for ascertaining chlorophylls and carotenoids[J]. Journal of Marine Research,1963,21(3):155-163.
[16] 李師翁,李虎乾,張建軍. 小球藻大規模培養研究的進展[J]. 植物學通報,1998,15(4):45 -50.
[17] GB/T16919 -1997. 食用螺旋藻粉.
[18] Kim S G,Choi A,Ahn C Y,et al. Harvesting ofSpirulina platensisby cellular flotation and growth stage determination[J]. Letters in Applied Microbiology,2005,40(3):190 -194.
[19] 胡海燕,張靜,徐晶,等. 螺旋藻培養液中碳、氮、磷的優化及其效應評價[J]. 食品科技,2012,37(1):29 -33.

