缺氧預(yù)處理減輕內(nèi)質(zhì)網(wǎng)應(yīng)激所致的大鼠心肌微血管內(nèi)皮細(xì)胞損傷*
武旭東, 張振英, 王曉礽, 李玉珍, 劉秀華△
(中國(guó)人民解放軍總醫(yī)院 1門(mén)診部, 2病理生理研究室,北京 100853)
·論著·
缺氧預(yù)處理減輕內(nèi)質(zhì)網(wǎng)應(yīng)激所致的大鼠心肌微血管內(nèi)皮細(xì)胞損傷*
武旭東1△▲, 張振英2▲, 王曉礽2, 李玉珍2, 劉秀華2△
(中國(guó)人民解放軍總醫(yī)院1門(mén)診部,2病理生理研究室,北京 100853)
目的研究缺氧預(yù)處理(hypoxic preconditioning, HPC)對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress, ERS)所致的心肌微血管內(nèi)皮細(xì)胞(microvascular endothelial cells, MVECs)損傷的影響。方法以毒胡蘿卜素(thapsigargin, TG)誘導(dǎo)大鼠心肌MVECs ERS,以乳酸脫氫酶(lactate dehydrogenase, LDH)漏出和細(xì)胞凋亡率檢測(cè)細(xì)胞損傷, phalloidin-FITC熒光染色和內(nèi)質(zhì)網(wǎng)染色分別觀察細(xì)胞骨架和細(xì)胞內(nèi)質(zhì)網(wǎng)形態(tài)變化,雙向電泳-質(zhì)譜技術(shù)檢測(cè)TG作用后內(nèi)皮細(xì)胞蛋白質(zhì)譜表達(dá)變化,Western blotting技術(shù)檢測(cè)ERS相關(guān)的分子表達(dá)。結(jié)果TG劑量依賴性誘導(dǎo)MVECs LDH漏出和細(xì)胞凋亡,并出現(xiàn)內(nèi)質(zhì)網(wǎng)應(yīng)激分子鈣網(wǎng)蛋白(calreticulin, CRT)和葡萄糖調(diào)節(jié)蛋白78(glucose-regulated protein 78, GRP78)表達(dá)上調(diào);HPC減輕TG誘導(dǎo)的MVECs損傷,并可以抑制TG誘導(dǎo)的ERS相關(guān)分子的表達(dá)上調(diào)。結(jié)論HPC減輕內(nèi)質(zhì)網(wǎng)應(yīng)激所致的大鼠心肌MVECs損傷。
缺氧預(yù)處理; 微血管內(nèi)皮細(xì)胞; 內(nèi)質(zhì)網(wǎng)應(yīng)激
高血壓、動(dòng)脈粥樣硬化、冠心病等心血管疾病嚴(yán)重危及人類健康,血管內(nèi)皮功能障礙(endothelial dysfunction)是上述疾病的共同發(fā)病環(huán)節(jié),決定疾病的發(fā)生、發(fā)展和療效,改善內(nèi)皮功能已成為心血管疾病治療的新靶點(diǎn)[1],探索激發(fā)機(jī)體內(nèi)源性保護(hù)機(jī)制,增強(qiáng)內(nèi)皮細(xì)胞對(duì)缺血缺氧的抵抗能力,是減輕內(nèi)皮功能障礙的重要策略。缺血預(yù)處理是指預(yù)先短暫缺血可以延緩或減輕組織后續(xù)缺血/再灌注損傷的現(xiàn)象,可以被缺氧預(yù)處理(hypoxic preconditioning, HPC)所模擬[2],是迄今已知最強(qiáng)的內(nèi)源性保護(hù)現(xiàn)象之一,其機(jī)制涉及減輕細(xì)胞內(nèi)鈣超載、減輕氧化應(yīng)激、誘導(dǎo)內(nèi)源性保護(hù)蛋白合成等多種作用。內(nèi)質(zhì)網(wǎng) (endoplasmic reticulum, ER) 是細(xì)胞內(nèi)膜/分泌蛋白合成的細(xì)胞器,在調(diào)節(jié)蛋白質(zhì)正確折疊、鈣穩(wěn)態(tài)和細(xì)胞凋亡等方面具有重要作用。血管內(nèi)皮細(xì)胞具有高度發(fā)達(dá)的內(nèi)質(zhì)網(wǎng),對(duì)應(yīng)激刺激非常敏感,缺血、缺氧等多種因素均可以誘導(dǎo)內(nèi)質(zhì)網(wǎng)未折疊/錯(cuò)誤折疊蛋白質(zhì)的聚集和鈣穩(wěn)態(tài)破壞等功能紊亂狀態(tài),即內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress, ERS)。毒胡蘿卜素(thapsigargin, TG)通過(guò)抑制內(nèi)質(zhì)網(wǎng)鈣-ATPase、排空內(nèi)質(zhì)網(wǎng)鈣離子誘導(dǎo)細(xì)胞嚴(yán)重內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)。長(zhǎng)期或過(guò)度內(nèi)質(zhì)網(wǎng)應(yīng)激觸發(fā)C/EBP同源蛋白[CCAAT/enhancer-binding protein (C/EBP) homologous protein, CHOP]、caspase-12等內(nèi)質(zhì)網(wǎng)相關(guān)細(xì)胞死亡途徑,是缺血再灌注損傷、動(dòng)脈粥樣硬化、糖尿病等[3]疾病的重要發(fā)病機(jī)制。CHOP是含有169(人)或168(嚙齒類)個(gè)氨基酸殘基的分子量為29 kD的蛋白,內(nèi)質(zhì)網(wǎng)應(yīng)激時(shí)CHOP在轉(zhuǎn)錄水平上被誘導(dǎo),其過(guò)表達(dá)可導(dǎo)致生長(zhǎng)停滯和細(xì)胞凋亡。研究證實(shí)HPC通過(guò)調(diào)動(dòng)內(nèi)源性保護(hù)機(jī)制減輕鈣超載、氧化應(yīng)激等病理過(guò)程而發(fā)揮細(xì)胞保護(hù)作用[4],但是HPC是否可以直接抑制過(guò)度ERS、減輕CHOP介導(dǎo)的凋亡而發(fā)揮細(xì)胞保護(hù)作用尚不清楚。本實(shí)驗(yàn)在原代培養(yǎng)大鼠心肌微血管內(nèi)皮細(xì)胞(microvascular endothelial cells, MVECs)模型上,采用ERS誘導(dǎo)劑TG誘導(dǎo)ERS,研究HPC對(duì)ERS 致MVECs損傷的影響及其機(jī)制。
材 料 和 方 法
1主要試劑
M199培養(yǎng)基為Gibco產(chǎn)品;內(nèi)皮細(xì)胞生長(zhǎng)支持物(endothelial cell growth supplement, ECGS)、Ⅰ型膠原酶、FITC-albumin、phalloidin-FITC、乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)、羥乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid, HEPES)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、Triton X-100、十二烷基硫酸鈉(sodium dodecyl sulfate, SDS)、釩酸鈉(Na2VO4)、丙烯酰胺、甲叉丙烯酰胺、二硫蘇糖醇(dithiothreitol, DTT)、leupeptin、四甲基乙二胺(tetramethylethylenediamine, TEMED)和過(guò)硫酸胺(ammonium persulfate, APS)均為Sigma產(chǎn)品;蛋白電泳分子量(7~175 kD)標(biāo)記為Bio-Rad產(chǎn)品;總RNA提取試劑盒(DP419)、cDNA第1鏈合成試劑盒(KR104)、2× Taq PCR MasterMix(KT201)、100 bp DNA Ladder (MD109)和電泳級(jí)瓊脂糖(RT101)均購(gòu)自北京天根生化科技有限公司;兔抗人鈣網(wǎng)蛋白(calreticulin, CRT; SPA-600)和兔抗大鼠葡萄糖調(diào)節(jié)蛋白78(glucose-regulated protein 78, GRP78; SPA-826)多克隆抗體購(gòu)自Stressgen;兔抗人磷酸甘油醛脫氫酶(glyceraldehydes-3-phosphate dehydrogenase, GAPDH; Sc-25778)、兔抗小鼠CHOP(Sc-575)、兔抗人Bax(Sc-493)和兔抗人Bcl-2(Sc-783)多克隆抗體和增強(qiáng)化學(xué)發(fā)光(enhanced chemiluminescence, ECL;Sc-2048)試劑盒均購(gòu)自Santa Cruz;辣根過(guò)氧化酶標(biāo)記山羊抗兔(80259)和山羊抗小鼠IgG(79659)購(gòu)自Jackson ImmunoResearch;TG(586005)購(gòu)自Israel Calbiochem;乳酸脫氫酶(lactate dehydrogenase, LDH)測(cè)定試劑盒為南京建成生物工程研究所產(chǎn)品;Annexin V-FITC細(xì)胞凋亡檢測(cè)試劑盒購(gòu)自南京凱基生物工程公司;內(nèi)質(zhì)網(wǎng)形態(tài)染色試劑盒購(gòu)自上海杰美基因醫(yī)藥科技有限公司。固相pH梯度(immobilized pH gradient, IPG) buffer (pH 3~10)、 Destreak Reagent、低分子量marker、上樣濾紙和IPG干膠條(pH 3~10)為Amersham Biosciences產(chǎn)品;蛋白酶抑制劑(cocktail tablets)為Roche產(chǎn)品;碘乙酰胺為Acros organics產(chǎn)品;乙腈(色譜級(jí))為J. T. Baker產(chǎn)品;三氟乙酸(trifluoracetic acid,TFA)為Merck產(chǎn)品;α-氰基-4-羥基肉桂酸(α-cyano-4-hydroxycinnamic acid,CHCA;質(zhì)譜基質(zhì))購(gòu)自Bruker。其余化學(xué)試劑為國(guó)產(chǎn)分析純產(chǎn)品。
2心肌微血管內(nèi)皮細(xì)胞原代培養(yǎng)及分組
根據(jù)本室建立的大鼠MVECs培養(yǎng)方法進(jìn)行培養(yǎng)[5]。大鼠頸椎脫臼快速處死后,無(wú)菌操作取出大鼠心臟,去除心房、右心室以及心內(nèi)膜和心外膜等組織后;剪碎心肌組織,0.1% I型膠原酶振蕩消化10 min,繼而0.1%胰蛋白酶消化10 min,重復(fù)消化1次后收集消化液,用100 μm濾網(wǎng)過(guò)濾,收集濾液,室溫下1 500 r/min離心10 min收集血管段,用M199培養(yǎng)液(新生牛血清20%,ECGS 0.02 g/L,谷氨酰胺2 mmol/L,青霉素1×105U/L,鏈霉素100 mg/L)懸浮血管段,于37 ℃、5%CO2培養(yǎng)箱中孵育4 h后換液,以后每3 d換培養(yǎng)液1次直至細(xì)胞單層融合后進(jìn)行傳代培養(yǎng)。以內(nèi)皮細(xì)胞特異性表達(dá)的黏附分子和在體內(nèi)皮細(xì)胞完整性標(biāo)志分子VE-cadherin 抗體(Santa Cruz) 進(jìn)行細(xì)胞免疫熒光染色,鑒定培養(yǎng)的心肌MVECs,其純度為90%以上。細(xì)胞按1×104/cm2傳代用于細(xì)胞骨架染色和內(nèi)質(zhì)網(wǎng)形態(tài)測(cè)定;按5×104/cm2進(jìn)行傳代用于其它各項(xiàng)測(cè)定。同步化處理24 h后,隨機(jī)分為下列各組:(1) 正常對(duì)照組(control):細(xì)胞常規(guī)培養(yǎng)至實(shí)驗(yàn)結(jié)束;(2) 內(nèi)質(zhì)網(wǎng)應(yīng)激組(TG組):向培養(yǎng)液內(nèi)加入TG(終濃度分別為0.1、0.2、0.5、1 μmol/L),置于細(xì)胞培養(yǎng)箱內(nèi)常規(guī)培養(yǎng)24 h結(jié)束實(shí)驗(yàn);(3) HPC組:按照本室報(bào)道的方法[6]將細(xì)胞置于缺氧倉(cāng)內(nèi),通入95% N2-5% CO2混合氣20 min后,常規(guī)培養(yǎng)24 h結(jié)束試驗(yàn);(4) HPC+TG組:按照步驟(3)進(jìn)行HPC后,向培養(yǎng)液內(nèi)加入0.5 μmol/L TG 孵育24 h結(jié)束實(shí)驗(yàn)。
3培養(yǎng)基LDH活性和細(xì)胞凋亡率檢測(cè)
實(shí)驗(yàn)結(jié)束后收集各組細(xì)胞培養(yǎng)基,參照LDH試劑盒操作說(shuō)明進(jìn)行LDH活性測(cè)定。0.2%胰蛋白酶收集MVECs后,按照試劑盒說(shuō)明分別加入Annexin V和PI,室溫孵育15 min后,流式細(xì)胞儀(Becton-Dickinson)檢測(cè)細(xì)胞凋亡率變化。
4細(xì)胞通透性檢測(cè)
MVECs按1×105/cm2接種于鋪有1%明膠的雙層通透的培養(yǎng)皿(Transwell)頂層小室微孔膜上(直徑6.5 mm,孔徑為3 mm),待細(xì)胞長(zhǎng)至融合,按上述實(shí)驗(yàn)分組處理細(xì)胞后,參照Gillrie等[7]報(bào)道方法進(jìn)行通透性測(cè)定:每個(gè)雙層小室的頂室加入100 μL (終濃度250 mg/L) FITC-albumin, 37 ℃孵育4 h后,分別取頂室培養(yǎng)液20 μL和底室培養(yǎng)液100 μL于96孔板內(nèi),熒光酶標(biāo)儀測(cè)定其熒光強(qiáng)度。內(nèi)皮細(xì)胞單層對(duì)白蛋白的通透性采用通透率表示:通透率(%)=底室熒光強(qiáng)度/(底室熒光強(qiáng)度+頂室熒光強(qiáng)度),底室和頂室熒光強(qiáng)度分別采用相應(yīng)體積校正。
5細(xì)胞骨架染色
參照Z(yǔ)hang等[8]報(bào)道的方法,MVECs種于激光共聚焦專用培養(yǎng)皿(Mattek),實(shí)驗(yàn)結(jié)束后PBS洗滌2次,2.5%戊二醛固定30 min,1%牛血清白蛋白封閉30 min后,加入phalloidin-FITC(終濃度5 mg/L)室溫孵育1 h,PBS洗滌3次后加入DAPI標(biāo)記的封片劑,在激光掃描共聚焦顯微鏡(FV1000, Olympus)下觀察并采集圖像。
6雙向電泳-質(zhì)譜分析
MVECs總蛋白質(zhì)提取及雙向電泳-質(zhì)譜分析按照本室以往報(bào)道方法進(jìn)行[5], Bradford法蛋白定量后分裝、-70 ℃保存。參照改進(jìn)的膠內(nèi)加樣方法,上樣量為1 mg蛋白,平衡后的一向電泳后的IPG膠條置于二向電泳儀(Amersham Pharmacia)上進(jìn)行SDS-PAGE。凝膠常規(guī)固定、考馬斯亮藍(lán)染色。圖像掃描后利用Image Master 2D Elite圖像分析(Amersham Pharmacia)軟件進(jìn)行分析。選取各組凝膠中Volume值[即蛋白點(diǎn)的面積(area)與灰度值(intensity)的積分]相差≥2.0倍的蛋白斑點(diǎn),膠內(nèi)酶切后進(jìn)行質(zhì)譜分析,經(jīng)Bruker Daltonics Bio Tools 2.2軟件處理后,采用Mascot軟件在NCBI nr數(shù)據(jù)庫(kù)中進(jìn)行檢索。
7RT-PCR
按照試劑盒操作說(shuō)明提取培養(yǎng)內(nèi)皮細(xì)胞總RNA,兩步法行RT-PCR,總RNA逆轉(zhuǎn)錄參照cDNA第1鏈合成試劑盒操作說(shuō)明,各目的基因上、下游引物(由北京三博遠(yuǎn)志生物技術(shù)公司合成)見(jiàn)表1,PCR擴(kuò)增反應(yīng)結(jié)束后取5 μL PCR產(chǎn)物進(jìn)行1.5% 瓊脂糖凝膠電泳,電泳圖像采用Image-Pro Plus 圖像分析軟件(Version 4.1)分析平均吸光度值,以目的片段和GAPDH的平均吸光度比值反映目的基因mRNA的相對(duì)水平。

表1 PCR引物序列
GRP78: glucose-regulated protein 78; CRT: calreticulin; CHOP: C/EBP homologous protein.
8Westernblotting檢測(cè)
按本室以往報(bào)道的方法[5]提取MVECs總蛋白,Bradford法蛋白定量后分裝、-70 ℃保存。取上述蛋白提取液上清(含蛋白60 μg)進(jìn)行SDS-PAGE(10%分離膠),將電泳分離后的蛋白質(zhì)電轉(zhuǎn)移至硝酸纖維素膜上,經(jīng)10%脫脂奶粉封閉后分別加入CRT(1∶1 000)、GRP78(1∶1 000)、CHOP(1∶200)、Bax(1∶200)、Bcl-2(1∶200)、GAPDH(1∶500)抗體,室溫孵育4 h,洗膜后以相應(yīng)的Ⅱ抗室溫孵育1 h。ECL法顯影后暗室X光膠片曝光,采用Image-Pro Plus 圖像分析軟件(Version 4.1)分析蛋白條帶的積分吸光度值(integral absorbance,IA),IA=平均吸光度值×面積,以目的蛋白IA值/GAPDHIA值的比值反映目的蛋白相對(duì)水平。
9內(nèi)質(zhì)網(wǎng)形態(tài)染色
細(xì)胞接種于激光共聚焦專用培養(yǎng)皿,實(shí)驗(yàn)結(jié)束后按照內(nèi)質(zhì)網(wǎng)形態(tài)染色試劑盒說(shuō)明操作。染色后細(xì)胞在激光掃描共聚焦顯微鏡(FV1000, Olympus)下觀察并采集圖像。
10統(tǒng)計(jì)學(xué)處理
采用SPSS 13.0統(tǒng)計(jì)軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行分析,數(shù)據(jù)用均數(shù)±標(biāo)準(zhǔn)差(mean±SD) 表示,多組間比較應(yīng)用單因素方差分析(One-way ANOVA),組間兩兩比較應(yīng)用Student-Newman-Keuls檢驗(yàn),以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
1內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs損傷
采用不同濃度內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)劑TG作用培養(yǎng)MVECs,培養(yǎng)基LDH活性和細(xì)胞凋亡率測(cè)定檢測(cè)TG對(duì)MVECs損傷的影響,結(jié)果發(fā)現(xiàn)TG劑量依賴性地誘導(dǎo)培養(yǎng)基LDH活性和細(xì)胞凋亡率增加,見(jiàn)圖1。與正常對(duì)照組相比,0.1 μmol/L TG 誘導(dǎo)MVECs培養(yǎng)基LDH活性增加55.6% (P<0.05),但細(xì)胞凋亡率無(wú)顯著變化。0.2 μmol/L TG 誘導(dǎo)MVECs凋亡率較正常對(duì)照組增加11.8% (P<0.05),隨著TG濃度增加,LDH活性和細(xì)胞凋亡率劑量依賴性地增加。此外,1 μmol/L TG誘導(dǎo)MVECs損傷較為嚴(yán)重,培養(yǎng)基LDH活性和細(xì)胞凋亡率較0.5 μmol/L TG組分別增加29.5% (P<0.05)和11.1% (P<0.05)。故采用0.5 μmol/L TG 組誘導(dǎo)MVECs損傷進(jìn)行下述實(shí)驗(yàn)。
2HPC減輕內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的MVECs損傷
采用0.5 μmol/L TG誘導(dǎo)MVECs顯著損傷,低氧30 min復(fù)氧24 h進(jìn)行HPC后觀察MVECs損傷變化,結(jié)果發(fā)現(xiàn)內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs顯著損傷,TG組培養(yǎng)基LDH活性和細(xì)胞凋亡率分別較對(duì)照組增加70.3%(P<0.05)和12.37%(P<0.05),HPC可顯著抑制TG誘導(dǎo)的微血管內(nèi)皮細(xì)胞損傷,HPC+TG組LDH活性和細(xì)胞凋亡率分別較TG組降低21.6%(P<0.05)和8.58%(P<0.05),并且細(xì)胞凋亡率與對(duì)照組無(wú)顯著差異(P>0.05)。單純HPC對(duì)MVECs無(wú)顯著損傷,見(jiàn)圖2。

Figure 1. Effect of different doses of TG on MVECs injury. A:LDH activity in MVECs medium; B: apoptotic rate of MVECs. Mean±SD.n=4.*P<0.05vs0 μmol/L;#P<0.05vs0.5 μmol/L.
圖1不同濃度TG對(duì)MVECs損傷的影響

Figure 2. Effect of HPC on TG-induced MVECs injury.A: LDH activity in MVECs medium; B: apoptotic rate of MVECs. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsTG.
圖2HPC對(duì)TG誘導(dǎo)的MVECs損傷的影響
3HPC減輕內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的MVECs通透性增加和細(xì)胞骨架破壞
FITC-albumin 熒光標(biāo)記技術(shù)發(fā)現(xiàn),內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs通透性顯著增加,TG組細(xì)胞通透性較對(duì)照組增加92.5% (P<0.05),HPC顯著降低TG誘導(dǎo)的細(xì)胞通透性增加,HPC+TG組細(xì)胞通透性較TG組降低13.9% (P<0.05),但細(xì)胞通透性仍較對(duì)照組增加65.8%(P<0.05)。單純HPC對(duì)微血管內(nèi)皮細(xì)胞通透性無(wú)顯著影響,見(jiàn)圖3A。與MVECs通透性改變一致,內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs細(xì)胞骨架顯著破壞,TG組肌原纖維斷裂,排列紊亂,無(wú)明顯的應(yīng)力纖維,細(xì)胞骨架內(nèi)出現(xiàn)空泡。HPC顯著減輕TG誘導(dǎo)的細(xì)胞骨架破壞,肌原纖維排列整齊,無(wú)顯著斷裂和空泡形成,與對(duì)照組無(wú)顯著差異,見(jiàn)圖3B,提示HPC通過(guò)減輕細(xì)胞骨架破壞進(jìn)而發(fā)揮細(xì)胞保護(hù)作用。

Figure 3. Effects of HPC on permeability and cytoskeletal structure in MVECs treated with TG.A: permeability of MVECs; B: cytoskeletal structure in MVECs. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsTG.
圖3HPC對(duì)TG誘導(dǎo)的MVECs通透性和細(xì)胞骨架的影響
4TG誘導(dǎo)MVECs蛋白質(zhì)表達(dá)譜變化
雙向電泳-質(zhì)譜技術(shù)發(fā)現(xiàn)TG作用后MVECs中7種蛋白質(zhì)出現(xiàn)明顯差異表達(dá),與正常對(duì)照組比較,TG組6種蛋白質(zhì)表達(dá)上調(diào),1種蛋白質(zhì)表達(dá)下調(diào)。7種蛋白質(zhì)的序列號(hào)、蛋白名稱和主要功能見(jiàn)表2。其中TG誘導(dǎo)MVECs細(xì)胞內(nèi)質(zhì)網(wǎng)應(yīng)激分子GRP78和蛋白質(zhì)二硫鍵異構(gòu)酶相關(guān)蛋白3(protein disulfide isomerase-associated 3,PDIA3)顯著升高,其差異圖像和肽質(zhì)量指紋圖譜見(jiàn)圖4。

Figure 4. Proteomic profiles of MVECs treated with or without TG.A: differential expression of PDIA3 and GRP78 in MVECs; B: peptide mass fingerprint of PDIA3;C: peptide mass fingerprint of GRP78.
圖4TG誘導(dǎo)的MVECs蛋白質(zhì)譜變化
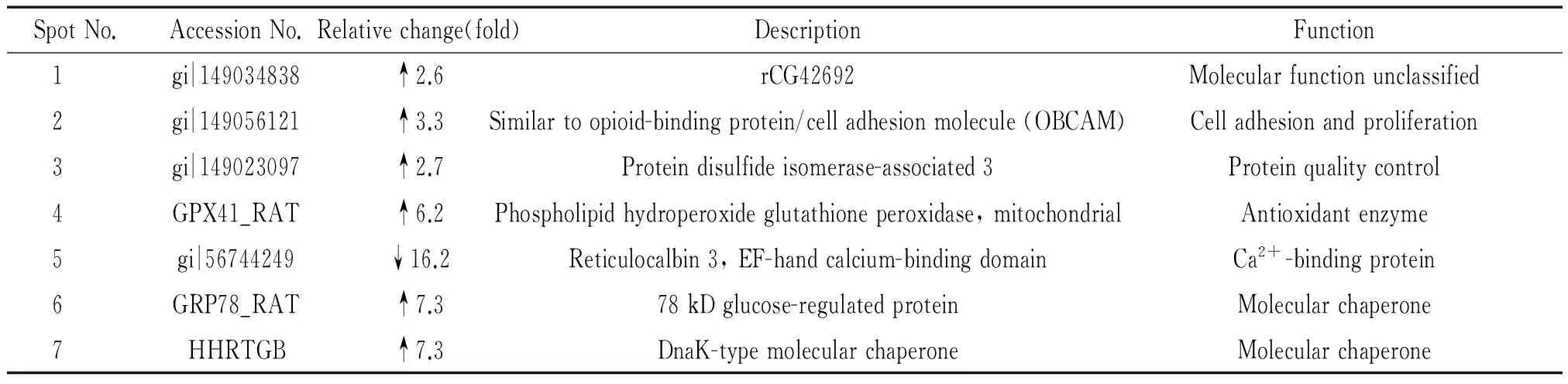
表2 質(zhì)譜分析后7個(gè)蛋白點(diǎn)Mascot檢索結(jié)果
↑: increased in TG groupvscontrol group; ↓: decreased in TG groupvscontrol group.
5HPC抑制MVECsCHOP介導(dǎo)的內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)凋亡途徑
5.1內(nèi)質(zhì)網(wǎng)形態(tài)的改變 采用內(nèi)質(zhì)網(wǎng)特異性染料Dapoxyl標(biāo)記MVECs內(nèi)質(zhì)網(wǎng),激光共聚焦顯微鏡觀察顯示正常MVECs 內(nèi)質(zhì)網(wǎng)均勻分布在核周,無(wú)空泡出現(xiàn);內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)劑TG誘導(dǎo)MVECs 內(nèi)質(zhì)網(wǎng)形態(tài)顯著受損,熒光顆粒分布不均、濃集,并有空泡形成;HPC顯著抑制TG誘導(dǎo)的內(nèi)質(zhì)網(wǎng)損傷,熒光顆粒分布均勻,無(wú)空泡形成,與正常對(duì)照組無(wú)顯著差異,見(jiàn)圖5A。
5.2內(nèi)質(zhì)網(wǎng)應(yīng)激分子CRT和GRP78表達(dá)的改變 采用RT-PCR和Western blotting技術(shù)檢測(cè)內(nèi)質(zhì)網(wǎng)應(yīng)激標(biāo)志性分子CRT和GRP78的表達(dá)發(fā)現(xiàn),TG誘導(dǎo)MVECs CRT和GRP78表達(dá)顯著增加,TG組CRT mRNA和蛋白表達(dá)分別較對(duì)照組增加46.2% (P<0.05)和71.8% (P<0.05),GRP78 mRNA和蛋白表達(dá)分別較對(duì)照組增加46.7% (P<0.05)和44.4% (P<0.05)。HPC顯著抑制CRT 蛋白表達(dá),HPC+TG組CRT蛋白表達(dá)較TG組降低20.7% (P<0.05),但對(duì)CRT mRNA表達(dá)和GRP78 表達(dá)無(wú)顯著抑制。單純HPC可促進(jìn)CRT表達(dá)增加,HPC組CRT mRNA和蛋白表達(dá)分別較對(duì)照組增加32.2% (P<0.05)和24.2%(P<0.05),但對(duì)GRP78 表達(dá)無(wú)顯著影響,見(jiàn)圖5B、C。
5.3CHOP相關(guān)凋亡途徑變化 TG組CHOP mRNA和蛋白表達(dá)分別較對(duì)照組增加29.5%(P<0.05)和84.3%(P<0.05),HPC對(duì)TG誘導(dǎo)的CHOP mRNA表達(dá)無(wú)顯著影響,但顯著抑制TG誘導(dǎo)的CHOP表達(dá)增加,HPC+TG組CHOP蛋白水平較TG組降低35.6%(P<0.05)。單純HPC對(duì)MVECs CHOP表達(dá)無(wú)顯著影響,見(jiàn)圖6。Bax是重要的促凋亡蛋白,而B(niǎo)cl-2是重要的抑凋亡蛋白,Bax/Bcl-2比值反映HPC對(duì)TG誘導(dǎo)的MVECs損傷的影響。TG誘導(dǎo)的MVECs Bax/Bcl-2比值顯著增加,TG組Bax/Bcl-2比值mRNA和蛋白水平分別較對(duì)照組增加181.5%(P<0.05)和107.5%(P<0.05),HPC顯著抑制TG誘導(dǎo)的Bax/Bcl-2比值增加,HPC+TG組Bax/Bcl-2比值mRNA和蛋白水平分別較TG組降低76.1%(P<0.05)和40.4%(P<0.05)。單純HPC對(duì)內(nèi)皮細(xì)胞Bax/Bcl-2比值無(wú)顯著影響,見(jiàn)圖7。上述結(jié)果提示HPC可能通過(guò)抑制CHOP介導(dǎo)的內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)凋亡途徑而發(fā)揮細(xì)胞保護(hù)作用。
討 論
內(nèi)皮功能障礙是高血壓、動(dòng)脈粥樣硬化、冠心病等疾病的共同發(fā)病環(huán)節(jié),決定疾病的發(fā)生、發(fā)展和療效。心肌微血管內(nèi)皮細(xì)胞在參與物質(zhì)交換、防止血小板聚集和血栓形成等方面具有重要作用,而且通過(guò)分泌活性物質(zhì)直接影響心肌細(xì)胞。微血管內(nèi)皮細(xì)胞功能障礙和凋亡通過(guò)誘導(dǎo)動(dòng)脈粥樣硬化、血栓形成等多種作用參與了缺血性心臟病的發(fā)生。缺血預(yù)處理是迄今最強(qiáng)的內(nèi)源性保護(hù)現(xiàn)象之一,并被HPC所模擬,自從1986年Murry等[9]發(fā)現(xiàn)這一現(xiàn)象以來(lái),其對(duì)缺血及再灌注損傷的保護(hù)作用在多種模型和不同器官、組織上得到證實(shí),但其內(nèi)源性保護(hù)機(jī)制目前并未完全闡明,涉及減輕細(xì)胞內(nèi)鈣超載、氧化應(yīng)激、誘導(dǎo)內(nèi)源性保護(hù)蛋白合成等多種機(jī)制。內(nèi)質(zhì)網(wǎng)是細(xì)胞內(nèi)穩(wěn)態(tài)調(diào)節(jié)和蛋白質(zhì)折疊、合成的細(xì)胞器,缺血、缺氧、鈣超載、氧化應(yīng)激等因素均可誘導(dǎo)ERS。大量研究證實(shí)ERS及相關(guān)凋亡參與了缺血性心臟病的發(fā)生、發(fā)展過(guò)程[3,10]。為證實(shí)HPC的內(nèi)源性保護(hù)作用涉及直接減輕內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的細(xì)胞損傷,本工作在ERS誘導(dǎo)劑TG致大鼠心肌MVECs內(nèi)質(zhì)網(wǎng)應(yīng)激模型上研究HPC的細(xì)胞保護(hù)作用,結(jié)果發(fā)現(xiàn)HPC顯著抑制TG誘導(dǎo)的MVECs LDH漏出和細(xì)胞凋亡,減輕其通透性增加和細(xì)胞骨架破壞,提示HPC可以直接抑制內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的MVECs損傷。
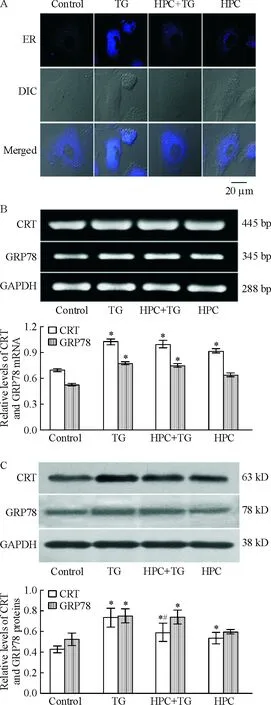
Figure 5. Effects of HPC on ER structure and expression of CRT and GRP78 in MVECs treated with TG.A: ER structure;B: mRNA levels of CRT and GRP78; C: protein levels of CRT and GRP78.DIC: differential interference contrast microscopy. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsTG.
圖5HPC對(duì)TG誘導(dǎo)的MVECsER形態(tài)以及CRT和GRP78表達(dá)的影響

Figure 6. Effect of HPC on CHOP expression in MVECs treated with TG.A: mRNA level of CHOP; B: protein level of CHOP. Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsTG.
圖6HPC對(duì)TG誘導(dǎo)的MVECs內(nèi)CHOP表達(dá)的影響
內(nèi)質(zhì)網(wǎng)應(yīng)激通常表現(xiàn)為內(nèi)質(zhì)網(wǎng)分子伴侶CRT和GRP78表達(dá)上調(diào)。CRT是內(nèi)質(zhì)網(wǎng)內(nèi)駐留的鈣結(jié)合蛋白,在細(xì)胞鈣穩(wěn)態(tài)調(diào)節(jié)中具有重要作用[10],并與GRP78一起作為分子伴侶,調(diào)節(jié)蛋白合成、折疊[11],旨在穩(wěn)定細(xì)胞內(nèi)質(zhì)網(wǎng)功能,保持細(xì)胞內(nèi)環(huán)境穩(wěn)態(tài)。PDIA3 是內(nèi)質(zhì)網(wǎng)應(yīng)激蛋白成員,可被氧化應(yīng)激誘導(dǎo),參與蛋白質(zhì)質(zhì)量控制過(guò)程[12]。本實(shí)驗(yàn)采用雙向電泳-質(zhì)譜技術(shù)發(fā)現(xiàn)TG誘導(dǎo)MVECs內(nèi)質(zhì)網(wǎng)應(yīng)激分子GRP78和PDIA3表達(dá)增加,Western blotting證實(shí)內(nèi)質(zhì)網(wǎng)應(yīng)激分子TG誘導(dǎo)MVECs內(nèi)CRT和GRP78表達(dá)顯著增加,而內(nèi)質(zhì)網(wǎng)染色證實(shí)TG誘導(dǎo)MVECs內(nèi)質(zhì)網(wǎng)形態(tài)顯著損傷和空泡化,上述結(jié)果提示TG誘導(dǎo)MVECs嚴(yán)重的內(nèi)質(zhì)網(wǎng)應(yīng)激。

Figure 7. Effects of HPC on expression of Bax and Bcl-2 in MVECs treated with TG.A: mRNA level of Bax and Bcl-2; B: protein level of Bax and Bcl-2.Mean±SD.n=4.*P<0.05vscontrol;#P<0.05vsTG.
圖7HPC對(duì)TG誘導(dǎo)的MVECs內(nèi)Bax和Bcl-2表達(dá)的影響
研究發(fā)現(xiàn)CRT過(guò)度表達(dá)參與了大鼠冠狀動(dòng)脈結(jié)扎心肌梗死和培養(yǎng)心肌細(xì)胞缺氧復(fù)氧損傷,HPC誘導(dǎo)CRT適度表達(dá)參與了HPC的心肌保護(hù)作用,并抑制缺氧復(fù)氧誘導(dǎo)的心肌細(xì)胞CRT過(guò)表達(dá)和游離Ca2+濃度增加[11]。研究證實(shí)細(xì)胞內(nèi)游離Ca2+濃度增加激活鈣依賴性蛋白酶,繼而降解收縮蛋白,引起細(xì)胞骨架破壞[13]。本實(shí)驗(yàn)發(fā)現(xiàn)內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs內(nèi)質(zhì)網(wǎng)形態(tài)損傷和空泡化,細(xì)胞骨架?chē)?yán)重破壞,無(wú)明顯應(yīng)力纖維,細(xì)胞骨架呈現(xiàn)彌散性破壞并出現(xiàn)空泡,同時(shí)細(xì)胞通透性顯著升高。HPC顯著抑制內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的上述損傷,內(nèi)質(zhì)網(wǎng)形態(tài)和細(xì)胞骨架與正常對(duì)照組無(wú)顯著差異,提示HPC可能通過(guò)抑制CRT過(guò)表達(dá),繼而抑制細(xì)胞內(nèi)Ca2+濃度增加誘導(dǎo)的骨架破壞而發(fā)揮細(xì)胞保護(hù)作用。
過(guò)度或嚴(yán)重內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)內(nèi)質(zhì)網(wǎng)相關(guān)凋亡蛋白CHOP表達(dá)上調(diào)。CHOP又稱為生長(zhǎng)停滯及DNA損傷誘導(dǎo)蛋白153(growth arrest and DNA damage inducible protein 153, GADD153),它通過(guò)直接調(diào)節(jié)核中靶基因,增加細(xì)胞對(duì)內(nèi)質(zhì)網(wǎng)應(yīng)激介導(dǎo)凋亡的敏感性。siRNA 干擾CHOP表達(dá)可抵抗內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的細(xì)胞凋亡[14],而CHOP過(guò)表達(dá)則促進(jìn)細(xì)胞凋亡[15]。研究發(fā)現(xiàn)CHOP過(guò)表達(dá)導(dǎo)致抗凋亡蛋白Bcl-2表達(dá)降低,并且導(dǎo)致促凋亡蛋白Bax從胞漿內(nèi)向線粒體內(nèi)易位[16],Bcl-2過(guò)表達(dá)和bax基因敲除均可抑制CHOP誘導(dǎo)的細(xì)胞凋亡[17-18]。本實(shí)驗(yàn)發(fā)現(xiàn)內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)劑TG誘導(dǎo)MVECs CHOP蛋白表達(dá)和Bax/Bcl-2比值顯著增加,HPC顯著抑制CHOP介導(dǎo)的細(xì)胞凋亡途徑,提示HPC通過(guò)抑制內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)CHOP凋亡途徑、減輕細(xì)胞凋亡繼而發(fā)揮細(xì)胞保護(hù)作用。
本研究在原代培養(yǎng)心肌MVECs上發(fā)現(xiàn)內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)MVECs顯著損傷,促進(jìn)細(xì)胞骨架破壞和通透性增加;HPC可能通過(guò)誘導(dǎo)適度內(nèi)質(zhì)網(wǎng)應(yīng)激、抑制CHOP介導(dǎo)的內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)凋亡途徑而減輕MVECs損傷及細(xì)胞骨架破壞,提示HPC的內(nèi)源性保護(hù)機(jī)制可能涉及直接抑制CHOP介導(dǎo)的過(guò)度內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng),為內(nèi)皮功能障礙相關(guān)疾病的防治提供了新的治療靶點(diǎn)。
[1] Simionescu M. Implications of early structural-functional changes in the endothelium for vascular disease [J]. Arterioscler Thromb Vasc Biol, 2007, 27(2): 266-274.
[2] Liu XH, Wu XD, Cai LR, et al. Hypoxic preconditioning of cardiomyocytes and cardioprotection: phosphorylation of HIF-1α induced by p42/p44 mitogen-activated protein kinases is involved[J]. Pathophysiology, 2003, 9(4): 201-205.
[3] 張振英,劉秀華. 血管內(nèi)皮細(xì)胞內(nèi)質(zhì)網(wǎng)應(yīng)激[J].生理科學(xué)進(jìn)展,2010, 41(1): 295-298.
[4] 劉秀華, 蘇靜怡. 缺血預(yù)處理的研究現(xiàn)狀[J]. 生理科學(xué)進(jìn)展,2001, 32(1): 83-87.
[5] Liu XH, Wu XD, Cai LR, et al. Calreticulin downregulation is associated with FGF-2-induced angiogenesis through calcineurin pathway in ischemic myocardium [J]. Shock,2008, 29(1): 140-148.
[6] Wu XD, Liu XH, Zhu XM, et al. Hypoxic preconditioning induces delayed cardioprotection through p38 MAPK-mediated calreticulin upregulation [J]. Shock, 2007, 27(5): 572-577.
[7] Gillrie MR, Krishnegowda G, Lee K, et al. Src-family kinase-dependent disruption of endothelial barrier function byPlasmodiumfalciparummerozoite proteins [J]. Blood, 2007, 110(9): 3426-3435.
[8] Zhang ZY, Liu XH, Hu WC, et al. The calcineurin-myocyte enhancer factor 2c pathway mediates cardiac hypertrophy induced by endoplasmic reticulum stress in neonatal rat cardiomyocytes[J]. Am J Physiol Heart Circ Physiol,2010, 298(5): H1499-H1509 .
[9] Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium [J]. Circulation, 1986, 74(5): 1124-1136.
[10] Park K, Poburko D, Wollheim C, et al. Amiloride derivatives induce apoptosis by depleting ER Ca2+stores in vascular endothelial cells [J]. Br J Pharmacol, 2009, 156(8):1296-1304.
[11] Liu XH, Xu FF, Fu Y, et al. Calreticulin induces delayed cardioprotection through mitogen-activated protein kinases [J]. Proteomics,2006, 6(13): 3792-3800.
[12] Huang TS, Olsvik PA, Krvel A, et al. Stress-induced expression of protein disulfide isomerase associated 3 (PDIA3) in Atlantic salmon (SalmosalarL.) [J]. Comp Biochem Physiol B Biochem Mol Biol,2009, 154(4): 435-442.
[13] Papp Z, van der Velden J, Stienen GJ. Calpain-I induced alterations in the cytoskeletal structure and impaired mechanical properties of single myocytes of rat heart [J].Cardiovasc Res,2000, 45(4): 981-993.
[14] Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress [J]. Cell Death Differ, 2004, 11(4): 381-389.
[15] Kim KM, Pae HO, Zheng M, et al. Carbon monoxide induces heme oxygenase-1 via activation of protein kinase R-like endoplasmic reticulum kinase and inhibits endothelial cell apoptosis triggered by endoplasmic reticulum stress [J]. Circ Res, 2007, 101(9): 919-927.
[16] Friedman AD. GADD153/CHOP, a DNA damage-inducible protein, reduced CAAT/enhancer binding protein activities and increased apoptosis in 32D c13 myeloid cells [J]. Cancer Res,1996, 56(14): 3250-3256.
[17] McCullough KD, Martindale JL, Klotz LO, et al. Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state [J]. Mol Cell Biol,2001, 21(4): 1249-1259.
[18] Gotoh T, Terada K, Oyadomari S, et al. hsp70-DnaJ chaperone pair prevents nitric oxide-and CHOP-induced apoptosis by inhibiting translocation of Bax to mitochondria [J]. Cell Death Differ,2004, 11(4): 390-402.
Hypoxicpreconditioningprotectsratmyocardialmicrovascularendothelialcellsagainstendoplasmicreticulumstress-inducedinjury
WU Xu-dong1, ZHANG Zhen-ying2, WANG Xiao-reng2, LI Yu-zhen2, LIU Xiu-hua2
(1Out-patientDepartment,2DepartmentofPathophysiology,ChinesePeople’sLiberationArmyGeneralHospital,Beijing100853,China.E-mail:wuxudong60@yahoo.com.cn)
AIM: To investigate the effect of hypoxic preconditioning (HPC) on endoplasmic reticulum stress (ERS)-induced injury in cultured microvascular endothelial cells (MVECs) from rat hearts.METHODSMVECs injury was induced by an ERS inductor thapsigargin (TG). Lactate dehydrogenase (LDH) leakage and apoptotic rate were detected to evaluate the injury of MVECs. Cytoskeleton and endoplasmic reticulum (ER) in MVECs were observed by phalloidin-FITC fluorescence staining and ER staining, respectively. Two-dimensional electrophoresis and mass spectrometry (MS) were used to identify proteomic profile in MVECs treated with TG. Western blotting was used to detect the expression of ERS markers, calreticulin (CRT) and glucose-regulated protein 78 (GRP78).RESULTSTG induced the increase in LDH activity in medium and the apoptosis of MVECs in a dose-dependent manner. TG treatment up-regulated the expression of CRT and GRP78, while HPC attenuated the ERS-induced injury and the up-regulation of ERS markers in MVECs.CONCLUSIONHPC protects MVECs from ERS-induced injury.
Hypoxic preconditioning; Microvascular endothelial cells; Endoplasmic reticulum stress
R363.1
A
1000- 4718(2013)09- 1537- 09
2012- 09- 17
2013- 08- 16
國(guó)家自然科學(xué)基金資助項(xiàng)目(No. 81070186)
△通訊作者 Tel: 010-66937334; E-mail: wuxudong60@yahoo.com.cn
▲并列第1作者
10.3969/j.issn.1000- 4718.2013.09.001
- 中國(guó)病理生理雜志的其它文章
- Nrf2-ARE通路在缺氧/吡那地爾后處理減輕大鼠心肌細(xì)胞缺氧復(fù)氧損傷中的作用*
- TNF-α增強(qiáng)人臍帶間充質(zhì)干細(xì)胞條件培養(yǎng)基的體外造血支持功能*
- 抗組胺治療對(duì)實(shí)驗(yàn)性肝炎大鼠肥大細(xì)胞浸潤(rùn)及c-Kit和SCF表達(dá)的影響*
- Nrf2過(guò)表達(dá)對(duì)乙醇刺激下肝星狀細(xì)胞激活與增殖及合成I型膠原的影響*
- 胰島素對(duì)嚴(yán)重?zé)齻缙诖笫笮募⊙趸瘧?yīng)激的影響*
- 紅景天苷對(duì)非酒精性脂肪性肝炎大鼠肝組織氧化應(yīng)激的抑制作用

