硫酸浸出硼泥制備片狀氫氧化鎂實驗研究
孫 青,侯會麗,鄭水林,葉 鵬
[中國礦業大學(北京)化學與環境工程學院,北京 100083]
硼泥是制取硼化工產品時產生的大宗廢棄物,目前已在遼寧、吉林、四川和青海等地造成大量堆積,并且在中國正以每年100萬t以上的排放量增加。由于硼泥呈堿性,大量硼泥露天堆積,易造成堿液滲漏,污染周圍水體、生態環境,并影響人體健康[1-4]。 硼泥主要化學成分是 MgO、SiO2、Fe2O3、Na2O和CaO等,其中MgO含量最為豐富。目前,已對硼泥利用開展了相關研究,制成鎂鹽產品、耐火材料和建筑材料等,取得了節省資源和保護環境的良好效果[5-6]。
氫氧化鎂是重要的鎂化工制品,作為無機阻燃填料在塑料、橡膠材料應用廣泛,具有無鹵、無毒、無煙、熱穩定性好和分解溫度高的優點[7-9]。將硼泥中的鎂回收利用,可制得氫氧化鎂產品,現有工藝主要包括碳化法、焙燒法、中性鹽浸出法、相轉移法及直接酸浸法[10-11]。筆者針對廢棄硼泥成分和物相組成特點,采用硫酸直接浸出、梯度堿析和水熱反應方法,制備出純度高、形貌均一和分散性好氫氧化鎂產品。
1 實驗
1.1 實驗原料與試劑
實驗用硼泥來自吉林集安,其主要化學成分見表1。由表1可以看出,硼泥中主要化學成分為MgO、SiO2和 Fe2O3, 還有少量的 B2O3、Al2O3、Na2O、CaO和MnO等。硼泥中MgO含量豐富,高達40%(質量分數,下同)以上,為制取 Mg(OH)2提供了高品位原礦,但同時易浸出雜質成分Fe2O3、Al2O3的含量也較高。

表1 硼泥化學成分分析 %
由X射線衍射分析得出,該硼泥主要礦物組成有含鐵橄欖石[(Mg,Fe)2SiO4]、 菱鎂礦(MgCO3)、變質 蛇 紋 石 (Mg,Al)3[(Si,Fe)2O5] (OH)4、 磁 鐵 礦(Fe3O4)、石英(SiO2)等。 依據 X 光衍射 ASTM 數據卡片對硼泥礦物組成進行分析,各礦物組成見表2。由表2可知,硼泥中的鎂橄欖石物相含量最高,占硼泥成分的50%(質量分數,下同)以上,鎂元素在硼泥中主要以鎂橄欖石物相存在;菱鎂礦物相有24.10%,還有少量的鎂以蛇紋石的形式存在(2.00%)。當硼泥中鎂以菱鎂礦(MgCO3)物相存在時,可以通過煅燒處理,使鎂以MgO的形式釋放出來。提鎂工藝較為簡單,而對于鎂橄欖石和蛇紋石,需采用強酸破壞其礦物結構,使鎂以Mg2+形式進入溶液。對浸出液進一步凈化處理,可以制得相應的MgSO4、MgCl2及 Mg(OH)2等產品。
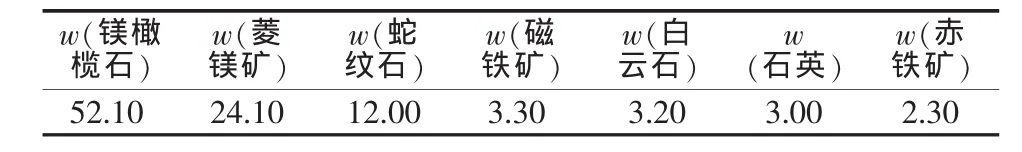
表2 硼泥物相組成分析 %
實驗所用濃硫酸、過氧化氫、氨水、氫氧化鈉均為分析純,實驗用水為自制蒸餾水。
1.2 實驗方法與儀器
1.2.1 實驗方法
取一定量硼泥置于三口燒瓶中,加入適量的硫酸,開啟加熱及攪拌,浸出反應一段時間后,經過過濾、洗渣、烘干、稱重后,采用電感耦合等離子體發射光譜儀(ICP-OES)分析濾渣中未浸出的鎂含量,計算鎂浸出率,并對反應渣進行XRD物相分析。濾液經氧化除雜后,過濾、沉淀、干燥得富含Fe(OH)3的渣;濾液加入適量的氫氧化鈉溶液,得到氫氧化鎂沉淀,將沉淀物洗滌、過濾后,對氫氧化鎂沉淀進一步水熱反應,得到水熱氫氧化鎂。實驗流程見圖1。

圖1 硫酸浸出硼泥制取片狀氫氧化鎂實驗流程示意圖
1.2.2 儀器設備
CDE-300E型打散機、DZKW-4型恒溫水浴鍋、JJ-2型機械攪拌器、HL-2型恒流泵、真空泵、水熱反應釜、DGB/20-002A型臺式干燥箱、D/max 2500型X射線衍射儀、EVO 18 Special Edition型掃描電子顯微鏡、iCAP 6000 Series型等離子體發射光譜儀。
2 結果與討論
2.1 正交實驗
為分析硼泥在硫酸溶液中的浸出行為,采用正交實驗確定影響硼泥中鎂浸出率的主要因素。影響硼泥中鎂浸出率因素有反應溫度、反應時間、硫酸用量、硫酸初始濃度(酸用量和初始濃度共同影響反應體系的固液比)、固體顆粒物的粒度等。因此,為了尋求硼泥酸浸優化工藝條件,選擇反應溫度(℃)、反應時間(h)、硫酸用量(實際用量與理論用量的物質的量比)、硫酸初始濃度(%),設計 4 因素 3 水平 L9(34)正交實驗,結果見表3。正交實驗及極差分析結果見表4。正交實驗方差分析見表5。
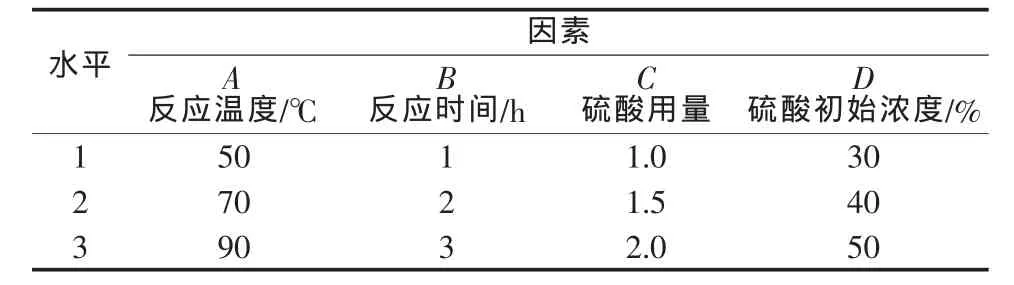
表3 正交實驗因素及水平
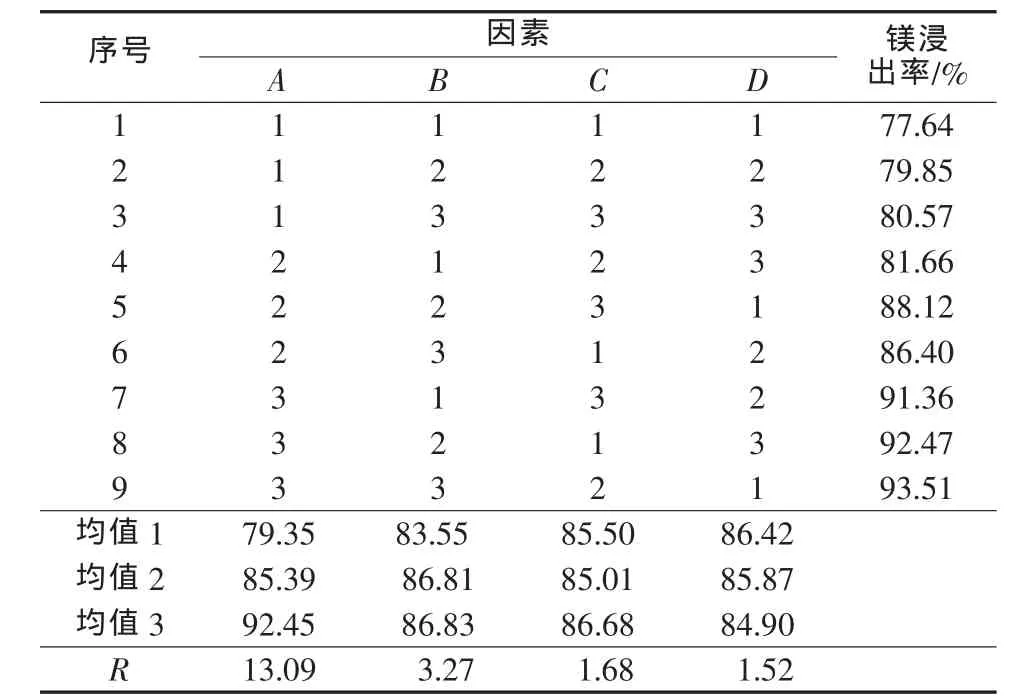
表4 正交實驗結果
由表4、5可知,各因素對鎂浸出率影響大小順序:反應溫度>反應時間>硫酸用量>硫酸初始濃度。說明在浸出硫酸用量足夠的條件下,反應溫度對Mg的浸出率影響最大。最優水平A3B3C2D1,即反應溫度為90℃、反應時間為3 h、硫酸用量為1.5倍、硫酸初始濃度為30%(質量分數,下同)時,鎂的浸出率最大。
2.2 因素實驗
通過正交實驗得知,對Mg的浸出率影響最大的因素為反應溫度。在實驗過程中,濃硫酸經稀釋后會有大量稀釋熱放出,在不進行外加熱的情況下,就能使反應溫度升到50℃以上。結合工業實際及成本考慮,硼泥浸出反應溫度的提高較易實現,而硫酸用量會影響浸出液除鐵及沉淀 Mg(OH)2過程堿量消耗,在保證硼泥中Mg能有較好浸出率的前提下,應盡量減小硫酸用量。因此,在固定條件下,通過因素實驗考察了不同反應溫度、硫酸用量對Mg浸出率的影響。
1)反應溫度。在反應時間為3 h、硫酸用量為理論量1倍、硫酸初始濃度為40%的條件下,考察了反應溫度對Mg浸出率的影響,結果見圖2。由圖2可知,在反應溫度為50~90℃時,Mg浸除率隨反應溫度的升高迅速升高,繼續升至95℃,Mg浸出率增幅變小。因此,實驗選擇硫酸浸出硼泥的反應溫度為95℃。
2)硫酸用量。在反應時間為3 h、反應溫度為95℃、硫酸初始濃度為40%的條件下,考察了硫酸用量對Mg浸出率的影響,結果見圖3。由圖3可知,Mg的浸出率隨著硫酸用量的增加而增大。當硫酸用量為理論量的0.8倍時,Mg浸出率僅為82.19%,當硫酸用量為理論量的1.2倍時,Mg浸出率為95.62%。當硫酸加入量大于1.1倍時,Mg的浸出率增幅不大。為節省沉淀氫氧化鎂時堿的用量,實驗選擇硫酸用量為理論量的1.2倍。
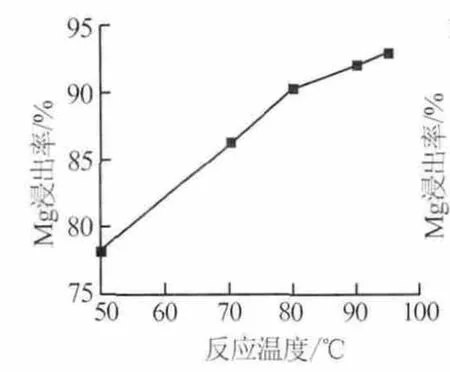
圖2 反應溫度對Mg浸出率的影響
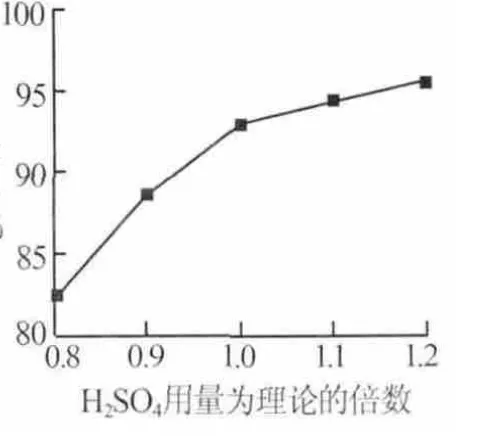
圖3 H2SO4用量對Mg浸出率的影響
通過因素實驗,確定優化酸浸條件:反應溫度為95℃、反應時間為3 h、硫酸初始濃度為40%、硫酸用量為理論量的1.2倍。反應完成后,漿洗一次、淋洗一次反應渣,經過濾得到初級硫酸鎂浸出液。圖4為浸出反應渣的XRD譜圖。從圖4可以看出,酸浸過后的渣中只含少量未浸出的硅酸鎂、石英及氧化鐵物相,大量 Mg2+、Fe2+、Al3+等被浸出,在 2θ為 10~30°時形成無定形的SiO2衍射鼓包。

圖4 硼泥浸出渣的XRD譜圖
2.3 氫氧化鎂制備實驗
2.3.1 氧化除雜
取初級硫酸鎂浸出液于三口燒瓶中,反應溫度為90℃,開啟攪拌,加入少量質量分數為30%的雙氧水氧化30 min,使溶液中的Fe2+氧化成Fe3+。以質量分數為25%的氨水為沉淀劑,用蠕動泵緩慢滴加至pH為5~6,沉化30 min后過濾得到氫氧化鐵沉淀物。
2.3.2 沉淀氫氧化鎂
反應溫度為70℃,配制質量分數為20%的氫氧化鈉溶液作為氫氧化鎂沉淀劑,用蠕動泵緩慢滴加至pH為12~13,沉化30 min。過濾沉淀物并對濾餅加水洗滌3次,制得氫氧化鎂濾餅。
2.3.3 氫氧化鎂的提質水熱反應
水熱反應是在加壓反應釜中進行的,采用沉淀氫氧化鎂濾餅,加水調漿至150~200 g/L,氫氧化鎂的水熱條件:水熱溫度為150℃,水熱時間為2 h。
2.3.4 氫氧化鎂產品的表征
硫酸浸出硼泥制得氫氧化鎂經水熱反應后,采用SEM、XRD及建筑材料行業標準 JC/T 1021.9—2007《水鎂石化學分析方法》等分別對樣品形貌、物相、化學成分等進行了分析。
圖5 為未水熱 Mg(OH)2和水熱 Mg(OH)2的SEM照片。由圖5可見,水熱反應前,沉淀反應生成的氫氧化鎂呈團聚狀;在高溫、高壓條件下,經水熱反應后,氫氧化鎂沉淀可以進一步結晶,除去沉淀時包聚的水分、Na+、SO4-等雜質,形成晶粒發育完整、粒度分布均勻、顆粒分散性好的片狀氫氧化鎂粉體。

圖5 未水熱 Mg(OH)2和水熱 Mg(OH)2的 SEM 照片
圖6 為水熱 Mg(OH)2的 XRD 譜圖(a)和標準Mg(OH)2衍射卡片(b)的對比。 由圖 6 可見,水熱Mg(OH)2結晶性較好,與標準 Mg(OH)2衍射卡片(JCPDS 76-0667)對比可以看出,實驗所得 Mg(OH)2無其他雜質物相峰出現,其Mg(OH)2質量分數為99.35%。
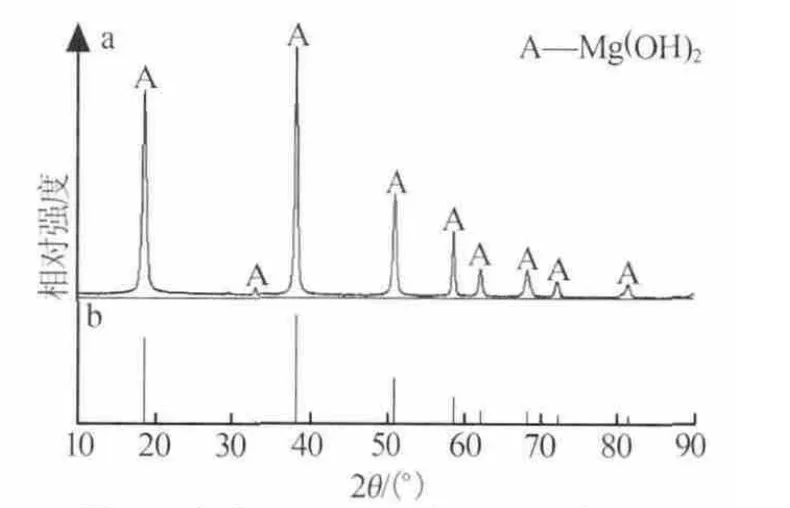
圖6 水熱 Mg(OH)2的 XRD譜圖
3 結論
1)硼泥中含有豐富的鎂資源,通過硫酸浸出、梯度堿析和水熱反應,可以有效回收硼泥中鎂元素,制得片狀高純 Mg(OH)2產品。
2)用硫酸浸出硼泥優化工藝條件:浸出溫度為95℃、浸出時間為3 h、硫酸初始濃度為40%(質量分數)、硫酸用量為理論量的1.2倍。
3)硼泥中氧化鎂組分經硫酸浸出后可制得形貌均一、顆粒分散性好、晶粒發育完整的Mg(OH)2粉體,其 Mg(OH)2質量分數高達 99.35%。
[1]孫彤.硼泥綜合利用概況與展望[J].遼寧工學院學報.2004,24(4):45-48.
[2]單松高,閻加強,陳文,等.硼泥的性質及綜合利用[J].山東建材,1998(2):37-39.
[3]徐華琴.硼泥的綜合利用[J].礦產保護與利用,1993(5):38-40.
[4]劉見芬,蔣引珊,方送生.硼泥的綜合回收利用試驗研究[J].非金屬礦,2001,24(3):27-29.
[5]劉寶樹,胡慶福,胡永琪,等.硼泥綜合利用研究進展[C]∥2010年全國鎂鹽行業年會暨節能減排與發展研討會論文集.德州:中國無機鹽工業協會鈣鎂鹽分會,2010:78-84.
[6]錢洪偉,薛向欣,劉然,等.硼泥資源化利用的重要途徑[J].化工礦物與加工,2007,36(9):33-36.
[7]胡慶福,宋麗英,劉寶樹.中國工業鎂化合物生產現狀與展望[J].無機鹽工業,2009,41(4):8-10,34.
[8]Mordike B L,Ebert T.Magnesium:Properties-applications-potential[J].MaterialsScienceandEngineeringA,2001,302(1):37-45.
[9]高善民,王善華,孫樹聲,等.市場前景廣闊的無機阻燃劑——氫氧化鎂[J].化工進展,2001(08):56-59.
[10]向蘭,吳會軍,金永成,等.阻燃型氫氧化鎂制備技術評述[J].海湖鹽與化工,2001,30(5):1-4.
[11]孫青,侯會麗,鄭水林,等.硼泥中鎂、硅回收及綜合利用研究進展[J].中國粉體技術,2012(增刊):20-23.
[12]Lebedev V N.Specific features of disposal of sulfuric acid solutions resulted from magnesium silicate decomposition[J].Russian Journal of Applied Chemistry,2010,83(4):607-610.

