海洋放線菌Y-0117農用活性代謝產物的研究
楊巍民,斯聰聰,楊 星,徐文平,陶黎明
(1.上海市農藥研究所,上海200032;2.華東理工大學藥學院,上海200237)
當今國內外農用抗生素基本上都是來源于陸地微生物,但是隨著陸地可利用微生物資源的減少,從陸地微生物中提取新型抗生素難度加大,而占地球71%的海洋,由于其資源極其豐富,且大部分都未被開發,逐漸成為了國內外研究的重點和熱點[1]。早在1869年法國Darieude Monzonneuvo就報道了從海草中分離得到首個專性海洋真菌Spaeria posidoniae,證明了海洋微生物有其專有的種屬,而并非來源于陸地微生物。Grein等[2]發現海水對炭疽桿菌和霍亂弧菌的生長有抑制作用,這也是最早關于海洋微生物抑菌活性的報道。隨著海洋微生物研究的進一步深入,研究者從海洋微生物中分離得到大批新型活性代謝產物,有關專家預測,海洋微生物將是獲得新的醫用、農用抗生素的重要資源[3]。
我國學者近年來開始從海洋中篩選農用活性微生物,并取得了一些成果,如從我國膠州灣海域中分離篩選得到2株海洋放線菌,具有抗菌活性[4];從海洋放線菌N311發酵液中分離得到一種生物堿類物質,具有抗菌活性和細胞毒性[5];從湛江硇洲島高鹽泥樣中篩選得到到一株海洋微嗜鹽放線菌JMC06001,該菌株的發酵粗產物具有很強的抑菌活性[6];從渤海海底沉積物中篩選得到一株編號A2的海洋放線菌,該菌株發酵產生的代謝產物對多種植物病原真菌具有強烈的抑制作用[7];從連云港海域采集的沉積物樣本中篩選得到一株產高活性抗細菌物質的鏈霉菌GB-2[8];自南中國海紅樹根部土壤篩選到一株海洋放線菌Streptomyces sp.V5,從其發酵液中分離獲得一種新型的八元環內酯 Octalactin C[9];從海南、湛江等海洋沉積物樣本中篩選得到菌株HA07011,該菌株的發酵液具有殺線蟲活性[10]。作者對篩選得到的具有較高農用活性的海洋放線菌菌株Y-0117所產生的生物活性物質進行了分離純化,確定了對植物病原真菌具有良好拮抗作用的代謝物。
1 實驗
1.1 菌株及培養基
海洋放線菌Y-0117由國家海洋局第一海洋研究所提供,經農用生物活性篩選,發現該菌株產生的代謝產物對植物病原真菌有較好拮抗作用。
發酵培養基(g·L-1):葡萄糖20.0,黃豆餅粉25.0,淀粉10.0,酵母粉4.0,NaCl 20.0,牛肉膏1.0,K2HPO40.05,pH=7.2。
1.2 儀器
Agilent 1200MS-LC 型 液 質 聯 用 色 譜;UV-2501PC型紫外全光譜掃描儀,東芝;Bruker Avance 500MHz型核磁共振儀;氣相色譜/飛行時間質譜聯用儀、液相色譜/飛行時間質譜聯用儀,英國質譜公司。
1.3 活性代謝產物的分離純化
從斜面培養基中取培養7d后的菌株Y-0117的適量菌體,接種于發酵培養基中,于28℃、220r·min-1搖床培養6d。發酵培養40L,將發酵液離心,過濾,取菌絲體所在的濾餅部分,用80%的丙酮浸取過夜,冷凍離心,過濾除去濾渣,真空濃縮除去丙酮,與發酵上清液合并,然后用正丁醇萃取2次,合并正丁醇相濃縮至干,再用甲醇浸取2次,過濾除去甲醇不溶物,濃縮除去甲醇獲得粗品。
粗品經硅膠柱層析分離,分別以二氯甲烷-甲醇(20∶1,10∶1,5∶1)洗脫,活性組分主要集中在二氯甲烷-甲醇(10∶1)中,再將獲得的活性組分進行TLC制備,層析液為二氯甲烷-甲醇(8∶1),收集Rf值為0.53(組分0117A)和Rf值為0.65(組分0117B)的活性組分,經甲醇溶出并除去硅膠粉后,最后進行HPLC制備,得到純品0117A(14.7mg)和0117B(16.4 mg),純度均達到96%以上。制備柱型號:VP250/21 Nucleosil 100-7C18,流動相為甲醇-水(67∶33),流速為16mL·min-1,柱溫為室溫,紫外檢測波長為210nm。
分離純化過程中以對稻瘟病菌(Pyricularia oryzae)的抑制活性進行生物活性跟蹤。
1.4 結構鑒定
將0117A和0117B分別溶解于0.5mL CDCl3中,進 行 核 磁 共 振 掃 描 (1H 為 400MHz,13C 為 125 MHz)。記錄1HNMR、13CNMR、DEPT90、DEPT135、COSY、NOESY、HSQC和HMBC等譜圖信息。
1.5 生物活性測定
采用平板拮抗法測定分離所得化合物0117B對稻瘟病菌(Pyricularia oryzae,Po)、黃瓜灰霉病菌(Botriytis cinerea,Bc)、水稻紋枯病菌(Rhizoctonia solani,Rs)、瓜類炭疽病菌(Collectotrichum lagenarium,Cl)、玉米小斑病菌(Helminthosporium maydis,Hm)、小麥赤霉病菌(Gibberella zeae,Gz)、瓜類白粉病菌(Sf)等植物病原真菌的抑制作用,并測定其最小抑菌濃度 (MIC)。
2 結果與討論
2.1 活性化合物的結構鑒定
0117A:白色粉末狀固體。紫外吸收λmax為242.8nm、283.4nm;ESI-MS,m/z:627.3808[M+Na]+,分子式為C35H56O8;分子量為604。
0117B:白色晶狀固體。紫外吸收λmax為246.4nm、285.6nm;ESI-MS,m/z:645.5[M +Na]+,分子式為C42H60O12;分子量為756。
對活性化合物的NMR結果分別進行解譜,根據13C-1H HSQC圖譜確定C-H 相關信息,由1H-1H COSY和1H-1H NOESY圖譜分別確定 H-H 相關和遠程相關信息,根據13C-1H HMBC圖譜確定C-H遠程相關信息,綜合各種2DNMR的解譜信息,確定活性化合物的具體結構,見圖1,其結構中C和H的化學位移分布如表1 所示。
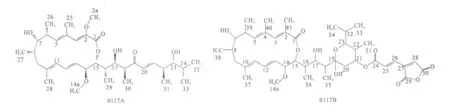
圖1 化合物0117A和0117B的結構Fig.1 The structure of compounds 0117Aand 0117B
經文獻檢索,發現化合物0117A與Bafilomycin D結構相同[11],而化合物0117B 與 Tchize等[12]在2010年從放線菌Streptomyces varsoviensis發酵液中分離得到的Bafilomycins類新結構化合物相同,為Hygrobafilomycin。
2.2 化合物0117B的生物活性
化合物0117B(Hygrobafilomycin)對植物病原真菌的抑制作用見表2 。

表1 海洋放線菌Y-0117產生的活性化合物的C和H的化學位移分布Tab.1 TheδCandδHof the active compounds generated by marine Actinomycete Y-0117

表2 0117B(Hygrobafilomycin)對植物病原真菌的抑制作用Tab.2 The inhibition of 0117B (Hygrobafilomycin)to plant pathogenic fungi
由表2 可知,化合物0117B在離體條件下可以抑制稻瘟病菌、黃瓜灰霉病菌和瓜類炭疽病菌的生長,表明其具有一定的抗植物病原真菌活性。進一步考察0117B對稻瘟病菌的拮抗作用,結果表明,化合物0117B在濃度(μg·mL-1)為500、250、125、62.5、31.25、15.63、7.81時對稻瘟病菌的抑菌圈直徑(cm)分別為3.2、3.2、3.0、2.3、2.4、1.4、0,可知其對稻瘟病菌的最小抑菌濃度為15.63μg·mL-1。
2.3 討論
與化合物0117A結構相同的Bafilomycin D曾被報道有除草活性[11]和殺蟲活性[3],對哺乳動物細胞的V-ATPase有選擇性抑制作用。而Hygrobafilomycin是于2010年發現的新結構化合物,在對40多種腫瘤細胞株的實驗中顯示了高細胞毒性(平均IC50=5.3n)[12]。而本研究分離所得的兩個化合物都是以植物病原真菌為測試對象而純化得到的,具有較好開發為農用殺菌劑或作為結構改造前體的應用前景,其農用生物活性譜、藥效試驗等還有待進一步研究。由于野生菌株的產素效價較低,可以通過優化產生菌的發酵條件或對產生菌進行誘變育種,提高目標產物的發酵效價,以更好地進行開發。
3 結論
在農用抗生素篩選中發現代號為Y-0117的海洋放線菌菌株所產生的代謝產物對植物病原真菌具有良好的抑制作用。對Y-0117發酵液進行萃取、硅膠柱層析、制備薄層色譜、制備HPLC,分離純化得到兩個活性組分0117A和0117B。通過紫外光譜、質譜、核磁共振等手段,確定0117A的分子式為C35H56O8,分子量為604,結構與已知化合物Bafilomycin D相同;0117B的分子式為C42H60O12,分子量為756,結構與近期發現具有抗癌活性的已知化合物Hygrobafilomycin相同。研究發現0117B對多種植物病原真菌具有良好的抑制活性,對稻瘟病菌的最小抑制濃度為15.63μg·mL-1。
[1]Peng J N,Shen X Y,Sayed K A,et al.Marine natural products as prototype agrochemical agents[J].Food Chemistry,2003,51(8):2246-2252.
[2]Grein A,Meyers S P.Growth characteristics and antibiotic production of Actinomycetes isolated from littoral sediments and materials suspended in sea water[J].Bactriol,1958,76(5):457-463.
[3]田黎,陳杰,何遠轉,等.農用抗生素的新資源——海洋微生物[J].中國生物防治,2003,19(3):121-124.
[4]吳少杰,王淑軍,李富超,等.膠州灣海洋放線菌的分布及其抗微生物活性[J].中國海洋藥物,2006,25(5):11-13.
[5]林親雄,劉云,奚濤.海洋放線菌N331生物堿活性組分的研究[J].中國海洋藥物,2008,27(1):46-49.
[6]陳義光,張曉蓉,張麗.具抗菌活性海洋放線菌菌株JMC06001的分離和鑒定[J].微生物學通報,2008,35(1):40-44.
[7]黃偉平,方麗萍,姬志勤.放線菌A2菌株代謝產物的研究初報[J].農藥,2007,46(4):232-234.
[8]劉姝,陸穎健,陸兆新.海洋鏈霉菌GB-2發酵產物的抗細菌活性及性質研究[J].生物工程學報,2007,23(6):1077-1081.
[9]陳光英,朱峰,林永成.海洋放線菌Streptomyces sp.V5產生的一個新的八元環內酯[J].有機化學,2007,27(9):1159-1161.
[10]雷敬超,李傳浩,黃惠琴.殺線蟲海洋放線菌的篩選及菌株HA07011的鑒定[J].生物技術通報,2007,(6):146-149.
[11]Kretschmer A,Dorgerloh M,Deeg M,et al.The structures of novel insecticidal macrolides:Bafilomycins D and E and oxohygrolidin[J].Agric Biol Chem,1985,49(8):2509-2511.
[12]Tchize N B S,Sattler I,Maier A,et al.Hygrobafilomycin,a cytotoxic and antifungal macrolide bearing a unique monoalkylmaleic anhydride moiety,from Streptomyces varsoviensis[J].J Antibiotic,2010,63(7):359-363.

