零價鐵催化過二硫酸鹽降解苯胺
楊世迎,馬 楠,王 靜,王雷雷
(1. 中國海洋大學 海洋環境與生態教育部重點實驗室,山東 青島 266100;2. 中國海洋大學 環境科學與工程學院,山東 青島 266100)
苯胺(AN)是重要的有機化學品,對生物和環境具有較大危害[1]。我國將AN列為優先控制污染物[2]。因此,嚴格控制廢水中AN含量具有現實意義。
采用基于SO4?-的過硫酸鹽氧化技術可去除難降解有機污染物,是一類新型的水處理高級氧化技術[3-5]。過渡金屬離子(如Fe2+等)可催化過二硫酸鈉(PS)分解生成SO4?-[6],其氧化還原電位(E0=2.5~3.1 V[7])接近甚至超過氧化性極強的羥基自由基(E0=1.8~2.7 V[8]),理論上可降解大部分有機污染物。但Fe2+催化PS降解污染物的效果并不理想,主要原因是,過量的Fe2+會消耗SO4?-[9]。將Fe0作為Fe2+的來源,催化PS,也可產生SO4?-,從而有效降解污染物[10-11]。Fe0對環境危害性小、費用低廉,能在常溫常壓下自發進行PS的催化,無需外加能量,極具發展潛力。研究結果表明,Fe0催化PS可有效降解氯苯酚、萘、三氯乙烯,使蒽醌染料脫色[11-14]。本課題組在關于Fe0-PS體系降解硝基苯的研究中發現,當硝基苯被還原為AN時,產生的Fe2+能進一步催化PS快速降解中間產物AN[15]。
本工作利用Fe0催化PS降解AN,進一步研究了Fe0-PS體系對AN的降解效果,并探討其反應機制。
1 實驗部分
1.1 試劑和儀器
AN、PS、N-(1-萘基)乙二胺鹽酸鹽、硼酸:分析純。
Fe0:鐵粉。
Alpha系列分光光度計:上海譜元儀器有限公司;SHA-C型恒溫振蕩器:常州國華電器有限公司;PHS-3C型pH計:上海雷磁儀器廠;TOC-vcpn型TOC分析儀:日本島津公司。
1.2 實驗方法
按照文獻[15]對Fe0進行預處理。在反應溫度為25 ℃的條件下,將濃度為0.12 mmol/L的AN水溶液置于500 mL錐形瓶中,加入35.7 mmol/L的Fe0和一定量的PS,振蕩反應一定時間后取樣分析。
1.3 分析方法
采用N-(1-萘基)乙二胺偶氮分光光度法測定AN濃度,計算AN降解率[16]; 采用分光光度法測定PS濃度,計算PS轉化率[17];采用鄰菲啰啉分光光度法測定Fe3+和Fe2+濃度[18];采用TOC分析儀測定TOC。
2 結果與討論
2.1 Fe0-PS體系對AN的降解效果
在PS加入量為6.0 mmol/L的條件下,不同體系對AN降解率的影響見圖1。由圖1可見:單獨采用PS氧化降解AN,當反應時間為120 min時,降解率僅為19.8%;單獨使用Fe0時,AN幾乎沒有降解;采用Fe0-PS體系降解AN,當反應時間120 min時,降解率達81.4%。

圖1 不同體系對AN降解率的影響
對圖1中PS和Fe0-PS體系的反應速率進行一級動力學擬合,其ln(ct/c0)~t關系見圖2。由圖2可見,Fe0-PS體系對AN的降解符合一級反應動力學方程,Fe0-PS體系對AN的一級反應速率常數(0.038 19 min-1)明顯大于PS體系降解AN的一級反應速率常數(0.004 61 min-1)。
另外,考察了Fe0-PS體系對AN的礦化效果,實驗結果表明,TOC去除率達52.6%。

圖2 不同體系的ln(ct/c0)~t關系
在Fe0-PS體系中,Fe0被氧化成Fe2+[13-14],Fe2+催化PS發生類Fenton試劑氧化反應,產生強氧化性的SO4?-, Fe2+過量則會消耗SO4?-(見式(1)~(3))。
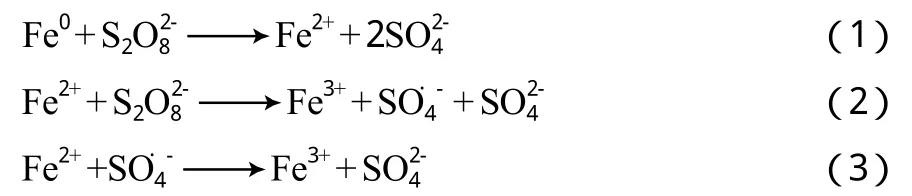
2.2 PS加入量對Fe0-PS體系降解AN的影響
在Fe0-PS體系中,PS加入量對AN降解率的影響見圖3。由圖3可見,隨PS加入量的增加,AN降解率逐漸增大。

圖3 PS加入量對AN降解率的影響
不同PS加入量下的ln(ct/c0)~t關系見圖4。由圖4可見,隨PS加入量的增加,擬合直線斜率逐漸降低,表明一級反應速率常數逐漸增加。當PS加入量分別為1.2,3.6,6.0 mmol/L時,一級反應速率常數分別為0.010 12,0.020 31,0.038 19 min-1。

圖4 不同PS加入量下的ln(ct/c0)~t關系
2.3 Fe0-PS體系中Fe2+對降解AN的貢獻
在PS加入量為6.0 mmol/L的條件下, 溶液中Fe2+和Fe3+的濃度及溶液pH隨反應時間的變化見圖5。由圖5可見:在整個反應過程中,溶液pH基本維持在2.4~3.0,呈酸性;Fe3+濃度在反應時間為20 min時達到最大值,之后逐漸降低;Fe2+濃度隨反應時間的延長逐漸升高。這是由于Fe0可被氧化生成Fe2+或Fe3+,由于體系中的Fe0過量,Fe3+進一步與Fe0反應生成Fe2+。因此,酸性條件利于Fe2+的生成,從而催化PS降解AN。酸性條件下)時的AN降解率;在調節溶液pH=9.2后,PS體系與Fe0-PS體系擬合直線的斜率接近,說明Fe0催化PS降解AN的速率與PS自身降解AN的速率接近,兩者的一級反應動力學常數均為0.003 00 min-1左右。原因為當溶液pH=9.2時,體系中沒有Fe2+,無法催化PS產生強氧化性的SO4?-,從而影響了AN的降解效果。因此,在Fe0-PS體系中Fe2+的作用非常重要。

圖5 Fe2+和Fe3+濃度及溶液pH隨反應時間的變化
圖6 PS體系和Fe0-PS體系對AN的降解率

圖7 PS體系和Fe0-PS體系的ln(ct/c0)~t關系
進一步研究在堿性條件下Fe0催化PS降解AN的情況。向體系中加入硼酸緩沖液,調節溶液pH=9.2。在溶液pH=9.2時,PS體系和Fe0-PS體系對AN的降解率見圖6,PS體系和Fe0-PS體系的ln(ct/c0)~t關系見圖7。由圖6和圖7可見:在120 min的反應過程中,PS體系和Fe0-PS體系的AN降解率基本一致; 在堿性條件下反應120 min后,AN降解率約為40%,明顯低于相同條件下未調節溶液pH(即
2.4 不同價態Fe對AN降解率的影響
在PS加入量為6.0 mmol/L、Fe0、Fe2+和Fe3+的加入量均為35.7 mmol/L的條件下,不同價態Fe對AN降解率的影響見圖8。由圖8可見:在3種不同價態Fe催化PS降解AN的體系中,Fe0-PS體系的AN降解率最高,當反應時間為120 min時,AN降解率達81.4%;在Fe3+-PS體系中,AN幾乎未得到降解;在Fe2+-PS體系中,當反應時間為120 min時,AN降解率為50.0%,較Fe0-PS體系的AN降解率低31.4百分點。這是由于,Fe0是非均相催化劑,主要通過反應生成Fe2+催化PS降解有機物,這是一個緩慢的反應過程,有利于SO4?-與污染物接觸進行反應[9];而直接加入Fe2+易導致Fe2+過量從而消耗SO4?-,降低降解效果[11]。

圖8 不同價態Fe對AN降解率的影響
在PS加入量為6.0 mmol/L、Fe0,Fe2+,Fe3+加入量均為35.7 mmol/L的條件下,不同價態Fe對PS轉化率的影響見圖9。由圖9可見:在Fe3+-PS體系中,PS轉化率很低;在Fe2+-PS體系中,Fe2+可迅速分解PS,在15 min內PS轉化率可達80%;在Fe0-PS體系中,隨反應時間的延長,PS轉化率逐漸升高,當反應時間為120 min時,PS轉化率達80%。過量的SO4?-并不能有效降解污染物,反而會被Fe2+消耗。因此,Fe0-PS體系中的Fe2+釋放相對緩慢,可有效地利用PS,從而更有利于AN的氧化降解。
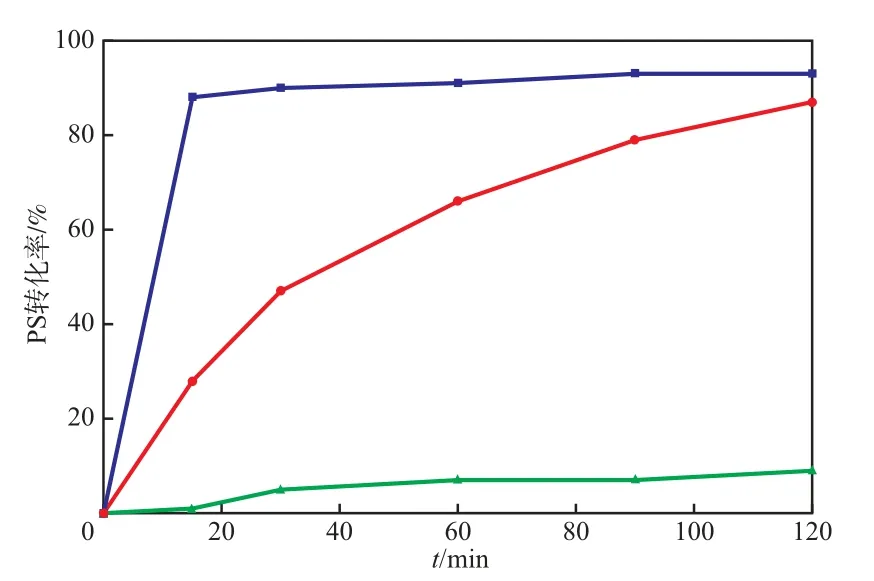
圖9 不同價態Fe對PS轉化率的影響
3 結論
采用Fe0催化PS降解AN。在PS加入量為6.0 mmol/L、Fe0加入量為35.7 mmol/L、反應時間為120 min的條件下,AN降解率可達81.4%,TOC去除達52.6%,一級反應速率常數為0.038 19 min-1。在Fe0-PS體系中,Fe0被氧化生成Fe2+,Fe2+可以催化PS發生類Fenton試劑氧化反應,產生強氧化性的SO4?-,從而降解AN。反應過程中,Fe2+起到重要作用,酸性條件有利于Fe2+的生成。與Fe2+-PS體系相比,Fe0-PS體系中的Fe2+緩慢釋放,可有效利用PS,有利于AN的氧化降解。
[1] Zhang Yongqing,Du Xiaozhe,Huang Weilin. Temperature effect on the kinetics of persulfate oxidation ofp-chloroaniline[J]. Chin Chem Lett,2011,22(3):358-361.
[2] An Fuqiang,Feng Xiaoqin,Gao Baojiao. Adsorption property and mechanism of composite adsorbent PMAA/SiO2for aniline[J]. J Hazard Mater,2010,178(1):499-504.
[3] 陳曉旸. 基于硫酸自由基的高級氧化技術降解水中典型有機污染物研究[D]. 大連:大連理工大學環境學院,2007.
[4] 楊世迎,陳友媛,胥慧真,等. 過硫酸鹽活化高級氧化新技術[J]. 化學進展,2008,20(9):1433-1438.
[5] Liang C,Bruell C,Marley M,et al. Thermally activated persulfate oxidation of trichloroethylene (TCE)and 1,1,1-trichloroethane (TCA) in aqueous systems and soil slurries[J]. Soil Sediment Contam,2003,12(2):207-228.
[6] House D. Kinetics and mechanism of oxidations by peroxydisulfate[J]. Chem Rev,1962,62(3):185-203.
[7] Neta P,Huie R E,Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. J Phys Chem Reference Data,1988,17(3):1027 -1284.
[8] Buxton G,Greenstock C,Helman W,et al. Critical review of rate constants for reactions of hydrated electrons chemical dinetic data base for combustion chemistry[J]. J Phys Chem Reference Data,1988,17(2):513-780.
[9] Romero A,Santos A,Vicente F,et al. Diuron abatement using activated persulphate:Effect of pH,Fe(Ⅱ)and oxidant dosage[J]. Chem Eng J,2010,162(1):257-265.
[10] 楊世迎,楊鑫,王萍,等. 過硫酸鹽高級氧化技術的活化方法研究進展[J]. 現代化工,2009,29(4):13-19.
[11] Zhao Jinying,Zhang Yaobin,Quan Xie,et al.Enhanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxydisulfate at ambient temperature[J]. Sep Purif Technol,2010,71(3):302-307.
[12] Liang Chenju,Guo Yiyu. Mass transfer and chemical oxidation of naphthalene particles with zerovalent iron activated persulfate[J]. Environ Sci Technol,2010,44(21):8203-8208.
[13] Liang Chenju,Lai Mingchun. Trichloroethylene degradation by zero valent iron activated persulfate oxidation[J]. Environ Sci Technol,2008,25(7):1071-1078.
[14] Oh S Y,Kim H,Park J,et al. Oxidation of polyvinyl alcohol by persulfate activated with heat,Fe2+,and zero-valent iron[J]. J Hazard Mater,2009,168(1):346-351.
[15] 楊世迎,楊鑫,梁婷,等. 零價鐵還原和過硫酸鹽氧化聯合降解水中硝基苯[J]. 環境化學,2012,31(5):682-686.
[16] 北京市化工研究院分院. GB11889—89水質 苯胺類化合物的測定N-(1-萘基)乙二胺偶氮分光光度法[S]. 北京:中國標準出版社,1989
[17] Liang Chenju,Huang Chiufen,Mohanty Nihar,et al. A rapid spectrophotometric determination of persulfate anion in ISCO[J]. Chemosphere,2008,73(9):1540-1543.
[18] Lee Y,Lo S L,Chiueh P T,et al. Microwave-hydrothermal decomposition of perf l uorooctanoic acid in water by iron-activated persulfate oxidation[J]. Water Res,2010,44(3):886-892.

