反應活化能的Tolman解釋*
劉國杰 黑恩成
(華東理工大學化學系 上海 200237)
自從Arrhenius提出活化能概念以來,這個概念的物理意義一直引人關注。20世紀20年代,Tolman用統計力學的觀點給出了明確的解釋,但直至20世紀70年代才廣泛被人們接受。然而,Arrhenius方程是個經驗方程,由此引出的Arrhenius活化能并不嚴格,這就需要對化學反應活化能的解釋作進一步的探討,本文的目的就在于此。
1 Arrhenius活化能的Tolman解釋[1]
Tolman解釋的一個基本假設是認為,反應系統基本處于平衡狀態,以致其能量服從Boltzmann分布。對于單分子基元反應:
如果反應物分子在其能級上的分布為:
能級ε0,ε1,ε2,…,εj,…
簡并度g0,g1,g2,…,gj,…
濃度cA0,cA1,cA2,…,cAj,…
速率常數k0,k1,k2,…,kj,…
其中,cAj為處于j能級的反應物濃度,kj為這種反應物的反應速率常數,則由統計力學觀點,處于j能級的反應物分子的反應速率當為:
(1)
反應物的總反應速率應等于各能級反應物分子的反應速率之和:
(2)
而實驗測得的反應速率為:
(3)
所以,測得的反應速率常數當為:
(4)
按照Boltzmann能量分布定律:
(5)
式中Pj代表反應物分子在j能級上的分布概率,kB為Boltzmann常量。將式(5)代入式(4),則得:

(6)
這就是說,實驗測得的反應速率常數k實為相應微觀量kj的統計平均值。
假定反應服從Arrhenius方程,將式(6)代入其活化能的定義式,可得:
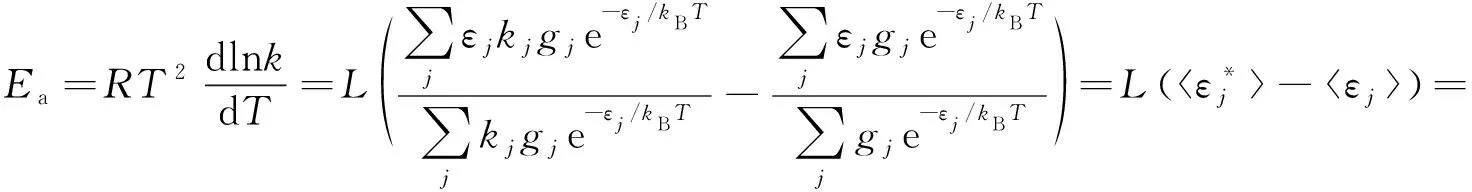
(7)
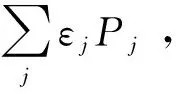
以上方法同樣可應用于雙分子反應:
從而得到:
(8)
式中cAi為處于i能級的反應物A的濃度,cBj為處于j能級的反應物B的濃度,kij為這兩種分子間的反應速率常數。因此,實驗測得的速率常數應為:
(9)
將式(9)代入Arrhenius活化能定義式,經過運算,便得:

(10)
由上述推導可見,無論是單分子反應還是雙分子反應,Arrhenius活化能Ea都等于活化分子或活化分子對的平均摩爾能與所有反應物分子的平均摩爾能之差。這就是Arrhenius活化能的Tolman解釋。
綜上所述,Tolman解釋有兩個前提:一是反應系統的能量必須服從Boltzmann分布,二是反應活化能必須遵守Arrhenius方程。
2 Arrhenius假設
對于反應速率常數k與溫度T的指數關系,最早是由Hood[2]提出。后來,Van′t Hoff[3]從熱力學考慮,得出:
(11)

假設①:并非所有分子都能反應,參與反應的只有那些能量較高的“活化分子”,一般分子必須在吸收了一定的能量后,才變成“活化分子”。這就是說,反應是按如下模式進行的:
假設②:一般分子A變成“活化分子”A*是可逆的,且“活化分子”很容易衰變為一般分子,故“活化分子”的濃度是極低的,A與A*間可視為處于平衡狀態。據此,可得:

(12)
式中Kc為平衡常數,Kc=k1/k-1。
假設③:“活化分子”轉變成產物P的速率很慢,這一步是反應的速控步。
(13)
故反應速率常數為:
k=k2Kc
(14)
等號兩邊取對數,然后對溫度求導,則得:
(15)
式中代入了Van′t Hoff方程。此式即為式(11),其中dlnk2/dT=C。所以必須補充一個假設(即假設④)。

(16)
值得關注的是,正是假設④成全了Arrhenius活化能的Tolman解釋。因為據此不僅最終導得了Arrhenius方程,而且使反應系統的能量只與一般分子轉變成“活化分子”的標準摩爾熱力學能增量相關,而這一步是平衡過程,其能量服從Boltzmann分布。
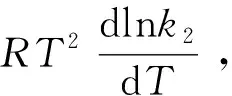
3 反應活化能及其Tolman解釋
那么,k2與溫度的關系如何呢?前文[6]已根據過渡狀態理論導得:
k2=βTn
(17)
式中β和n是兩個與溫度T無關的常數。其中,β是比例系數;n是T的冪次,其值可正可負,可以是整數也可以是分數。
式(15)也可表示為:
(18)

(19)
令積分常數D=lnA,則式(19)變為:
k=k2Ae-E/RT
(20)
將式(17)代入式(20),即得:
k=BTne-E/RT
(21)
式中B=Aβ。式(21)就是修正的Arrhenius方程,式中的E才是名副其實的反應活化能,其定義式即為式(18)。
在對實驗數據的描述上,式(21)要比原始的Arrhenius方程好得多,特別是在較寬的溫度范圍。作為一個例子,基元反應D+H2→DH+H,Michael等[7]用閃光光解等技術測定了它在167~1980K溫度范圍的反應速率常數,發現它能十分滿意地用下式來描述:
k=4.0×10-18T2.29exp(-21.8×103J/RT)cm3·molecule-1·s-1
NIST化學動力學數據庫擬合表明,這個三參數(B、n和E)方程的擬合均方根偏差為2.24×10-14,幾乎等于0,而用原始的兩參數(A和Ea)Arrhenius方程擬合的均方根偏差為0.37,顯然,前者要比后者好得多。擬合得到的活化能也有明顯的差別:E=21.8kJ·mol-1,而Ea=29.1kJ·mol-1。文獻[8]已用表列出了這兩個方程擬合的結果。
那么,反應活化能E的物理意義是什么呢?這可由式(14)和式(18)看出。由式(14)可知:
這就是說,k與k2之比等同于一般分子與“活化分子”間的平衡常數,故這個比值是可用Boltzmann能量分布來描述的。再由式(18)不難看出,這個比值也遵守Arrhenius型方程,故Tolman解釋同樣適用于反應活化能E。
參 考 文 獻
[1] Tolman R C.JAmChemSoc,1925,47:2652
[2] Hood J J.PhilMag,1878,6:371
[3] 韓德剛,印永嘉.化學教育,1981(增刊1):62
[4] Arrhenius S.ZeitPhysikChemie,1889,4:226
[5] 伊列敏 E И.化學動力學基礎.陳天明譯.福州:福建科學技術出版社,1985
[6] 劉國杰,黑恩成.大學化學,2013,28(2):77
[7] Michael J V,Fisher J R.JPhysChem,1990,94:3318
[8] 羅渝然,俞書勤,張祖德,等.大學化學,2010,25(3):35

