大腸桿菌S12無細胞系統合成AgrA蛋白的研究
瞿曉晶,權春善
(大連民族學院生物化學工程國家民委-教育部重點實驗室,遼寧大連116605)
金黃色葡萄球菌隸屬于葡萄球菌屬,是革蘭氏陽性菌[1],可引起許多嚴重感染,是一種重要的致病菌。agr系統是雙組分信號系統[2],能夠使該菌產生致病性并形成生物膜[3-4]。研究agr系統的調節原理,阻斷信號轉導,將使新型抗生素研究得到重大突破。反應調節子AgrA蛋白是agr系統的重要組成部分之一,其結構和功能目前尚不清楚,其研究的瓶頸是可溶性表達量較低。無細胞蛋白合成系統具有很多優勢,如:反應快速[5],下游處理簡單[6],不受細胞制約,蛋白表達量高,無細胞毒性[7],反應靈活易調節。郭新娟等簡化和優化了大腸桿菌細胞抽提物的制備過程[8],從而提高了細胞抽提物活性,并且優化了大腸桿菌S12無細胞蛋白表達系統。
本文利用無細胞蛋白合成系統,表達了AgrA蛋白,為AgrA的功能研究和agr系統的機制研究奠定了堅實的基礎。此外,溫度和時間對反應體系的影響很大,因此本文考察了不同溫度和時間對無細胞系統合成蛋白的影響。這些研究為agr系統的進一步研究奠定了實驗基礎,對于無細胞蛋白表達技術的研究和應用具有重要的借鑒意義,為金黃色葡萄球菌耐藥機制的研究和新型抗菌活性物質的研發提供了理論依據。
1 材料與方法
1.1 儀器及試劑
儀器:凝膠成像系統(GelDoc-ItTM300 Moterized lens,USA);多任務梯度PCR儀(VeritiTM96-WELL Thermal Cycler,singapore,England);BTX電擊儀(EMC630,USA)等。
試劑:一抗 Anti-His(C-Term)mouse(全式金,北京);二抗 Rabbit-Anti-Mouse;EasySee Western Marker(全式金,北京);EasySee Western Blot Kit(全式金,北京);pIVEX2.3d質粒載體(本實驗室保存);質粒 DNA小量提取試劑盒(BSC01M1,BioFlux);QIAprep Spin Miniprep Kit(27104,QIAGEN);其他試劑均為生化級,購自生工生物工程(上海)有限公司。
1.2 方法
1.2.1 體外表達載體的構建
首先利用PCR方法從pPROEXHTa-agrA上擴增目的片段agrA以構建表達載體pIVEX2.3d-agrA。引物與目標載體pIVEX2.3d具有~30 bps同源序列,與目的基因片段具有~20 bps同源序列。對PCR產物,即目的基因片段agrA,1%瓊脂糖凝膠電泳進行檢測,切膠回收。將PCR產物作為大引物,與載體pIVEX2.3d進行第二步PCR反應,實現目的基因插入到pIVEX2.3d載體之中。反應結束后,產物中包括空載體和插入目的基因的表達載體,采用DpnI消化法,消除母系空載體。消化反應結束后取5 μL產物進行電轉,宿主細胞是E.coli.DH5α。涂布過夜培養,挑取陽性單菌落,接菌培養,提取質粒,DNA測序驗證。
1.2.2 質粒載體的提純與檢測
采用QIAprep Spin Miniprep Kit試劑盒(QIAGEN公司)提取質粒:pIVEX 2.3d-agrA、pIVEX2.3d-GFP和 pIVEX2.3d-agrA-GFP。
1.2.3 大腸桿菌細胞抽提物的制備
(1)細胞培養。挑取E.coli BL21(DE3)codon-plus RIL單菌落于2×YT液體培養基中,次日以接種量5%接到2×YT培養基中,180 r·min-1,30℃培養,當細菌OD600達0.6時,加入終濃度為1 mM的IPTG。當OD600≈3.0時,細菌處于對數生長期中期,離心收菌,稱量濕重。
(2)在4℃下,每克收集的菌體用20 mL S30緩沖液 A重懸,離心收菌后浸液氮,保存于-70℃。
(3)在4℃下,每克細胞用1.27 mL S30緩沖液B溶解,解凍重懸。
(4)對菌體進行高壓破碎,4℃下12 000×g離心10 min,取上清。
(5)簡易空孵化。在37℃下將所得上清孵育30 min。
(6)分裝。浸液氮2 min后貯存于-70℃。
1.2.4 利用無細胞體系合成目的蛋白
在質粒的濃度和純度都符合無細胞蛋白表達系統的要求后,按照優化的無細胞反應體系,采用最簡S12細胞抽提物,進行AgrA、GFP、AgrA-GFP蛋白的合成。無細胞系統在180 r·min-1,30℃條件下,避光反應4 h(其中GFP表達條件需提供有氧環境)。按照優化的無細胞反應體系進行AgrA蛋白的合成,GFP作為對照,反應體系見表1。
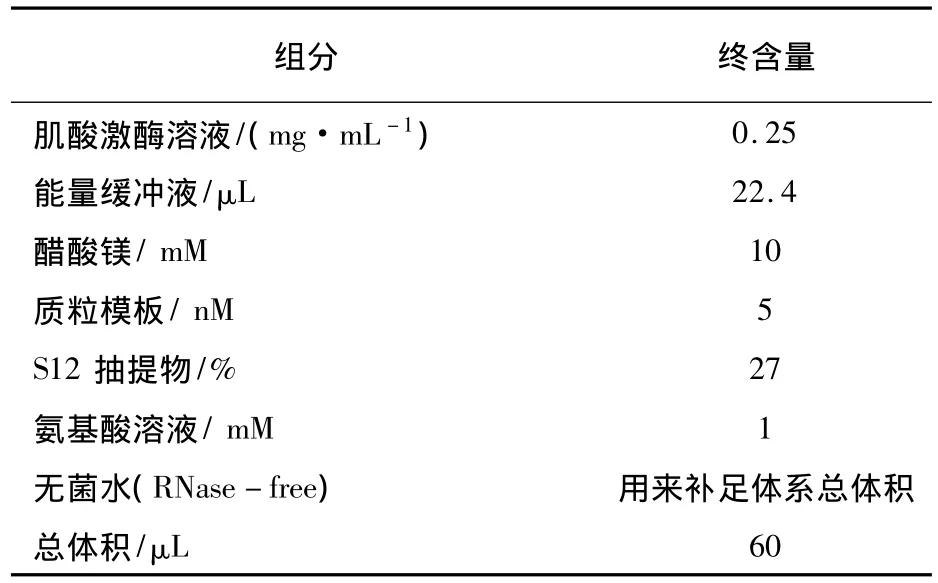
表1 優化的S12無細胞蛋白表達體系組成
1.2.5 目的蛋白的檢測
無細胞反應結束后,用丙酮處理反應產物:取5 μL反應產物于無RNase的離心管中,加50 μL丙酮,置于冰上靜置5 min。隨后10 000 r·min-1離心5 min。棄上清,風干20 min。用20 μL SDS-PAGE上樣緩沖液溶解沉淀,進行SDS-PAGE電泳。
質粒載體 pIVEX2.3d-agrA、pIVEX2.3d-GFP和pIVEX2.3d-agrA-GFP表達的蛋白在C端均帶有His標簽,通過Western blot進行檢測。
2 結果與討論
2.1 體外表達載體的構建
采用PCR方法擴增目的片段agrA(776 bps),進行1%瓊脂糖凝膠電泳檢測,對得到的目的產物進行切膠純化,之后使其作為大引物,線性擴增pIVEX2.3d目標載體。結束后,進行消化和電轉,得到pIVEX2.3d-agrA(4251 bps)質粒載體(如圖1),結果與預期相符。
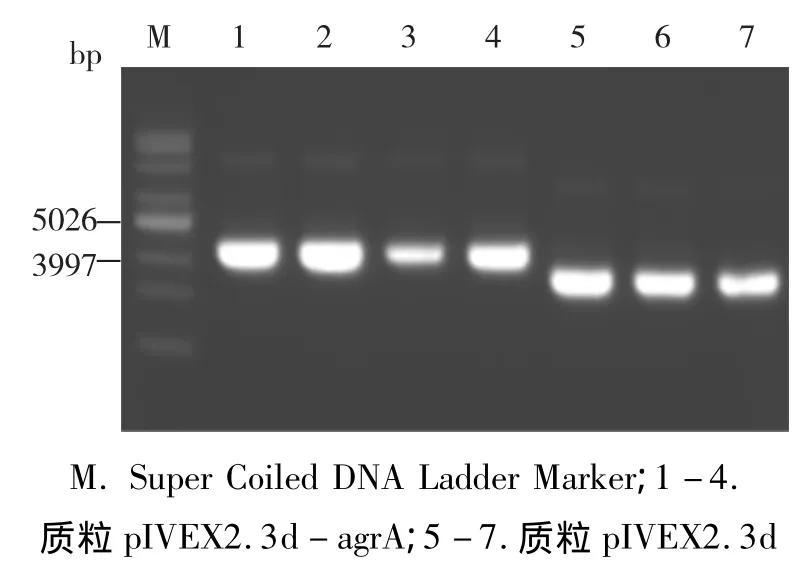
圖1 質粒pIVEX2.3d-agrA和pIVEX2.3d的電泳檢測圖
將得到的質粒進行DNA測序,對測序結果用DNAman軟件進行分析,其中,基因比對結果為99%,相應的蛋白質比對結果為100%,得到的質粒可用。
2.2 AgrA蛋白的合成與檢測
在進行無細胞蛋白合成反應時,由于GFP蛋白肉眼便能觀察到明顯熒光,故在蛋白AgrA加上GFP標簽,以便于對蛋白AgrA的合成進行檢測。本文分別對蛋白AgrA、GFP、AgrA-GFP進行合成反應。反應結束后,表達蛋白GFP和AgrA-GFP的試管便能肉眼明顯觀察到綠色熒光,AgrA和對照樣品試管觀察不到明顯的熒光。
對上述產物進行SDS-PAGE電泳檢測,觀測不到明顯的目的條帶。為了檢測蛋白的表達與否,對上述4組反應產物進行Western blot檢測,結果如圖2。由圖2可見,加入質粒模板的均有相應的蛋白表達,未加入任何模板的體系(4號)無蛋白表達。
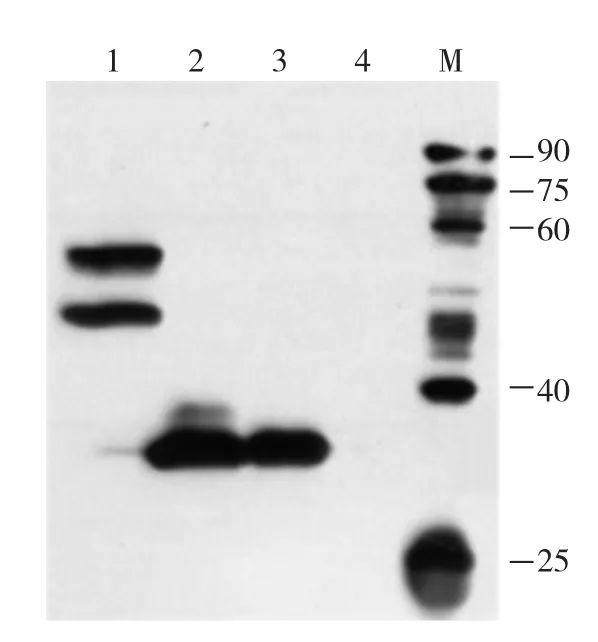
圖2 無細胞反應體系的Western blot檢測圖
從圖2看到,1號泳道對應的產物是蛋白AgrA-GFP(55.6 KD)。該泳道存在兩條帶,其中靠下的條帶比蛋白實際分子量小10 KDa左右;靠上的條帶與蛋白實際大小相符。有文獻報道:形成天然構象的GFP融合蛋白的凝膠條帶會比正常分子量小10 KDa左右,而GFP融合蛋白若未形成天然構象,其凝膠條帶會與其實際分子量大小相符[9]。靠上的條帶可能是沒有正確折疊的AgrA-GFP融合蛋白;靠下的條帶是正確折疊的AgrA-GFP融合蛋白,大小比實際分子量小10 KDa左右。2號和3號泳道對應的產物分別是GFP(26.2 KDa)和AgrA蛋白(26.3 KDa)。該凝膠條帶與實際分子量大小相符。可見,在優化的無細胞表達條件下,AgrA蛋白能夠得到有效表達。
2.3 不同反應溫度和時間對AgrA合成的影響
溫度和時間在無細胞反應過程中起著重要的作用。為了找到最佳的溫度和時間條件,在不同溫度、時間條件下,對AgrA和GFP蛋白進行表達,其中GFP蛋白易于觀察,起對照作用,用于蛋白的定量。反應結束后,GFP的熒光強度肉眼可以觀測,熒光強度從大到小依次為30℃、4 h,37 ℃、2 h,28 ℃、12 h,20 ℃、16 h,即在30 ℃、4 h條件下蛋白合成量最大。由western-blot檢測結果可知,在20℃、16 h條件下GFP蛋白表達量較低,沒有觀察到條帶,其他條件下均有清晰條帶,表明GFP表達(如圖3a)。AgrA的western-blot檢測結果如圖3b。由圖3b可見,不同條件下AgrA蛋白均有表達,其中20℃表達量比其他組稍低。綜合以上結果,最終確定30℃、4 h為最佳反應溫度和時間。
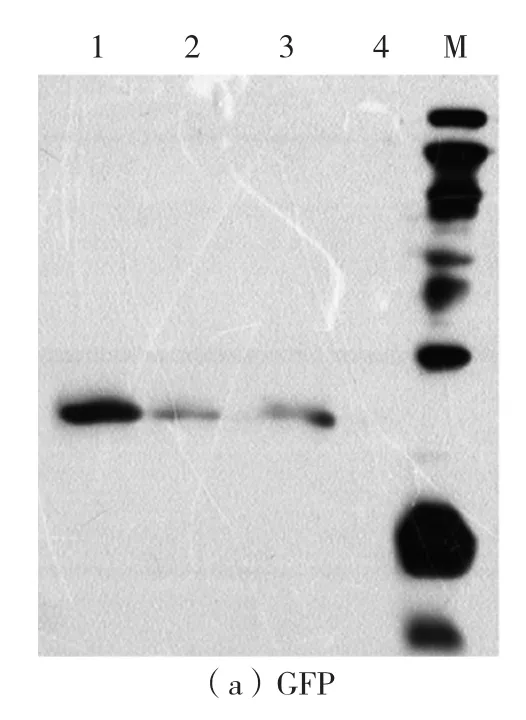
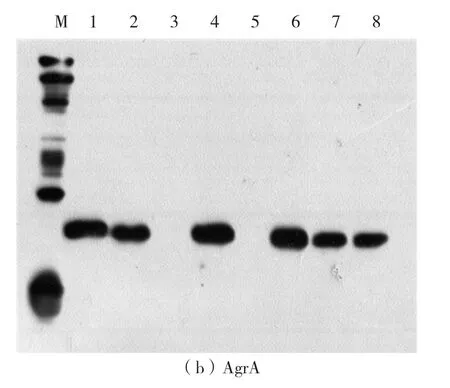
圖3 在不同溫度和時間條件下合成的AgrA和GFP蛋白的western blot檢測圖
3 結語
對蛋白的表達傳統方法是采用重組載體,在宿主菌體內表達,此方法有多種缺點:表達量低,細胞毒性大,易形成包涵體等。與體內蛋白表達相比,無細胞蛋白表達系統克服了上述缺點,具有操作快速,高通量,表達量高和不形成包涵體等優點。AgrA蛋白中的氨基酸含有半胱氨酸,在蛋白質合成過程中易形成二硫鍵,聚集在一起而形成包涵體,使蛋白不能正確折疊形成天然構象并且沒有活性。為克服AgrA蛋白在胞內表達的缺點,本文采用優化的S12無細胞系統合成AgrA蛋白。在AgrA蛋白的表達中,反應溫度和時間起著重要的作用,其中溫度的高低會影響蛋白的翻譯和修飾,反應時間的長短會影響酶的活性及反應轉化率。實驗結果表明,在30℃、4 h條件下蛋白的表達效果較好。
[1]HENKE J M,BASSLER B L.Bacterial social engagements[J].Trends Cell Biol,2004,14(11):648-656.
[2] WINZER K,WILLIAMS P.Quorum sensing and the regulation of virulence gene expression in pathogenic bacteria[J].International J Med Microbiol,2001,291(2):131-143.
[3]NOVICK RP,ROSS H,PROJAN S,et al.Synthesis of staphylococcal virulence factors is controlled by a regulatory RNA molecule[J].EMBO J,1993,12(10):3967-3975.
[4]夏培元.耐甲氧西林金黃色葡萄球菌的耐藥機制及其治療藥物的研究進展[J].國外醫藥:抗生素分冊,1999,20(4):178-180.
[5]JERMUTUS L,RYABOVA L A,PLUCKTHUN A.Recent advances in producing and selecting functional proteins by using cell-free translation[J].Curr Opin Biotech,1998,9(5):534-548.
[6]CARLSON E D,GAN R,HODGMAN C E,et al.Cell-free protein synthesis:Applications come of age[J].Biotechnol Adv,2011(30):1185-1194.
[7]NAKANO H,YAMANE T.Cell-free protein synthesis systems[J].Biotechnol Adv,1998,16(2):367-384.
[8]郭新娟,權春善,趙鵬超,等.大腸桿菌細胞抽提物制備方案的簡化與優化[J].生物工程學報,2013,29(4):532-535.
[9]GEERTSMA E R,GROENEVELD M,SLOTBOOM D J,et al.Quality control of over-expressed membrane proteins[J].Proc Natl Acad Sci,2008,105(15):5722-5727.

