應用富含血小板血漿構建組織工程骨的研究
張利難 馮瑞錚 張寶林
山西醫科大學第一附屬醫院整形外科,山西太原 030001
應用富含血小板血漿構建組織工程骨的研究
張利難 馮瑞錚 張寶林
山西醫科大學第一附屬醫院整形外科,山西太原 030001
目的 探究富含血小板血漿(PRP)是否能成為接種骨髓間充質干細胞(BMSCs)于3D支架中的有效媒介,是否具有促進骨組織再生、新生骨成熟及血管化的作用,為組織工程骨的構建策略及動物實驗和臨床應用提供理論依據。 方法 體外培養新西蘭兔BMSCs至第三代作為種子細胞,分別應用PRP組、乏血小板血漿(PPP組)重懸BMSCs,雙相接種法構建細胞/支架復合體,另設對照組,通過檢測支架內DNA含量、堿性磷酸酶(ALP)含量,對比細胞的接種效率、增殖和分化情況。結果PRP組的成骨量較PPP組和對照組顯著(P<0.05)。 結論 用PRP介導的雙相接種法可以促進BMSCs在細胞/支架復合物中增殖并向成骨分化;PRP雙相接種法是一種可行的構建組織工程骨的方法,具有很大的潛力和廣闊的應用前景。
組織工程骨;骨髓間充質干細胞;富含血小板血漿;3D-PLGA支架
骨組織工程的核心在于“仿生”,即構建適合成骨的內環境,模擬自然成骨機制,實現骨移植物與宿主組織的生物學相容,在成骨的同時組織工程支架材料逐步降解成無毒害代謝物,移植物復合體最終被新生骨組織替代。理想的組織工程骨應具有強大的骨誘導和血管生成潛能、生物學安全、低并發癥、構建程序簡便、使用壽命長等特征[1-2]。目前的移植物尚未完全達到上述標準。學者們在構建組織工程骨的嘗試中,逐漸認識到細胞和生物活性因子的復合構建比單純細胞或生物活性因子的構建成骨效果要好[3]。在成骨系細胞的體外培養實驗中,骨形態發生蛋白家族(Bmp)、血小板源生長因子 (PDGF)、血管內皮生長因子(VEGF)、轉化生長因子(TGF)是已被證實的具有促進細胞增殖和誘導成骨作用的細胞因子[4-7]。
富含血小板血漿(platelets-rich plasma,PRP)是將全血離心后得到的血小板濃縮物,濃度通常為全血的4~6倍,其被凝血酶激活后,可以釋放大量生長因子,如PDGF、TGF、VEGF、表皮生成長因子(EGF)、BMP 等[8]。 因此,以PRP為媒介復合種子細胞構建組織工程骨理論上有如下優勢:PRP源自宿主自體血漿,生物相容性好,不會產生免疫排斥反應;PRP在凝血酶激活下不僅可釋放大量生物活性因子,凝血反應所引發的由液-固態轉變過程有利于細胞黏附在支架上,提高種子細胞的接種效率[9];PRP所含成分和血漿相似,在一定程度上模擬了細胞增殖分化的微環境[10];提取PRP和添加凝血酶的過程較簡單,實際應用上操作可行。
兔骨髓間充質干細胞(MSCs)是理想的種子細胞。其有可以較容易地提取、具有強大的體外擴增能力和分化潛能、免疫排斥反應輕微等優點[11]。為了探究PRP能否在組織工程骨支架材料上促進種子細胞的黏附、增殖、分化,本研究以 MSCs為種子細胞設計了 2個實驗組,PRP組(MSCs+PRP+支架)和 PPP 組(MSCs+PPP+支架),另設一個空白對照組(MSCs+支架),比較MSCs的增殖和分化情況。
1 資料與方法
1.1 實驗動物
新西蘭白兔1只,2月齡,體重2.0~2.5 kg,雄性,來源于山西醫科大學實驗動物中心,動物等級為清潔型。
1.2 主要實驗試劑
DMEM 培養基(LowGlucose,Gibco)、胎牛血清(Hyclone)、β-甘油磷酸鈉(10 mmol/L,Sigma)、L-抗壞血酸(50 μg/ml,Sigma)、地塞米松(10-8mol/L,Sigma)、胰蛋白酶(0.25%,Sigma)、L-谷氨酰胺(Sigma)、青霉素-鏈霉素(100 U/ml)、TGF-β1(10 μg/L,Sigma)、吲哚美辛(50 μmol/L,Sigma)、IBMX(0.5 mmol/L,Sigma)、牛胰島素(10 mg/L,來寶生物公司)、PBS 緩沖液。 淋巴細胞分離液(Percoll,Sigma)、0.25%胰酶(Sigma)、枸櫞酸葡萄糖抗凝劑ACD(0.48 g枸櫞酸、1.32 g枸櫞酸鈉、1.47 g葡萄糖)、3D-PLGA支架、凝血酶溶液(10 000 U 凝血酶,Sigma)、10%CaCl2(Sigma)、骨細胞消化液、小牛胸腺DNA標準液、堿性磷酸酶(ALP)試劑盒(南京建成生物工程研究所)、0.1%茜素紅-Tris-HCl染液、1%甲苯胺藍染液、油紅染液。
1.3 實驗儀器
超凈工作臺,高速低溫離心機,孵箱,倒置相差顯微鏡,超聲細胞破碎機,熒光酶標儀。
1.4 MSCs原代培養及傳代
于一只新西蘭白兔無菌環境下用骨穿針抽取5 ml脛骨骨髓于10 ml注射器中(肝素鈉溶液1000 U/ml預先潤洗抗凝)。將抽取的骨髓液注入15 ml離心管中,1000 r/min,離心5 min。離心后可見液面上層淡黃色脂肪層。抽棄位于最上層的脂肪層,將骨髓液注入預熱的PBS緩沖液或DMEM培養基中,輕輕吹打混勻。新鮮配制的Percoll淋巴細胞分離液10 ml,將混勻后的液體按等體積緩緩加入Percoll中,避免沖破液面。2000 r/min離心,20 min。吸出中間淡黃色單核細胞層,移至25 cm2培養瓶中,加入低糖DMEM 10 ml, 其中含有 10%FBS,100 U/ml青霉素-鏈霉素。 調整細胞接種密度 1.0×104/ml,孵箱設定 37℃,5%CO2,孵育1 d,半量換液,倒置顯微鏡觀察細胞形態,繼續孵育,第3天全量換液。繼續培養大約2周時,可見大量多角行及紡錘形細胞增殖,待細胞90%融合時,0.25%胰酶消化、收集細胞至 15 ml離心管中,200×g離心10 min,棄上清液,DMEM重懸細胞團,以1.0×104/ml的密度接種于75 cm2培養瓶中,加入15 ml培養基,37℃,5%CO2孵育,每3天換液一次。細胞傳代培養至第三代凍存于-80℃液氮瓶中,備用于MSCs細胞驗證和細胞/支架復合體構建實驗。
1.5 MSCs細胞的驗證
1.5.1 成骨誘導分化及鑒定 37℃水浴快速復蘇第3代細胞,接種于6孔培養板,接種密度為1.0×104/ml,待細胞80%~90%融合時加入成骨誘導培養基(低糖全培養基中加入β-甘油磷酸鈉 10 mmol/L、L-抗壞血酸 50 μg/ml、地塞米松10-8mol/L)進行聯合誘導培養,培養至14 d后,PBS沖洗2次,95%乙醇固定10 min,雙蒸水沖洗3次。0.1%茜素紅-Tris-HCl(pH 8.3)37℃,30 min。 蒸餾水沖洗,干燥,封片。倒置顯微鏡下觀察染色結果。
1.5.2 成軟骨誘導分化及鑒定 細胞復蘇及培養方法同上,待細胞80%~90%融合時加入成軟骨誘導培養基(低糖全培養基中加入 L-抗壞血酸50 μg/ml、地塞米松10-8mol/L、TGF-β110 μg/L),培養至 14 d 后,用 10%甲醛固定 1 h,自來水沖15 min,蒸餾水洗一次,1%甲苯胺藍染2~4 h。加入95%乙醇,洗去多余的染液,倒置顯微鏡下觀察。
1.5.3 成脂誘導分化及鑒定 細胞復蘇及培養方法同上,待細胞80%~90%融合時加入成脂誘導培養基(低糖全培養基中加入 0.25 μmol/L 地塞米松,50 μmol/L 吲哚美辛,0.5 mmol/L IBMX,10 mg/L牛胰島素),誘導2周后,細胞經PBS洗滌,10%甲醛固定30 min,稀釋油紅儲存液,油紅∶去離子水=3∶2,濾紙過濾,室溫放置10 min,染色10 min左右。脫色,復染,甘油明膠封片。倒置顯微鏡觀察。
1.6 細胞/支架復合體構建
1.6.1 PRP和PPP的制備 配置抗凝劑ACD:0.48 g枸櫞酸,1.32 g枸櫞酸鈉,1.47 g葡萄糖溶于100 ml雙蒸水中,0.45 μm過濾消毒,冷藏備用。于一只新西蘭白兔心臟抽取全血 40 ml,其中加入 40 ml ACD,搖勻,移入 50 ml離心管,1000 r/min離心15 min。取上層血漿,棄紅細胞,二次離心,3000 r/min離心20 min。上層為清亮的PPP,移入另一個15 ml離心管中備用。中間層為白色的血小板,輕輕用吸管攪動吸出移至另一離心管中,下層紅細胞棄之。用少量PPP將血小板重懸,人工血小板計數,調節成濃度為106/μl的 PRP 備用。
1.6.2 支架的預處理 3D-PLGA支架規格為100 mm×30 mm×3 mm,PLA∶PGA=75∶25。 空隙率為 85%~90%, 孔徑大小100~300 μm。用11號尖刀片將大塊PLGA切成長寬均為10 mm,厚3 mm的立方體。將3D-PLGA小塊浸泡于75%乙醇中24 h,PBS緩沖液反復漂洗3次,然后將其多余水分吸干,經預濕處理后,再滴加細胞懸液,以增加支架的親水性。
1.6.3 構建細胞/支架復合體 將上述支架分3組,分別為PRP、PPP、空白對照組,每組8個樣本。將第三代種子細胞MSCs低速離心后,PRP組采用成骨誘導培養基加PRP溶液重懸細胞,PPP組采用成骨誘導培養基加PPP溶液重懸細胞,空白對照組單純采用成骨誘導培養基重懸細胞。運用細胞計數法調整細胞密度至5.0×107/ml,制成高密度細胞懸液。用微量移液槍吸取細胞懸液緩緩滴加于支架材料上,隨即滴加0.05 ml凝血酶溶液(10 000 U凝血酶加入10%CaCl2中),做到不使細胞溢出,移入六孔板中,每孔5 ml誘導培養基,放置孵箱中,37℃,5%CO2,孵育 1 h后,再次滴加細胞懸液于支架上,形成二次沉淀,以提高接種數量。接種后48 h倒置顯微鏡下觀察。第3天半量換液,以后每隔2~3 d全量換液。
1.7 細胞/支架復合體DNA定量分析
培養至第15天時,PBS緩沖液漂洗細胞/支架復合體2次,放入15 ml離心管中,剪成小塊,加1 ml骨細胞消化液,37℃水浴2 h。將消化混合液吸入15 ml離心管,超聲細胞破碎機處理 5 次,6 s/次,共 30 s,離心 200 r,5 min,取上清液待用。上清液50 μl置于48孔黑色不透光酶標板內,每個樣本2個副孔,每孔加150 μl Hoechst33258測試液(1 mg/ml),放入熒光酶標儀樣品槽,震蕩混勻30 s,選擇激發波長360 nm,發射波長460 nm,以小牛胸腺DNA作標準曲線,測定樣品的熒光強度。
1.8 細胞/支架復合體ALP活性定量分析
取方法6中的上清液,用ALP試劑盒(中國南京建成生物工程研究所)定量測定ALP活性。空白管加入雙蒸水0.05 ml、緩沖液和基質液各0.5 ml,標準管加入0.05 ml 0.1 mg/ml酚標準應用液、緩沖液和基質液各0.5 ml,測定管加入0.05 ml血清、緩沖液和基質液各0.5 ml。上述液體充分混合,置于37℃恒溫水浴15 min。然后每管各加入1.5 ml顯色劑,立即混勻,520 nm,0.5 cm或1 cm光徑比色,空白管調零,測各管吸光度。吸光度的OD值依據公式轉化為ALP活性。
1.9 統計學方法
采用統計軟件SPSS 18.0對實驗數據進行分析,所得結果均為計量資料,以均數±標準差表示,各組之間的比較采用單因素方差分析(one-way ANOVA)及Tukey HSD test,以P<0.05為差異有統計學意義。
2 結果
2.1 種子細胞的提取和體外擴增
運用密度梯度離心法成功提取兔BMSCs,經原代培養和傳代培養使其在體外大量擴增(圖1、2)。
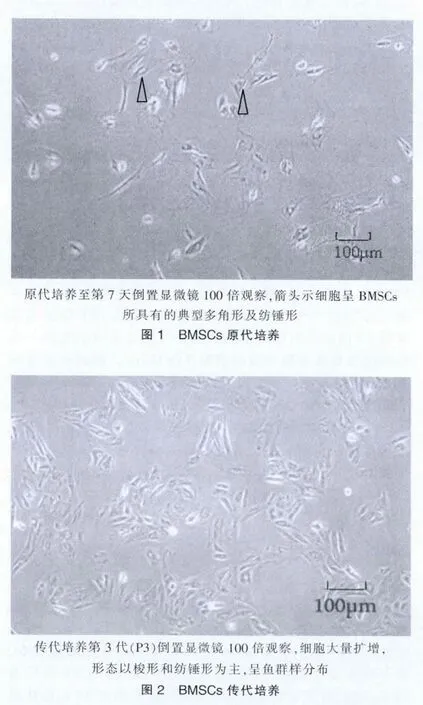
2.2 BMSCs細胞類型及分化潛能的驗證
為了驗證所提取的種子細胞是兔BMSCs,利用BMSCs具有多向分化潛能這一特征,在不同培養環境下促使其向脂肪細胞、成骨細胞、軟骨細胞分化,經細胞染色可見細胞呈現出目標細胞所具有的特征(圖3~5)。
上述結果說明實驗所提取的種子細胞確為兔骨髓間充質干細胞,在體外培養下仍具有多向分化潛能。
2.3 各組BMSCs/支架復合體DNA含量的比較
細胞在體外培養的增殖表現為DNA含量的增高,通過比較BMSCs/支架復合體中細胞DNA含量,可以反映出各組細胞數量的差異,進而說明細胞擴增的差異。PRP組的增殖趨勢較PPP組和空白對照組顯著,差異有統計學意義(P<0.05)。PPP組和空白對照組的DNA含量差異有統計學意義(P<0.05)(表 1)。
表 1 DNA 含量的比較(ng/ml,±s)
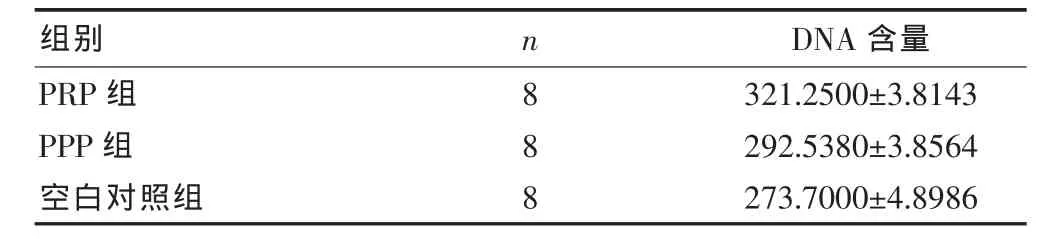
表 1 DNA 含量的比較(ng/ml,±s)
應用(one-way ANOVA)及 Tukey HSD test分析,F=32.202
組別 n DNA含量PRP組PPP組空白對照組888 321.2500±3.8143 292.5380±3.8564 273.7000±4.8986
2.4 各組BMSCs/支架復合體ALP活性的比較
成骨細胞的ALP含量與成骨細胞的數量呈正比;通過比較各組ALP值,間接反映出成骨細胞的數量,進而比較各組向成骨細胞分化的差異;PRP組的成骨分化較PPP組和空白對照組顯著,差異有統計學意義(P<0.05);PPP組和空白對照組的成骨分化差異無統計學意義(P>0.05)(表2)。
表 2 ALP 含量的比較(U/g prot,±s)
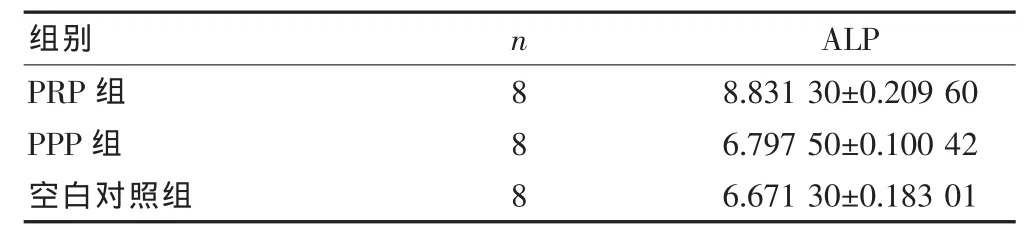
表 2 ALP 含量的比較(U/g prot,±s)
應用(one-way ANOVA)及 Tukey HSD test分析,F=50.379
組別 n ALP PRP組PPP組空白對照組888 8.831 30±0.209 60 6.797 50±0.100 42 6.671 30±0.183 01
3 討論
本實驗為使得種子細胞MSCs具有較好的生物活性,選用2月齡家兔作為骨穿對象。發現兔齡越小,相對于較大兔齡的BMSCsS,其活性更好,細胞增殖速率較快,傳代周期短。而兔齡過小帶來的缺點是增加了骨穿的難度,骨穿針易滑脫甚至穿過對側骨皮質。此外,兔齡過小則單次抽取的骨髓量不宜過多,容易出現骨髓液被大量外周血稀釋的情況,故通常在2個以上穿刺點抽取骨髓液,以避免上述情況的發生。
MSCs體外培養過程中,細胞的接種密度不宜過高,細胞接種密度越高,培養條件亦相應增高,低密度接種有利于細胞順利貼壁和擴增[12]。選擇接種密度為1.0×104cells/cm2作為細胞接種于培養瓶的接種密度;選擇5×107cells/ml作為接種于支架的細胞懸液濃度。研究表明,細胞接種密度對于MSCs接種于支架材料后的分化潛能有很大影響[13]。細胞接種密度過小,細胞黏附于內部支架材料的數量少,不利于細胞擴增;細胞密度過大可能會超出孔隙的運輸能力,引起養分相對不足,代謝產物堆積。2×107~6×107cells/ml是一個相對合適的范圍。
有研究表明,骨髓間充質干細胞的數量(而不是單獨的總數量的細胞/支架),與骨形成存在潛在的呈正相關[14]。因此,骨髓間充質干細胞的數量這一參數可以作為評價和預測組織工程骨骨質生成能力的指標之一。細胞/支架復合體經體外培養15 d后,大多數MSCs經歷了細胞增殖周期向成骨細胞分化[15]。通過分析支架細胞的DNA含量和ALP含量,探究PRP是否具有促進MSCs增殖并向成骨細胞分化的作用。表1、2結果顯示,PRP組DNA含量和ALP含量較PPP組和空白對照組增高,經統計學軟件SPSS 18.0 one-way ANOVA方差分析,PRP組和PPP組、對照組分析結果均得出P<0.05,可以認為PRP是否具有促進MSCs增殖并向成骨細胞分化的作用。而分析PPP組和對照組DNA含量得出P<0.05,ALP值P>0.05。可以認為PPP有一定的促進MSC細胞增殖的作用,也可能存在PPP中血小板未完全分離棄去,或者在細胞換液時操作不當造成誤差。
目前,PRP在組織工程領域受到廣泛關注。有學者以PRP 復合Ⅰ型膠原珠(type Ⅰ collagen beads,CIB)、BMSCs構建組織工程骨植入兔骨缺損模型,證實該復合移植物有效地促進骨質生成修復骨缺損[16]。PRP應用于軟骨缺損修復動物模型,被證實可有效地釋放內源性生長因子,其復合 BMSCs和脂肪干細胞(adipose derived stem cells,ADSC)的組織工程骨均有效修復兔骨缺損[17]。德國學者Kasten等[18]對比研究了PRP和VEGF在兔大段骨缺損動物模型上成骨及血管化進程,通過組織學測定和大體CT攝像結果分析,認為PRP和VEGF均有血管化作用,并且PRP的成骨作用強于VEGF。分析原因可能是PRP釋放的生長因子是一類協同刺激因子,較單一的生長因子效果明顯。雷華等[19]用PRP介導的雙相接種法構建組織工程骨成骨效果顯著,成功修復山羊顱骨缺損。在口腔頜面外科領域,有學者嘗試用PRP復合牙髓細胞作為實驗組,以血凝塊組,牙髓細胞組,PRP組對照,PRP復合牙髓細胞有效地促進了牙根周圍及牙髓組織的組織再生[20]。
本實驗結果顯示,以PRP為媒介雙向接種法構建的組織工程骨促進BMSCs在細胞/支架復合物中的增殖,并促進向成骨細胞分化。PRP雙相接種法是一種可行的構建組織工程骨的方法,具有很大的潛力和廣闊的應用前景。
[1]Finkemeier CG.Bone-grafting and bone-graft substitutes[J].Bone Joint Surg Am,2002,84-A(3):454-464.
[2]Younger EM,Chapman MW.Morbidity at bone graft donor sites[J].Orthop Trauma,1989,3(3):192-195.
[3]Perka C,Schultz O,Spitzer RS,et al.The influence of transforming growth factor beta1 on mesenchymal cell repair of full-thickness cartilage defects[J].Biomed Mater Res,2000,52(3):543-552.
[4]Guo X,Park H,Young S,et al.Repair of osteochondral defects with biodegradable hydrogel compositesencapsulating marrow mesenchymal stem cells in a rabbit model[J].Acta Biomater,2010,6(1):39-47.
[5]Guo X,Liao J,Park H,et al.Effects of TGF-beta3 and preculture period of osteogenic cells on thechondrogenic differentiation of rabbit marrow mesenchymal stem cells encapsulatedin a bilayered hydrogel composite[J].Acta Biomater,2010,6(8):2920-2931.
[6]van Hout WM,Mink van der Molen AB,Breugem CC,et al.Reconstruction of the alveolar cleft:can growth factor-aided tissue engineering replace autologous bone grafting?A literature review and systematic review ofresults obtained with bone morphogenetic protein-2[J].Clin Oral Investig,2011,15(3):297-303.
[7]Tamama K,Kawasaki H,Wells A.Epidermal growth factor (EGF)treatment on multipotential stromal cells (MSCs).Possible enhancement of therapeutic potential of MSC[J].Biomed Biotechnol,2010,2010:795385.
[8]唐鳳勤,鄒德榮.PRP復合間充質干細胞在頜骨組織工程領域的應用[J].口腔頜面外科雜志,2008,18(3):210-213.
[9]Intini G,Andreana S,Intini FE,et al.Calcium sulfate and plateletrich plasma make a novel osteoinductive biomaterial for bone regeneration[J].Transl Med,2007,7(5):13.
[10]張森林,毛天球.應用富血小板血漿和骨髓基質細胞構建細胞-膜片及其以為成骨的實驗研究[J].臨床口腔醫學雜志,2009,25(3):147-150.
[11]Tonti GA,Mannello F.From bone marrow to therapeutic applications:different behaviour andgenetic/epigenetic stability during mesenchymal stem cell expansion in autologousand foetal bovine sera?[J].Dev Biol,2008,52(8):1023-1032.
[12]Lapi S,Nocchi F,Lamanna R,et al.Different media and supplements modulate the clonogenic and expansion properties of rabbit bone marrow mesenchymal stem cells[J].BMC Res Notes,2008,28(1):53.
[13]Kavalkovich KW,Boynton RE,Murphy JM,et al.Chondrogenic differentiation of human mesenchymal stem cells within an alginatelayer culture system[J].In Vitro Cell Dev Biol Anim,2002,38(8):457-466.
[14]Braccini A,Wendt D,Farhadi J,et al.The osteogenicity of implanted engineered bone constructs is related to thedensity of clonogenic bone marrow stromal cells[J].Tissue Eng Regen Med,2007,1(1):60-65.
[15]雷華,肖苒,曹蕊,等.富含血小板血漿雙相接種法構建組織工程骨[J].中國美容醫學,2011,20(3):402-407.
[16]Lin BN,Whu SW,Chen CH,et al.Bone marrow mesenchymal stem cells,platelet-rich plasma andnanohydroxyapatite-type Ⅰcollagen beads were integral parts of biomimetic bonesubstitutes for bone regeneration[J].Tissue Eng Regen Med,2012,doi:10.1002/term.1472.
[17]Xie X,Wang Y,Zhao C,et al.Comparative evaluation of MSCs from bone marrow and adipose tissue seeded inPRP-derived scaffold for cartilage regeneration[J].Biomaterials,2012,33(29):7008-7018.
[18]Kasten P,Beverungen M,Lorenz H,et al.Comparison of platelet-rich plasma and VEGF-transfected mesenchymal stem cells onvascularization and bone formation in a critical-size bone defect[J].Cells Tissues Organs,2012,196(6):523-533.
[19]雷華,唐曉軍,彭喆,等.富含血小板血漿雙相接種法構建的組織工程骨修復山羊顱骨缺損[J].中國美容醫學,2011,20(4):581-585.
[20]Zhu W,Zhu X,Huang GT,et al.Regeneration of dental pulp tissue in immature teeth with apical periodontitis using platelet-rich plasma and dental pulp cells[J].Int Endod J,2013.[Epub ahead of print]
The experiment of constructing tissue engineering bone with platelet-rich plasma
ZHANG Li-nan FENG Rui-zheng ZHANG Bao-lin
Department of Plastic Surgery,the First Affiliated Hospital of Shanxi Medical University,Shanxi Province,Taiyuan 030001,China
ObjectiveTo investigate whether platelet-rich plasma(PRP)could be the effective seeding media of MSCs in 3D scaffold,whether PRP could enhance the effect or progress of osteogenesis,maturation and vascularization of new bone tissue,it is expected to further provide reference for strategy of bone engineering construction,animal experiments and clinical application.MethodsTo culture bone marrow mesenchymal stem cells(BMSCs)of New Zealand rabbit in vitro,to adopt the third generation as seeding cell,to construct tissue engineering bones respectively with PRP biphasic seeding and PPP biphasic seeding,so that the combination of cell/scaffold could be formed,and the control group was established.By means of testing DNA contents and ALP contents in the cell/scaffold combinations,the proliferation and differentiation comparison between PRP group and PPP group could be evaluated.ResultsThe osteogenesis effect in PRP group was more remarkable compared to PPP group and control group(P<0.05).ConclusionThe tissue engineering bone constructed by the PRP biphasic seeding strategy can promote the proliferation and osteogenesis of BMSCs in vivo.The PRP biphasic seeding is a practical way to construct tissue engineering bone,which has great potential and broad application prospects.
Tissue engineering bone;Bone mesenchymal stem cell;Platelet-rich plasma;3D-PLGA scaffold
R62
A
1674-4721(2013)08(b)-0020-05
2013-04-12 本文編輯:林利利)

