酒制瑞香狼毒對荷瘤小鼠抑瘤作用及機制的實驗研究
馬曉莉, 劉晉芝, 曹松云, 王 淼, 張新穎
(河北大學中醫學院,河北保定 071000)
瑞香狼毒為瑞香科狼毒屬植物Stellera chamaejasmeL.的干燥根,其味苦、辛,性平,有毒,入肝、肺、脾三經,有逐水、祛痰、破積、殺蟲之功效[1]。瑞香狼毒用于治療腫瘤在我國已有悠久的歷史。諸多文獻報道生藥狼毒既有明顯的體外抗腫瘤作用[2],又具有非常強的體內抗腫瘤作用[3],其含藥血清也有明顯的抗腫瘤作用[4]。但瑞香狼毒全草有毒,特別是對胸腺、脾臟等重要器官毒副作用較大。蒙醫在防病、治病的實踐中,摸索出狼毒的多種炮制方法,以達到減毒增效的目的,其中酒制狼毒有抗腫瘤作用,但炮制機理研究較少。本文通過H22荷瘤小鼠體內抑瘤實驗,考察了酒制對瑞香狼毒抑瘤作用的影響,探討其抑瘤機制,為瑞香狼毒的進一步開發、應用提供實驗依據。
1 材料與方法
1.1 藥品與試劑 狼毒購自安國市昌達中藥材飲片有限公司,留300 g作為生藥狼毒組的用藥;酒制狼毒的制備:另外取300 g狼毒飲片,制備酒制狼毒,加60°白酒 (紅星二鍋頭,北京紅星公司產品)沒過狼毒,浸泡6 h后,用文火煮至白酒完全被狼毒吸收,60℃烘干。
1.2 實驗動物與瘤株 實驗動物為雄性昆明種小鼠,體質量 (20±2)g,購自河北醫科大學實驗動物中心,實驗動物合格證號1112090。瘤株為H22小鼠腹水型肝癌細胞株,由河北大學基礎醫學院微生物免疫實驗室惠贈。
1.3 動物處理與分組 先從80只小鼠中隨機取10只不接種腫瘤,作為空白對照組;余下的70只接種腫瘤。取接種6 d腫瘤生長良好的小鼠腹水,用生理鹽水稀釋成1×106/mL,以每只0.2 mL的量接種于小鼠右側腋窩皮下,接種后24 h隨機分為7組,第一組為腫瘤對照組,其余6組為治療組,即生藥狼毒低、中、高劑量組 (低、中、高劑量分別為5、10、20 g/kg體質量的生藥狼毒藥液),酒制狼毒低、中、高劑量組 (低、中、高劑量分別為5、10、20 g/kg體質量的酒制狼毒藥液),空白對照組和腫瘤對照組給20 g/kg體質量的生理鹽水。接種24 h后開始灌胃1 mL,每天1次連續8 d。于停藥后次日處死小鼠,稱體質量解剖皮下瘤塊,取脾臟和胸腺,分別再稱定質量,計算腫瘤抑制率和脾、胸腺指數。
1.4 指標測定
1.4.1 體質量增長 將腫瘤對照組、狼毒生藥對照組和酒制狼毒低、中、高劑量各組小鼠在接種腫瘤后24 h稱取實驗動物體質量,并以苦味酸作標記,末次給藥后24 h再次稱取體質量并減去瘤質量,兩次體質量差即為體質量增長指標。
1.4.2 抑瘤率 按1978年全國抗癌藥物研究協會制定的《抗腫瘤藥物體內篩選規程》判定腫瘤抑制率[5]。將狼毒生藥組和酒制狼毒低、中、高劑量各組小鼠末次給藥后24 h處死動物,剝離瘤體電子天平稱定質量,計算抑瘤率。

1.4.3 脾指數的測定 將所有各組小鼠采用稱重法將小鼠稱定質量后脫頸處死,剝離脾臟,電子天平稱定質量,計算脾指數 (mg/g)。

1.4.4 胸腺指數的測定 將所有各組小鼠采用稱重法將小鼠稱定質量后脫頸處死,剝離胸腺,電子天平稱定質量,計算脾指數 (mg/g)。

1.4.5 Bax、Bcl-2免疫組織化學染色 將生藥狼毒組和酒制低、中、高劑量組小鼠脫頸椎處死后很快取出腫瘤,置于4%多聚甲醛溶液中固定,常規脫水、透明、包埋成石蠟切片,每張均切4 μm薄的切片,準備做免疫組化。免疫組化步驟:石蠟切片,60℃烤箱烤片20 min后,二甲苯脫蠟、不同濃度酒精脫水,3%H2O2去離子水孵育30 min,以封閉內源性過氧化物酶;0.1 mol/L枸櫞酸緩沖液(pH 6.0)微波修復;自然冷卻至室溫;分別用兔抗鼠Bax和Bcl-2抗體 (Santa cruz,1∶100)孵育切片 (4℃,過夜);滴加試劑1,37℃恒溫水浴鍋濕盒內孵育20 min;滴加試劑2,37℃恒溫水浴鍋濕盒內孵育20 min;DAB避光顯色1至2 min。每步驟間用0.01 mol/L PBS充分洗滌,再經過石蠟切片的常規梯度酒精脫水、二甲苯透明、中性樹膠封片,顯微鏡下觀察、拍攝照片。對照試驗:省去一抗或用PBS代替一抗孵育切片,結果為陰性。
1.5 統計分析
1.5.1 使用醫學圖像分析儀 (TN-8502),鏡下觀察狼毒生藥組和酒制狼毒低、中、高劑量各組染色結果,并測定細胞灰度值,用該儀器自帶分析軟件分析相應抗體的表達量。以上四組每組取五張切片,每張切片選五個視野,計算其平均值即為該張切片的灰度值,五張切片的平均值為該組的灰度值。
2 實驗結果
2.1 酒制狼毒各組對抑瘤率的影響 生藥狼毒對荷瘤小鼠的腫瘤生長有明顯的抑制作用,20 g/kg體質量生藥狼毒灌胃抑瘤作用最好,抑瘤率為69.45%,5、10 g/kg生藥狼毒抑瘤率為46.78%、52.34%。經過用白酒炮制后狼毒對腫瘤的抑制作用明顯增強,酒制狼毒低、中劑量組的抑瘤率分別高達98.40%、87.16%,高劑量酒制狼毒對腫瘤的抑制和生藥狼毒比有所下降,抑瘤率為50.21%。見表1。
表1 生藥狼毒和各組酒制狼毒對H22荷瘤小鼠抑瘤率的影響(±s,n=10)Tab.1 Effect of tumor inhibition of liquor-saturated Stellera chamaejasme and crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)

表1 生藥狼毒和各組酒制狼毒對H22荷瘤小鼠抑瘤率的影響(±s,n=10)Tab.1 Effect of tumor inhibition of liquor-saturated Stellera chamaejasme and crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
注:與腫瘤對照組比較,▲P<0.05;與生藥狼毒高劑量組比較,■P<0.05。
組 別 瘤質量/g 抑瘤率/%腫瘤對照組0.655 6±0.416 9 -生藥狼毒低劑量組 0.545 0±0.396 6▲ 46.78生藥狼毒中劑量組 0.418 9±0.527 8▲ 52.34生藥狼毒高劑量組 0.200 3±0.176 4▲ 69.45酒制狼毒低劑量組 0.010 5±0.011 2▲■ 98.40酒制狼毒中劑量組 0.084 2±0.101 4▲■ 87.16酒制狼毒高劑量組 0.326 4±0.366 2▲50.21
2.2 酒制狼毒各組對體質量增長、脾臟和胸腺的影響 與空白對照組比較,生藥狼毒組和酒制狼毒低、中、高劑量組的體質量增長均P>0.05,無明顯變化;與空白對照組比較,酒制狼毒低、中、高劑量各組對脾臟、胸腺的毒副作用小,脾指數、胸腺指數均P>0.05;生藥狼毒組對脾臟、胸腺影響較大,與空白對照組比較脾指數、胸腺指數均P<0.05;與生藥狼毒組比較,酒制狼毒低、中、高劑量各組的脾指數和胸腺指數均P<0.05。見表2。
2.3 生藥狼毒和各組酒制狼毒對Bax及Bcl-2表達的影響 與生藥狼毒組比較,酒制狼毒各組明顯使Bax表達上調,Bcl-2的表達下調,P<0.05有統計學意義。見表3。
表2 生藥狼毒和各組酒制狼毒對H22荷瘤小鼠體質量增長、脾指數、胸腺指數的影響 (±s,n=10)Tab.2 Effect of body weight,thymus index,spleen index in liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
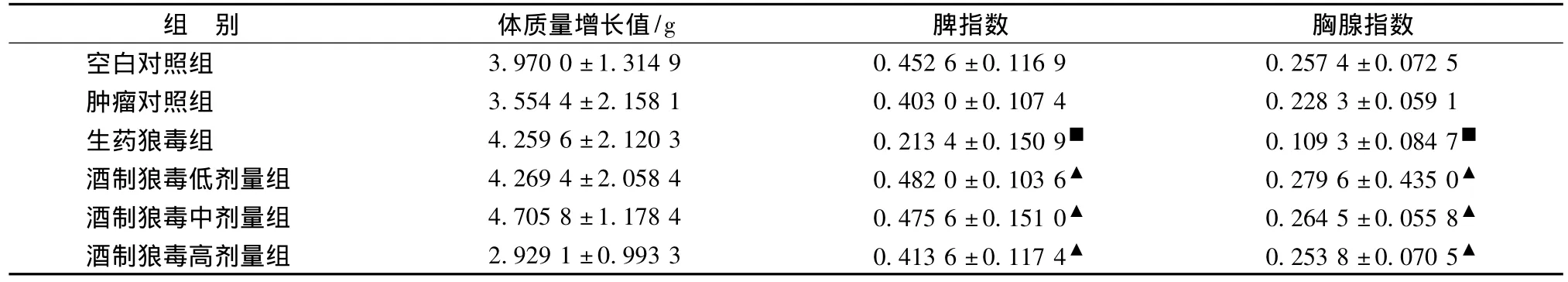
表2 生藥狼毒和各組酒制狼毒對H22荷瘤小鼠體質量增長、脾指數、胸腺指數的影響 (±s,n=10)Tab.2 Effect of body weight,thymus index,spleen index in liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
注:與空白對照組比較,■P<0.05,與生藥狼毒組比較,▲P<0.05。
脾指數 胸腺指數空白對照組組 別 體質量增長值/g 3.970 0±1.314 9 0.452 6±0.116 9 0.257 4±0.072 5腫瘤對照組 3.554 4±2.158 1 0.403 0±0.107 4 0.228 3±0.059 1生藥狼毒組 4.259 6±2.120 3 0.213 4±0.150 9■ 0.109 3±0.084 7■酒制狼毒低劑量組 4.269 4±2.058 4 0.482 0±0.103 6▲ 0.279 6±0.435 0▲酒制狼毒中劑量組 4.705 8±1.178 4 0.475 6±0.151 0▲ 0.264 5±0.055 8▲酒制狼毒高劑量組 2.929 1±0.993 3 0.413 6±0.117 4▲ 0.253 8±0.070 5▲
表3 Bax、Bcl-2在各組酒制法狼毒和生藥狼毒組中表達的比較 (±s)Tab.3 Comparison of Bax and Bcl-2 on liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme(±s)
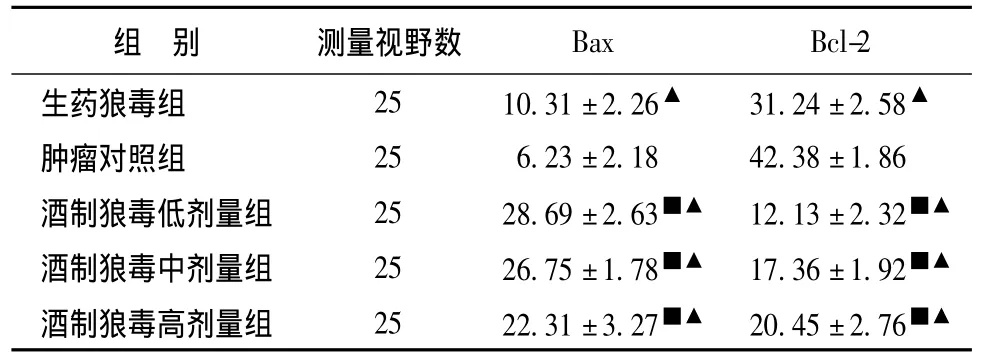
表3 Bax、Bcl-2在各組酒制法狼毒和生藥狼毒組中表達的比較 (±s)Tab.3 Comparison of Bax and Bcl-2 on liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme(±s)
注:與生藥狼毒組比較,■P<0.05;與腫瘤對照組比較,▲P<0.05。
組 別 測量視野數Bax Bcl-2生藥狼毒組 25 10.31±2.26▲ 31.24±2.58▲腫瘤對照組 25 6.23±2.18 42.38±1.86酒制狼毒低劑量組 25 28.69±2.63■▲ 12.13±2.32■▲酒制狼毒中劑量組 25 26.75±1.78■▲ 17.36±1.92■▲酒制狼毒高劑量組 25 22.31±3.27■▲ 20.45±2.76■▲
取生藥狼毒組和酒制狼毒低、中、高劑量組的腫瘤,做免疫組化常規DAB顯色,Bax表達陽性的為細胞質有棕黃色顆粒,與腫瘤對照組比較,生藥狼毒和酒制狼毒棕黃色顆粒都有增加;與生藥狼毒組比較,酒制毒低、中劑量棕黃色顆粒增加較多,高劑量增加較少 (見圖1)。
取生藥狼毒組和酒制狼毒低、中、高劑量組的腫瘤,做免疫組化常規DAB顯色,Bcl-2表達陽性的為細胞質有棕黃色顆粒,與腫瘤對照組比較,生藥狼毒組和酒制狼毒棕黃色顆粒減少;與生藥狼毒組比較,酒制狼毒低、中劑量棕黃色顆粒明顯減少,高劑量亦減少,與低、中劑量比稍高 (見圖2)。
3 討論
因昆明種小鼠和裸鼠的荷瘤率均為100%,本實驗目的是研究酒制狼毒抗腫瘤的作用及對胸腺、脾臟等重要臟器的影響,所以荷瘤小鼠選的是昆明種小鼠而非裸鼠。

圖1 生藥狼毒和各組酒制狼毒及腫瘤對照組Bax的表達 (DAB×400)Fig.1 Comparison of the expression of Bax among crude Stellera chamaejasme,groups of liquorsaturated Stellera chamaejasme and tumor contrast(DAB×400)
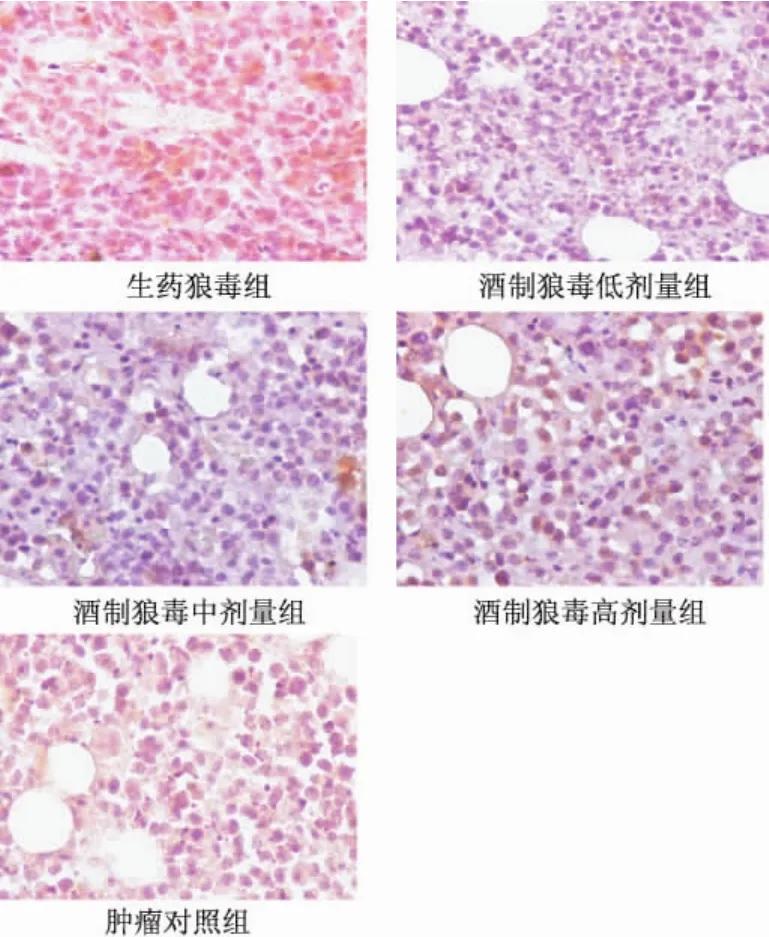
圖2 生藥狼毒和各組酒制狼毒及腫瘤對照組Bcl-2的表達 (DAB×400)Fig.2 Comparsion of the expression of Bcl-2 among groups of crude Stellera chamaejasme,liquorsaturated Stellera chamaejasme and tumor contrast(DAB×400)
中藥狼毒在中國被廣泛應用于治療腫瘤,其中有多種成分被發現有抗腫瘤的功能[6]。本實驗通過動物實驗證實生藥狼毒的抗腫瘤作用明顯。在表1中可以看到生藥狼毒的最大抑瘤率達到69.45%。炮制后,低、中劑量酒制狼毒抑瘤率大幅提高,尤其低劑量酒制狼毒的抑瘤率高達98.40%,中劑量酒制狼毒也達到87.16%,比同劑量生藥狼毒的抑瘤率增加,這說明用白酒炮制后能顯著提高生藥狼毒的療效。狼毒又名斷腸草[7],對身體的危害較大,用白酒炮制后低劑量就能達到很好的抑瘤作用,這樣就可以減少狼毒的用量,從而能減輕狼毒對身體的傷害。至于高劑量酒制狼毒比生藥狼毒的抑瘤率降低,需進一步做實驗探討其機理。
經白酒炮制后既提高了狼毒的療效亦能降低其對脾臟和胸腺的損害,從表2中可以看到,與正常對照組比較,酒制低、中、高劑量組的脾指數和胸腺指數P>0.05,說明沒有差異,經白酒炮制后狼毒的毒性明顯降低,對脾、胸腺沒有明顯損害。與正常對照組比較,生藥狼毒的脾指數和胸腺指數均P<0.05,說明有顯著性差異,生藥狼毒對脾和胸腺的損傷較大。從表2數據可以得出,與生藥狼毒組比較,酒制低、中、高劑量各組的脾指數和胸腺指數均P<0.05,說明經白酒炮制后確實減輕了狼毒的毒性,明顯降低了對這些免疫臟器的損傷。經白酒炮制后用較低劑量的狼毒就能達到很理想的抑瘤作用,對脾、胸腺等重要器官又沒有明顯的毒副作用,為狼毒用于臨床抗腫瘤提供新的思路。
酒制狼毒與生藥狼毒比較能顯著提高抑瘤率,其作用機制可能是使Bax的表達明顯上調,Bcl-2的表達逐漸下調。抗凋亡基因編碼的Bcl-2蛋白主要分布在線粒體外膜、細胞膜內表面、內質網膜及核膜等處[8]。它廣泛存在于造血細胞、上皮細胞、淋巴細胞、神經細胞及多種腫瘤細胞,體內和體外實驗都表明Bcl-2基因可抑制各種刺激下多種細胞的凋亡[9]。Bcl-2抗凋亡的機制目前認為主要有:①拮抗促凋亡基因bax;②抑制促凋亡的蛋白質細胞色素c自線粒體釋放到胞質;③ 阻止胞質中的細胞色素c激活caspase;④有抗氧化及維持細胞內鈣穩態等作用[10]。Bax基因屬于Bcl-2基因家族,編碼的Bax蛋白可與Bcl-2形成異二聚體,對Bcl-2產生阻抑作用。研究發現Bax/Bcl-2兩蛋白之間的比例關系是決定對細胞凋亡抑制作用強弱的關鍵因素,因此認為,Bax是極重要的促細胞凋亡基因之一[11]。Bcl-2基因啟動子具有NF-κB的結合位點并受其調控,故NF-κB可活化通過誘導Bcl-2及其他抗凋亡基因而阻止細胞凋亡。也可通過刺激IL-1β轉化蛋白酶、c-myc和TNF-α基因表達而導致細胞凋亡[12]。
本研究結果顯示,與腫瘤對照組比較,生藥狼毒組和各組酒制狼毒小鼠腫瘤細胞Bax蛋白表達量高,Bcl-2蛋白表達降低,從而促進了腫瘤細胞凋亡,這與前面生藥狼毒和各組酒制狼毒均有明顯的抑瘤作用一致;與生藥狼毒組比較,酒制狼毒低、中、高劑量各組小鼠腫瘤細胞Bax蛋白表達量高,Bcl-2蛋白有表達降低。表明酒制狼毒比生藥狼毒抑瘤作用提高可能是通過調控Bax和Bcl-2的表達,促進了腫瘤細胞的凋亡。
本實驗結果顯示,生藥狼毒經白酒炮制后既大大提高了抑瘤作用,又顯著降低了對胸腺、脾臟的毒副作用,臨床可考慮用酒制狼毒代替生藥狼毒入藥,但其藥效物質基礎需進一步研究。
[1]鄭寶江,胡海清.黑龍江省松嫩草地瑞香狼毒總黃酮含量的變化[J].東北林業大學學報,2006,34(4):59-60.
[2]胡蓉蓉,王義善.瑞香狼毒抗腫瘤作用研究進展[J].人民軍醫,2010,53(2):151-152.
[3]羅慧英,王愛勤.不同極性溶媒瑞香狼毒提取物的抗腫瘤活性比較[J].中國臨床藥理學與治療學,2005,10(10):1140-1142.
[4]楊 柯,王義善,王莉平,等.狼毒藥理作用研究及臨床應用情況概述[J].臨床醫學,2010,23(7):2496-2498.
[5]曹新偉,馮衛生.狼毒的化學成分研究進展[J].河南中醫學院學報,2004,19(6):81-84.
[6]楊 柯,張京玲,黃 謙,等.狼毒水提液對人A549肺癌細胞凋亡的影響[J].實用中西醫結合臨床,2011,11(5):88.
[7]郭曉莊.有毒中草藥大辭典[M].天津:天津科技翻譯出版公司,1992.446.
[8]孫曉芳,段 斐,寇素茹,等.低頻電磁場對大鼠生精細胞凋亡基因表達影響[J].中國公共衛生,2009,25(8):989-990.
[9]曹志然,戎瑞雪,王 蓓,等.馬鞭草水提取物對荷瘤小鼠抑瘤作用的實驗研究[J].醫學研究與教育,2009,26(5):1-3.
[10]王 敏,賈正平,馬 駿,等.瑞香狼毒總黃酮提取物的抗腫瘤作用[J].中國中藥雜志,2005,30(8):603-606.
[11]宋·唐慎微.證類本草.四庫醫學叢書[M].上海:上海古籍出版社,1991:524-740.
[12]江蘇新醫學院.中藥大辭典·下冊[M].上海:上海人民出版社,1977:1898.

