摻銀納米二氧化鈦可見光催化降解酸性紅B
何立平 葉先增 付 川 李廷真 林俊杰
(重慶三峽學院化學與環境工程學院,重慶萬州 404100)
酸性紅B是偶氮染料,是常見的染料中間體,在染料工業中應用極為廣泛[1],易造成水體惡臭,富營養化,影響水生生物的正常生長[2].納米二氧化鈦具有獨特的光催化活性,已經成為水處理研究熱點,但納米TiO2光生電子與光生空穴易復合[3],且對可見光區利用率低.如何對納米二氧化鈦進行改性使其有效利用可見光成為該技術的關鍵.研究者用貴金屬銀,鉑[4,5],稀土金屬如鈰、釔、鑭、釩等[6,7]對二氧化鈦進行摻雜,有效地減少了光生空穴的復合,這些研究主要集中在其對紫外光的利用上,對可見光的利用率較低,利用氙燈模擬可見光的研究尚未見報道.本文利用傳統的溶膠凝膠法合成了納米二氧化鈦,以乙二胺配成銀氨溶液為前軀體進行摻雜合成了Ag-TiO2催化劑,實驗探討了銀的最佳摻雜量,對比了紫外光照和可見光照下催化劑的催化性能,著重探討了在氙燈模擬可見光照的情況下,摻銀納米二氧化鈦對酸性紅B染料催化降解的最佳工藝條件,為后續對催化劑的負載等研究奠定基礎.
1 實驗部分
1.1 試劑與儀器
試劑:鈦酸丁酯,硝酸銀,乙二胺,異丙醇,試劑均為分析純.
儀器:XD-3x射線衍射儀(北京普析通用儀器有限責任公司);IRPrestige-21型傅立葉變換紅外光譜儀(日本島津公司);TOC-Vcpn(日本島津公司);光化學反應儀(上海比郎儀器有限公司);UV-2450型紫外可見分光光度計(日本島津公司);雷磁pHS-3C pH計(上海精密科學儀器有限公司);101A-1E型電熱恒溫鼓風干燥箱(上海齊欣科學儀器公司);CL-2型恒溫加熱磁力加熱攪拌器(鞏義市予華儀器公司);FA / JA電子天平(上海越平科學儀器有限公司);800離心機(常州國華電器有限公司).
1.2 實驗方法
1.2.1 催化劑制備
催化劑為本實驗室自制,具體方法為:將鈦酸四丁酯按1∶5體積比緩慢溶解于異丙醇中,調節溶液pH = 3,攪拌1 h得溶液A,3∶2體積比將異丙醇溶解于蒸餾水中,攪拌30 min制得溶液B,磁力攪拌以0.1 mL/min流速將溶液B加入溶液A中,攪拌5 h,陳化10 h,干燥12 h,450 ℃煅燒5 h.
溶液A中加入一定量銀氨溶液,用上述方法可制得摻雜1%、2%、3%、4%、5%Ag-TiO2納米粉體.
1.2.2 光催化降解實驗
在100 mL玻璃反應器中加入一定量的自制催化劑,然后加入50 mL一定濃度的酸性紅B染料模擬廢水,用0.1 mol/L HC1和0.2 mol/L NaOH調節溶液pH至相應值,在汞燈、氙燈光照下磁力攪拌,反應一定時間后取樣,3600 r/min離心5 min,取上層清液于吸收波長515 nm處測定吸光度,儀器分析法測定 TOC.
1.3 分析方法
用紫外-可見分光光度計測定酸性紅 B染料模擬廢水的吸光度值,計算染料的脫色率(η1,%);TOC-Vcpn儀測定模擬廢水 TOC并計算礦化率(η2),計算公式見公式1-2:
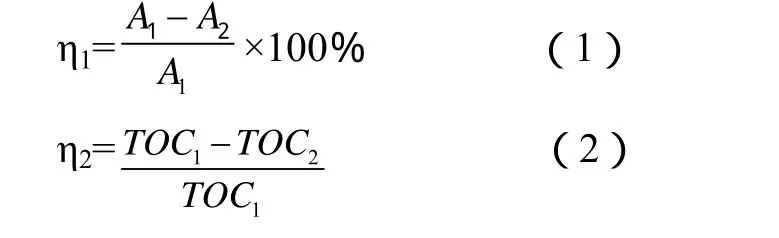
式中A1為反應前酸性紅B染料模擬廢水的吸光度,A2為反應后酸性紅 B染料模擬廢水的吸光度,TOC1為反應前模擬廢水的總有機碳含量,TOC2為反應后模擬廢水的總有機碳含量.
2 結果和討論
2.1 表征結果
2.1.1 XRD表征
催化劑的XRD表征圖見圖1,可知該方法合成的納米二氧化鈦含有銳鈦礦和金紅石兩種晶型,隨著銀的摻入,金紅石晶型的納米二氧化鈦先減少,后增加,銀摻量為 2%時全為銳鈦礦晶型,當銀摻量為 3%~5%時金紅石相的納米二氧化鈦含量又進一步升高.Scherrer公式計算TiO2和1%Ag-TiO2、2% Ag-TiO2、3% Ag-TiO2、4% Ag-TiO2、5% Ag-TiO2六個樣品的平均粒徑分別為:11 nm、10 nm、8 nm、7 nm、6 nm、5 nm,摻雜后催化劑的粒徑逐漸減小,說明摻雜不僅能有效抑制樣品粒徑的增長,在一定程度上還能抑制銳鈦礦晶型 TiO2向金紅石晶型的轉化.此外,由譜圖1還可以看出,摻銀后二氧化鈦衍射峰的位置沒有發生明顯變化,圖中亦未出現Ag元素的特征峰,Ag元素完全進入了TiO2的晶格中,均勻地分散在TiO2晶格中與之形成了固溶體[8].

圖1 催化劑的XRD譜圖Fig1 XRD pattems of catalysts
2.1.2 FT-IR表征
譜圖 2為納米二氧化鈦和 1%Ag-TiO2、2%Ag-TiO2、3%Ag-TiO2、4%Ag-TiO2、5%Ag-TiO2納米二氧化鈦的遠紅外光譜圖,圖中1 400 cm-1處為KBr背景峰.3 440 cm-1、1 630 cm-1處分別為表面吸附水 O-H的伸縮振動和彎曲振動峰[9-11],400-700cm-1出現的峰主要為Ti-O鍵的伸縮振動.隨著銀摻量的減少,Ti-O鍵伸縮振動峰漸銳化變窄,表明隨銀摻量的增加TiO2粒徑逐漸減少.
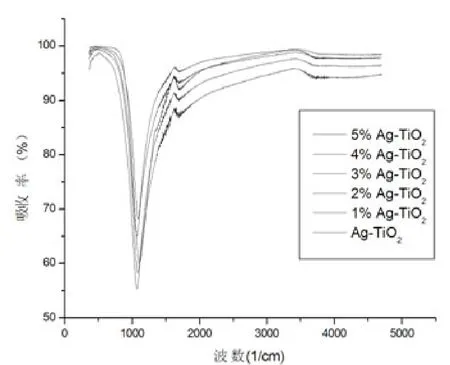
圖2 催化劑的紅外光譜圖Fig 2 IR Spectra of catalyst
2.2 紫外可見光催化降解模擬廢水對比
選取2%Ag-TiO2為催化劑,以汞燈模擬紫外光照,氙燈模擬可見光照,對比酸性紅B模擬廢水的脫色率,實驗結果見圖3,由圖3可知,摻雜銀后在紫外及可見光范圍內模擬廢水的脫色率均提高;30 min后脫色率分別為65%和30%,說明銀的摻入可提高催化劑的光催化活性;從圖中還可得知納米二氧化鈦在氙燈照射 30 min后模擬廢水脫色率為4.1%,而 2%Ag-TiO2催化劑在氙燈照射下 30 min后模擬廢水脫色率為 30.7%,說明銀的摻入使得催化劑的吸收波長紅移,提高了納米二氧化鈦對可見光的利用率.以下實驗選擇氙燈照射模擬可見光,探討摻銀納米二氧化鈦在可見光范圍內對酸性紅B染料模擬廢水的降解.
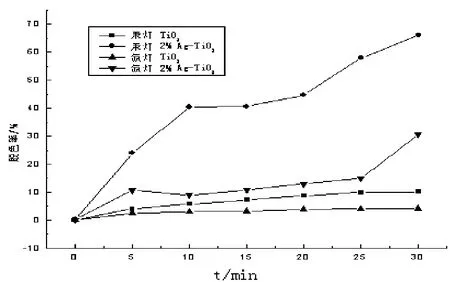
圖3 不同光源照射對脫色的影響Fig 3 The influence of different light source on the degradation rate of ARB wastewater

2.3 催化體系的選擇
500 W氙燈光照下,分別考察納米二氧化鈦和1%Ag-TiO2、2%Ag-TiO2、3%Ag-TiO2、4%Ag-TiO2、5%Ag-TiO2納米二氧化鈦對酸性紅B染料的催化降解,實驗結果如圖 4,結果表明,隨著銀摻量的增加,催化效果先增強后減弱,2%Ag-TiO2的催化效果最好.這與 XRD表征結果一致,由圖 1可知2%Ag-TiO2催化劑的晶型均為銳鈦礦,銳鈦礦具有較好的光催化性能.隨著銀摻入量繼續增加3%Ag-TiO2、4%Ag-TiO2、5%Ag-TiO2納米二氧化鈦催化性能逐漸下降,這可能是因為金紅石晶型的出現降低了催化劑對可見光的利用率,且可能形成電子空穴的復合中心[12],因此實驗選取銀摻雜量為2%.
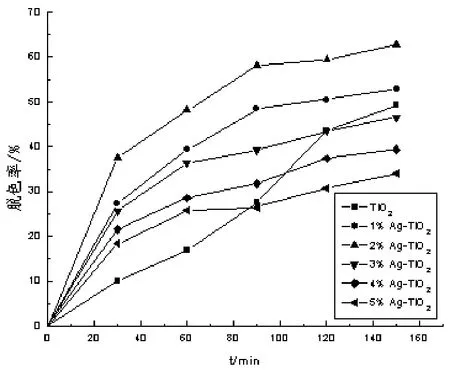
圖4 銀摻入量對脫色效果的影響
2.4 模擬廢水濃度對脫色效果的影響
模擬廢水濃度對脫色率、礦化率的影響如圖 5所示,當模擬廢水濃度為50 mg/L時兩指標值最大,分別為60%和35%,其原因在于隨著酸性紅B濃度的加大,酸性紅B分子和光生OH·自由基的接觸反應碰撞幾率增加,反應速率會隨之迅速升高.然而,可見光催化產生的OH·自由基濃度是一定的,當酸性紅B分子濃度超過體系中光生OH·能氧化的最大濃度時,反應速率將迅速下降.
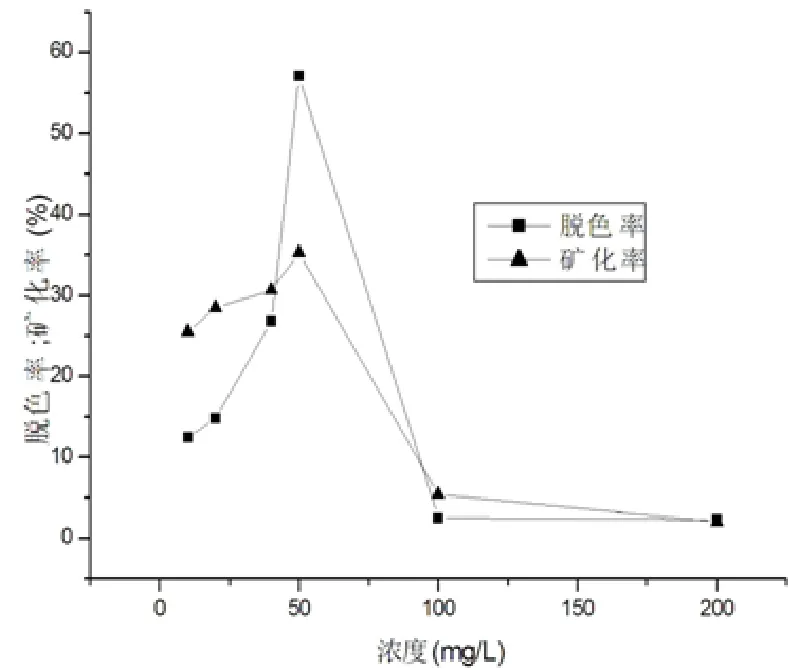
圖5 酸性紅B染料模擬廢水濃度對脫色率和礦化率的影響Fig 5 The influence of ARB concentration on the degradation and Mineralization rate of simulated wastewater
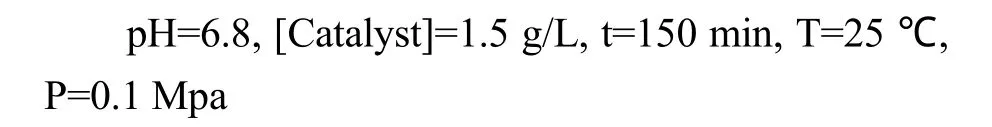
2.5 催化劑用量對脫色效果的影響
500 W氙燈光照下考察了催化劑用量對脫色率和礦化率的影響,實驗數據如圖6所示.由圖6可知,模擬廢水脫色率和礦化率隨著催化劑用量的增加先升高后降低,在催化劑用量為1.5 g/L時達到最大值,分別為55%和32%.出現這種現象的原因可能是一定體系中產生的光生 OH·的量是一定的,進一步加大催化劑的投加量反而會增加光散射效應,同時增大催化劑表面反催化作用的可能性,使得OH·在催化劑表面發生猝滅反應.
2.6 模擬廢水pH值對脫色效果的影響
實驗考察了不同初始模擬廢水pH值對脫色率和礦化率的影響,如圖7所示,pH值在1~14范圍內脫色率變化趨勢是先升高后降低,總體上是酸性環境脫色率大于堿性環境.當pH = 4時,催化劑對酸性紅 B染料模擬廢水的脫色率和礦化率效果最好,分別為90%和60%.在酸性的介質中,溶液中存在的氫離子對催化反應具有酸催化作用,而在堿性介質中,氫氧根離子的存在將減少催化劑吸附酸性紅B染料的量,從而阻礙酸性紅B降解[13].
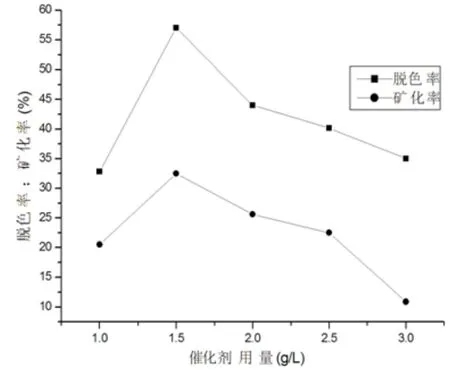
圖6 2% Ag-TiO2 催化劑用量對模擬廢水對脫色率和礦化率的影響Fig 6 The influence of 2% Ag-TiO2 concentration on the degradation and Mineralization rate of simulated wastewater[ARB]=50mg/L,pH=6.8, t=120min, T=25℃, P=0.1Mpa
圖7 pH值對酸性紅B染料模擬廢水的對脫色率和礦化率的影響Fig 7 The influence of pH value on the degradation and Mineralization rate of simulated wastewater[ARB]=50mg/L ,[Catalyst]=1.5g/L,t=150min,T=25℃ ,P=0.1Mpa
3 結 論
(1)溶膠凝膠法合成了載銀納米二氧化鈦,XRD及FT-IR表征顯示銀已進入催化劑晶胞,實驗表明2%Ag-TiO2為銳鈦礦晶型,可見光利用率較高.
(2)常溫常壓,500 W氙燈光照,2%Ag-TiO2加入量為1.5 g/L,pH = 4,反應時間為150 min,反應溫度為25 ℃的條件下,處理質量濃度為50 mg/L的酸性紅B模擬廢水的脫色率達90%,礦化率達60%.
[1]張隆,王競,周集體,等.酸性偶氮染料還原產物強化偶氮染料生物脫色[J].中國環境科學,2008,28(3):237-241.
[2]林治順,潘湛昌,彭康華,等.負載型 TiO2光電催化降解酸性紅B[J].工業水處理,2008,3(28):23-26.
[3]Xie Y., Kum J.M., Zhao X.J.,et al. Enhanced photocatalytic activity of mesoporous S-N-codoped TiO2loaded with Ag nanoparticles .Semiconductor Science and Technology ,2011,8(26):188-194.
[4]Chang C.C, Chen J.Y., Hsu T.L.Photocatalytic properties of porous TiO2/Ag thin films. Thin Solid Films,2008,8(516):1743-1747.
[5]Ding Y., Wang Y., Zhang L.C., et al.Preparation of TiO2–Pt hybrid nanofibers and their application for sensitive hydrazine detection .Nanoscale, 2011,3(25), 1149-1157.
[6]Amelie R., Geraldine D., Dominique D.,et al.Synthesis of YAG:Ce/TiO2nanocomposite films .Optical Materials,2011, 7(33):1124-1127.
[7]Liu W., Han R., Wang H.T.,et al.Photoassisted degradation of pentachlorophenol in a simulated soil washing system containing nonionic surfactant Triton X-100 with La–B codoped TiO2under visible and solar light irradiation . Applied Catalysis B: Environmental,2011,4(103):47-78.
[8]劉秀華.金屬離子摻雜二氧化鈦光催化劑的改性研究[D].綿陽:中國工程物理研究院,2007.
[9]Liu G., Chen Z.G., Dong C.L., et al .Visiblelight phot ocatalyst : I odine doped mes oporous titania with a bicrystalline framework . J Phys Chem B, 2006, 110(42) : 20823- 20828.
[10]張健,矯慶澤,張宗儉.摻硼納米 TiO2對農藥毒死蜱的光催化降解作用[J].化學研究,2006,17(3):32-35.
[11]Ding Z, Lu G.Q., Greenfield P. F. Role of the crystallite phase of TiO2in heter ogeneous phot ocatalysis for phenol oxidati on in water . J Phys Chem B, 2000, 10(104): 4815-4820 .
[12]劉守新,曲振平,韓秀文,等.Ag擔載對 TiO2光催化活性的影響[J].催化學報,2004,25(2):133-137.
[13]祁巧艷,孫劍輝.負載型納米 TiO2光催化降解羅丹明B動力學與機理研究[J].水資源保護,2006,22(2):56-58.

