橘皮中檸檬苦素類物質的提取研究
楊 艷,潘雪雪,羅愛民,金 晶,吳海燕
(湖北民族學院化學與環境工程學院,湖北 恩施445000)
橘子營養價值很高,橘皮中富含香精油、色素、檸檬苦素、果膠等天然物質[1],但大部分未充分利用就被丟棄,既浪費資源,又污染環境。檸檬苦素類物質是一類高度氧化的四環三萜類次生代謝產物,主要存在于蕓香科和楝科植物組織中[2]。20世紀60年代,Arigoni等[3]用化學和X-衍射的方法對檸檬苦素的結構進行了研究,1989年,Hasegawa等[4]首次發現了檸檬苦素類似物甙。近年來的研究表明,檸檬苦素類物質具有消炎鎮痛、抗氧化性、抗腫瘤、抗焦慮等獨特的生物活性[5-8]。
作者采用高效液相色譜法對檸檬苦素類物質含量進行測定,通過單因素實驗考察了不同操作因素對低溫微波輻射輔助提取橘皮中檸檬苦素類物質的影響,擬為開發利用廢棄的橘皮自然資源提供參考。
1 實驗
1.1 材料、試劑與儀器
橘皮購于恩施農貿市場。
檸檬苦素標準品(含量≥98%),上海金穗生物科技有限公司;溴化鉀(光譜純),乙腈(色譜級),無水乙醇、乙酸乙酯、丙酮、石油醚、冰醋酸、98%硫酸均為分析純,上海國藥集團;水為超純水。
1260Infinity Series型高效液相色譜儀,Agilent;AVATAR 370FTIR型光譜儀,Thermo Nicolet;DF-101S型集熱式恒溫加熱磁力攪拌器,上海羌強儀器設備有限公司;KQ2200B型超聲波清洗器,昆山市超聲儀器有限公司;FA1004B型電子天平,上海佑科儀器有限公司;SHZ-D(Ⅲ)型循環水式真空泵,上海英化設備有限公司;800型離心機,上海云樓醫用儀器廠;RE-52A型旋轉蒸發儀,上海亞榮生化儀器廠;家用微波爐;NEXUS470型傅立葉紅外光譜儀;YB-2型壓片機,上海齊益電子儀器有限公司。
1.2 方法
預處理:將新鮮橘皮剪成大小基本一致(1mm2)的碎片,放到50℃恒溫烘箱中烘干至水分<5%;在裝有適量石油醚的棕色瓶中浸泡8h,脫去橘皮中的油脂,過濾,自然風干;輔助處理:微波300W 輻射1 min;溶劑提取:具體提取流程如圖1所示。
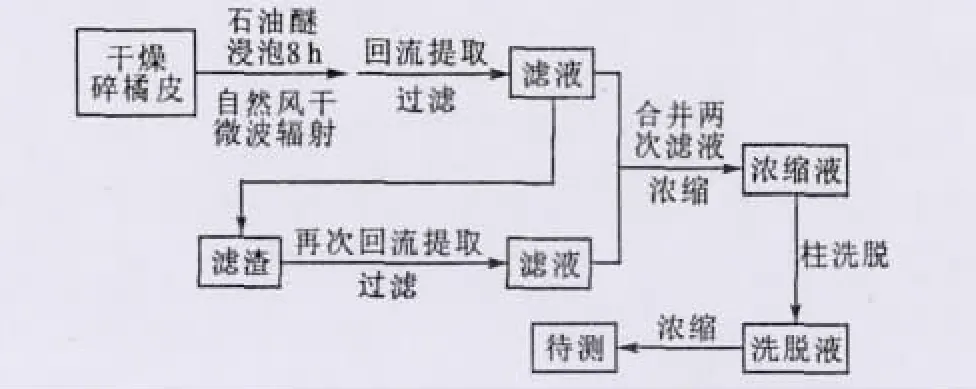
圖1 橘皮中檸檬苦素類物質提取流程Fig.1 Extraction process of limonoids from citrus peel
設計單因素實驗考察溶劑種類及其濃度、pH值、提取溫度、提取時間、料液比(g∶mL,下同)對檸檬苦素類物質提取效果的影響。
1.3 分析檢測
(1)HPLC色譜條件:Edipse plus C18色譜柱(4.6 mm×10mm,3.5μm);流動相:乙腈-水(45∶55,體積比),流速:0.8mL·min-1;檢測器:DAD紫外檢測器;波長:210nm;檢測溫度:室溫;進樣量:10μL。檢測之前通過掃描檸檬苦素類物質在190~400nm的紫外吸收,確定其最佳吸收波長為210nm。
(2)檸檬苦素類物質提取量測定:采用外標法,按下式計算:
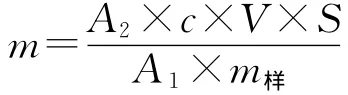
式中:m為檸檬苦素類物質提取量,mg·g-1;A1為標準品色譜峰面積;A2為樣品色譜峰面積;c為標準溶液質量濃度,mg·mL-1;V 為樣品溶液體積,mL;S為樣品稀釋倍數;m樣為樣品質量,g。
2 結果與討論
2.1 標準曲線的繪制
準確稱量14.40mg檸檬苦素標準品(純度≥98%)于小燒杯中,用流動相溶解,定容到25mL的容量瓶中,配成質量濃度為0.576mg·mL-1的檸檬苦素溶液。分別取0mL、0.2mL、0.4mL、0.6mL、0.8 mL、1.0mL上述檸檬苦素溶液置于10mL的容量瓶中,配成質量濃度(μg·mL-1)為0、11.52、23.04、34.56、46.08、57.60的標準溶液。以質量濃度(c)為橫坐標、色譜峰面積(A)為縱坐標繪制標準曲線,如圖2所示。
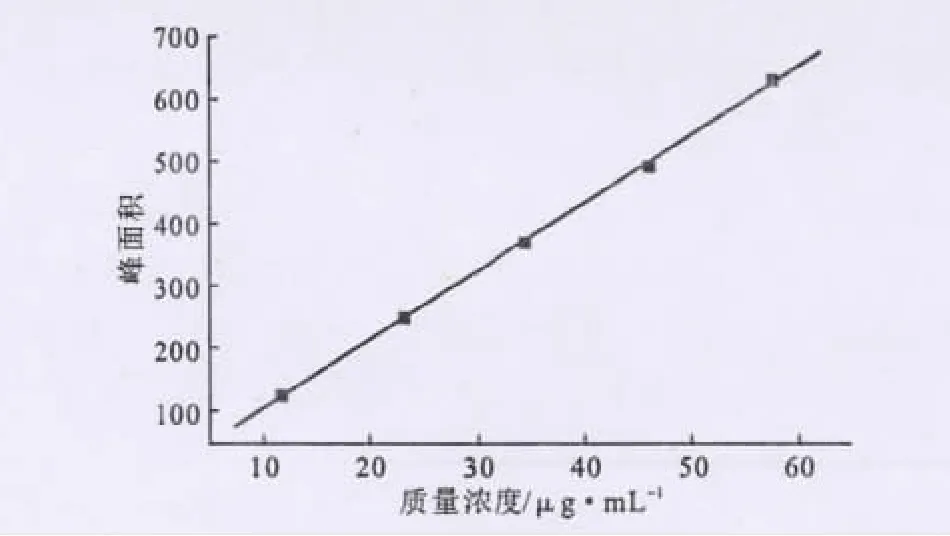
圖2 檸檬苦素標準曲線Fig.2 The standard curve of limonin
由圖2可知,檸檬苦素質量濃度在11.52~57.60 μg·mL-1范圍內與色譜峰面積呈良好的線性關系。標準曲線擬合線性回歸方程為:A=10.9308016c-2.901838(R2=0.99969)。
2.2 HPLC分析
將提取液樣品處理后進行HPLC檢測,樣品與標準品的HPLC圖譜如圖3所示。
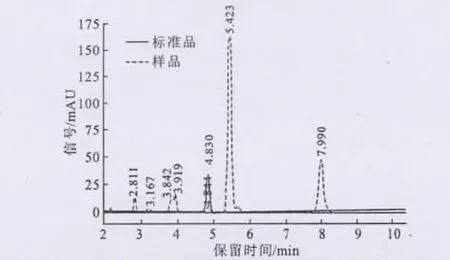
圖3 檸檬苦素標準品和檸檬苦素類物質樣品的HPLC圖譜Fig.3 The HPLC chromatograms of limonin standard and limonoids sample
2.3 單因素實驗結果與分析
2.3.1 溶劑對提取效果的影響
準確稱取3.00g預處理后橘皮,選擇無水乙醇、乙酸乙酯、水、丙酮、二氯甲烷為提取溶劑,考察不同溶劑對檸檬苦素類物質提取的影響,結果如圖4所示。
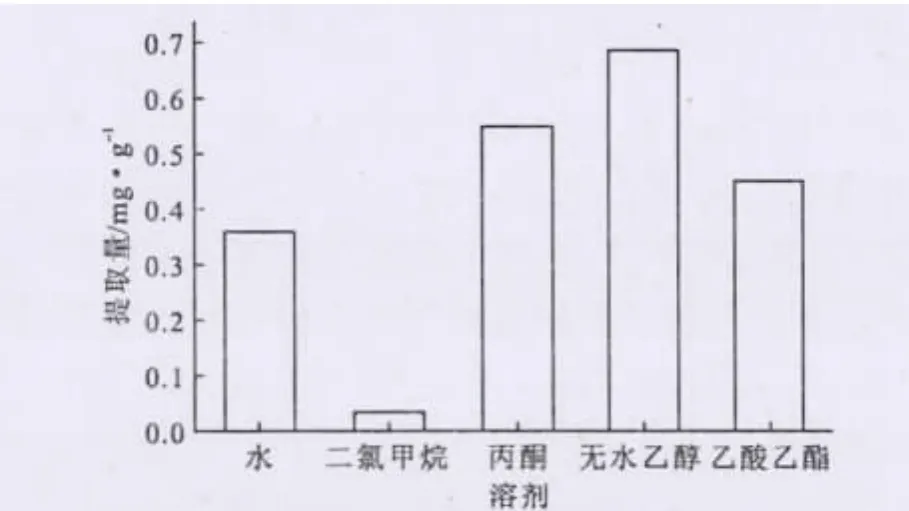
圖4 溶劑對檸檬苦素類物質提取的影響Fig.4 The effect of solvent on extraction of limonoids
從圖4可以看出,無水乙醇提取效果最好,二氯甲烷效果最差,無水乙醇提取的檸檬苦素類物質是二氯甲烷提取的19.94倍。這是因為,二氯甲烷沸點太低,長時間回流過程中大量揮發,致使檸檬苦素類物質提取效果差。考慮到乙醇無毒、成本低、易回收利用,選擇乙醇作為提取溶劑。
2.3.2 乙醇體積分數對提取效果的影響
分別以體積分數為30%、50%、70%、80%的乙醇和無水乙醇作為提取劑,考察乙醇體積分數對檸檬苦素類物質提取的影響,結果如圖5所示。
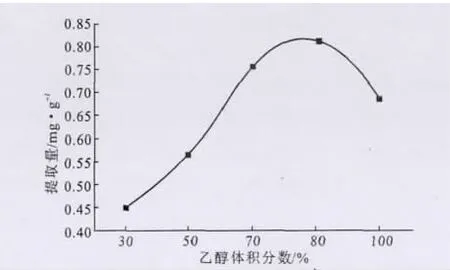
圖5 乙醇體積分數對檸檬苦素類物質提取的影響Fig.5 The effect of ethanol volume fraction on extraction of limonoids
從圖5可以看出,隨著乙醇體積分數的增大,檸檬苦素類物質的提取量顯著增加,當乙醇體積分數為80%時提取效果最好;之后提取量明顯減少,無水乙醇提取效果較差。這可能是因為,乙醇的體積分數過大時其極性也大,不利于弱極性、非極性類型的檸檬苦素類化合物的提取,致使提取量反而減少。因此,選擇80%乙醇作為提取溶劑。
2.3.3 pH值對提取效果的影響
以80%乙醇作為提取劑,用冰醋酸和NaOH溶液調節提取體系的pH值,考察pH值對檸檬苦素類物質提取的影響,結果如圖6所示。

圖6 pH值對檸檬苦素類物質提取的影響Fig.6 The effect of pH value on extraction of limonoids
從圖6可以看出,在酸性范圍內,隨著pH值逐漸增大,檸檬苦素類物質提取量不斷增加;當pH值為5時提取量達到最大;當提取體系呈堿性時,檸檬苦素類物質提取量顯著減少,pH值為10時的提取量僅為0.309mg·g-1。這可能是因為,強酸性條件下檸檬苦素類物質中的羰基和呋喃環不穩定,強堿性條件下羰基又容易發生開環反應,導致檸檬苦素類物質生成相應的苷元和葡萄糖[9],而檸檬苦素類物質在pH值為5~7時相對穩定,提取效果較好。因此,選擇適宜的pH值為5。
2.3.4 提取溫度對提取效果的影響(圖7)

圖7 提取溫度對檸檬苦素類物質提取的影響Fig.7 The effect of extraction temperature on extraction of limonoids
從圖7可以看出,隨著提取溫度的升高,檸檬苦素類物質的提取量先增后減,在50℃時達到最大,為0.703mg·g-1。這可能是因為,升高溫度可以加快植物有效成分的提取速率,增強提取效果,但溫度過高會使檸檬苦素類物質熱分解[10]轉化成苷糖類物質,甚至喪失生物活性。因此,選擇適宜的提取溫度為50℃。
2.3.5 提取時間對提取效果的影響(圖8)
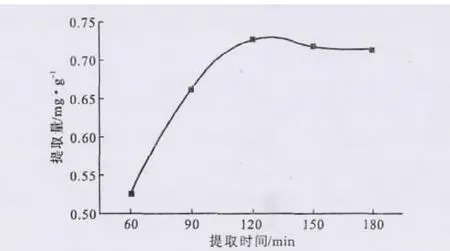
圖8 提取時間對檸檬苦素類物質提取的影響Fig.8 The effect of extraction time on extraction of limonoids
從圖8可以看出,提取初期檸檬苦素類物質提取量隨著提取時間的延長顯著增加,在提取120min時最大,達0.734mg·g-1;隨著提取時間進一步延長,提取量反而有所減少。這可能是因為,在適宜的溫度下,延長提取時間有利于檸檬苦素類物質從橘皮組織細胞中擴散出來[11];但提取時間過長時,副反應增多,反而導致提取量減少。因此,選擇適宜的提取時間為120min。
2.3.6 料液比對提取效果的影響(圖9)
從圖9可以看出,隨著料液比的減小即溶劑用量的增大,檸檬苦素類物質提取量顯著增加;當料液比為1∶12時,檸檬苦素類物質提取量為0.693mg·g-1;進一步增加溶劑用量,檸檬苦素類物質提取量趨于平穩。理論上溶劑用量越大,檸檬苦素類物質提取越徹底,但溶劑用量過大不僅對提取液濃縮處理帶來麻煩,也不經濟。因此,選擇適宜的料液比為1∶12。
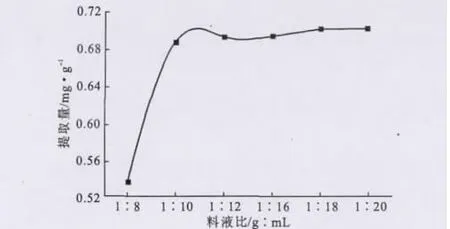
圖9 料液比對檸檬苦素類物質提取的影響ig.9 The effect of solid-liquid ratio on extraction of limonoids
2.3.7 驗證實驗結果
在單因素實驗確定的優化條件下,即以80%乙醇為溶劑、pH值為5、提取時間為120min、提取溫度為50℃、料液比為1∶12,進行3次平行實驗,檸檬苦素類物質的平均提取量為0.856mg·g-1,表明所確定優化條件可靠。
2.4 紅外光譜檢測
將提取液樣品經減壓蒸餾、離心分離等純化處理后得到白色晶體粉末,用KBr粉末壓片進行紅外光譜檢測,結果如圖10所示。
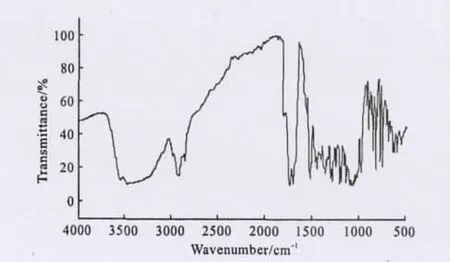
圖10 提取物樣品的紅外光譜Fig.10 The FTIR spectrum of the extract sample
從 圖 10 可 以 看 出,2919cm-1、1050cm-1、892cm-1處為β-取代呋喃環的特征吸收峰;2852cm-1處為甲基的C-H伸縮振動吸收峰;1744cm-1處為δ-內酯環的C=O伸縮振動吸收峰;1699cm-1處為六元酮C=O伸縮振動吸收峰;1357cm-1處為酮碳二甲基吸收峰;1279cm-1、1099cm-1處為環醚C-O-C吸收峰;1208cm-1、1129cm-1處為季碳二甲基吸收峰。將圖譜信息與檸檬苦素紅外標準圖譜進行對比,結構特征相符,表明提取物確為檸檬苦素類物質。
2.5 討論
實驗對比了回流和索氏提取及提取次數的影響。結果表明:雖然索氏提取效果略好,但溶劑消耗量大,后處理繁瑣;回流次數過多,易使檸檬苦素類物質分解轉化,提取量減少,以回流2次為宜。故確定以回流法提取橘皮中檸檬苦素類物質,回流2次。
3 結論
(1)應用高效液相色譜法檢測橘皮中檸檬苦素類物質含量,檸檬苦素質量濃度在11.52~57.60μg·mL-1范圍內與色譜峰面積呈良好的線性關系。擬合線性回歸方程為A=10.9308016c-2.901838(R2=0.99969)。
(2)單因素實驗確定低溫微波輻射輔助提取橘皮中檸檬苦素類物質的優化提取條件如下:以80%乙醇為提取溶劑、pH值為5、提取溫度為50℃、提取時間為120min、料液比為1∶12(g∶mL),在此條件下回流提取2次,提取量為0.856mg·g-1。
(3)得到的檸檬苦素類物質結構經紅外光譜檢測確認。
[1]張珉,鐘曉紅.柑橘功能性成分研究進展[N].中國農學通報,2009,25(11):137-140.
[2]劉君.柑橘種子中類檸檬苦素提取純化工藝研究[D].重慶:西南大學,2008.
[3]Arigoni D,Barton D,Corey E J,et al.The constitution of limonin[J].Cell Mol Lief,1960,16(2):41-49.
[4]Hasegawa S,Bennett R D.Limonoid glucosides in citrus[J].Phytochemistry,1989,28(6):1717-1720.
[5]李赤翎,俞建,蔣雪薇,等.檸檬苦素類似物糖苷的抗菌與抗氧化作用研究[J].食品科學,2008,33(5):154-156.
[6]Poulose S M,Harris E D.Citrus limonoids induce apoptosis in human neuroblastoma cells and have radical scavenging activity[J].Nutrition,2005,135(4):870-877.
[7]鄒連生.柑橘類檸檬苦素的提取、純化和體外抗腫瘤的研究[D].重慶:西南農業大學,2001.
[8]Wada K,Yagi M,Kurihara T,et al.Studies on the constituents of edible and medicinal plants.Ⅲ.Effects of seven limonoids on the sleeping time induced in mice by anesthetics[J].Chem Pharm Bull,1992,40(11):3079-3080.
[9]劉亮,戚向陽,董緒燕.柑橘中檸檬苦素類似物的研究新進展[J].農產品加工·學刊,2007,(7):37-41.
[10]Jitpukdeebodintra S,Chantachum S,Ratanaphan A.Stability of limonin from lime seeds[J].Environ Agric Food Chem,2005,4(3):30.
[11]蔣俊平,袁芳,吳兵,等.檸檬苦素類物質的研究進展綜述[J].中國釀造,2012,31(7):10-14.

