CH3SH與CN自由基反應(yīng)的理論研究
馬詠梅,王艷麗
(1.渭南師范學(xué)院化學(xué)與生命科學(xué)學(xué)院,陜西 渭南714000;2.西北工業(yè)大學(xué)理學(xué)院,陜西 西安710129)
含硫化合物對大氣環(huán)境和生物生存有著很重要的影響,如酸雨的形成、能見度降低及全球氣候變化等[1]。甲硫醇(CH3SH)是一種簡單的有機硫化物,其含量約占大氣中有機硫化物的10%。CH3SH與活潑自由基和小分子的反應(yīng)已有許多實驗和理論研究報道[2-8]。
CN是一種重要的自由基,具有介于F和Cl之間的較強電負(fù)性和強的三鍵(749.4kJ·mol-1)[9],在燃燒過程和大氣化學(xué)中起著主要的作用。Briank等[8]研究了CH3SH與CN自由基的反應(yīng),測得293K時該反應(yīng)的速率常數(shù)為(2.7±0.3)×10-10cm3·mol-1·s-1。邊 江 魚[10]用 B3LYP/6-311G(d,p)方 法 對CH3SH與CN自由基反應(yīng)機理進行了理論研究。許保恩等[11]用B3LYP/6-311++G(d,p)方法找到了3條反應(yīng)通道。但邊江魚和許保恩等均未計算CH3SH與CN自由基反應(yīng)的速率常數(shù),因此,有必要采用較高級別的方法對此反應(yīng)進行研究。
作者在此采用雙水平計算方法G3MP2//MP2/6-311G(d,p)研究了CH3SH與CN自由基反應(yīng)的機理,計算了各反應(yīng)通道在不同溫度下的速率常數(shù)以及總反應(yīng)速率常數(shù),并與實驗結(jié)果進行比較,擬為該反應(yīng)的進一步實驗研究提供理論數(shù)據(jù)。
1 計算方法
在 MP2/6-311G(d,p)水平上,全參數(shù)優(yōu)化了CH3SH與CN自由基反應(yīng)路徑上各駐點(反應(yīng)物、產(chǎn)物、絡(luò)合物和過渡態(tài))的幾何構(gòu)型,并通過振動頻率分析確認(rèn)。在相同水平上進行內(nèi)稟反應(yīng)坐標(biāo)(IRC)計算,證實了反應(yīng)物、過渡態(tài)和產(chǎn)物的相關(guān)性。為了得到可靠的勢能面信息,采用高級別方法G3MP2對在MP2/6-311G(d,p)水平上獲得的所有駐點進行單點能量計算。經(jīng)過 MP2/6-311G(d,p)水平上零點能(ZPE)校正獲得反應(yīng)勢能剖面。所有計算采用Gaussian09程序包[12]完成。利用Zhang等[13]提供的動力學(xué)計算程序 VKLab(Virtual kinetic laboratory)分別計算了200~1000K溫度區(qū)間內(nèi)各分支反應(yīng)的速率常數(shù)和總反應(yīng)速率常數(shù)。
2 結(jié)果與討論
在 MP2/6-311G(d,p)水平上優(yōu)化的反應(yīng)通道的反應(yīng)物(R)、產(chǎn)物(P)、前期絡(luò)合物(CR)、后期絡(luò)合物(CP)、過渡態(tài)(TS)的幾何構(gòu)型和部分實驗值[14]見圖1。
從圖1可以看出,優(yōu)化值與實驗值基本一致,說明所選方法是可靠的。
各駐點物種的振動頻率及零點能(ZPE)見表1。頻率分析發(fā)現(xiàn),所有的反應(yīng)物、中間體和產(chǎn)物的振動頻率皆為實頻,是反應(yīng)勢能面上的穩(wěn)定點;每個過渡態(tài)有且僅有一個虛頻,是各反應(yīng)勢能面上的一階鞍點,并通過IRC計算使每個過渡態(tài)連接到了相應(yīng)的反應(yīng)物、產(chǎn)物和中間體。
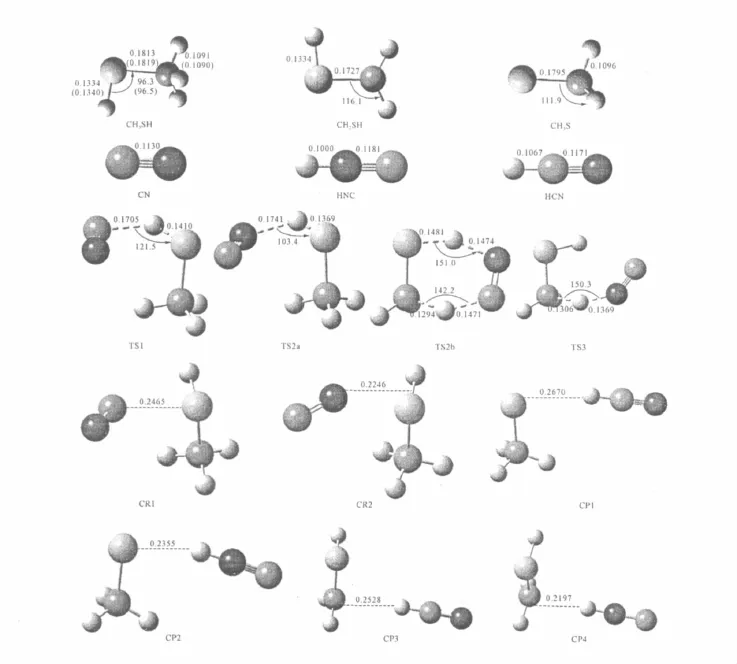
圖1 各駐點的構(gòu)型參數(shù)(括號中為實驗值,鍵長,nm)Fig.1 Geometric parameters of the stationary points(the experimental datum in the bracket)
2.1 反應(yīng)機理
由于CN自由基中C、N的電負(fù)性相近,所以C和N可分別抽取CH3SH中-SH基團和-CH3基團上的H。當(dāng)CN自由基的C和N原子分別靠近CH3SH的-SH基團時,首先生成前期絡(luò)合物CR1和CR2,其弱相互作用的C…S和N…S鍵長分別為0.324nm和0.225nm。繼續(xù)靠近時,越過過渡態(tài)TS1和TS2a,生成后期絡(luò)合物CP1和CP2。在TS1和TS2a中,即將斷裂的S-H鍵長相比反應(yīng)物的平衡鍵長分別增長了6%和3%,即將生成的C-H和N-H鍵比HCN和HNC中的平衡鍵長分別增長了60%和74%。因此,TS1和TS2a是類反應(yīng)物構(gòu)型,反應(yīng)通道分別經(jīng)歷一個早期能壘。最后CP1分解為產(chǎn)物CH3S+HCN,即為反應(yīng)通道Ⅰ。CP2分解為CH3S+HNC,即為通道Ⅱa。接著CH3S與HNC繼續(xù)反應(yīng),形成過渡態(tài)TS2b,經(jīng)TS2b的振動模式分析和IRC計算,可知與TS2b對應(yīng)的反應(yīng)物確是CH3S和HNC。在TS2b形成過程中,HNC中的H-N鍵逐漸伸長,同時H原子向CH3S中的S原子靠近,而CH3S中的C-H鍵逐漸伸長且C-H中的H原子不斷向HNC中的C原子靠近,生成后期絡(luò)合物CP3,最后CP3分解為產(chǎn)物CH2SH+HCN,即為反應(yīng)通道Ⅱb。
當(dāng)CN自由基抽取CH3SH中-CH3基團上的H時,沒有找到C原子而直接抽取-CH3基團上H為反應(yīng)通道的過渡態(tài)。由于反應(yīng)物CH3SH具有Cs對稱性,因此應(yīng)存在兩條抽H反應(yīng)通道,分別為平面內(nèi)和平面外H提取通道。但是N原子抽取-CH3基團上的H時,只找到了一個和平面外H提取一樣的過渡態(tài),即TS3。實際計算中發(fā)現(xiàn)這是因為在優(yōu)化平面內(nèi)的H提取反應(yīng)過渡態(tài)的形成過程中,發(fā)生了-CH3基團以C-S鍵為軸的旋轉(zhuǎn)。在TS3形成過程中,CH3SH中的C-H鍵逐漸伸長直至斷裂,N-H鍵逐漸縮短,生成后期絡(luò)合物CP4,最后CP4分解為產(chǎn)物CH2 SH+HNC,即為反應(yīng)通道Ⅲ。

表1各駐點物種的振動頻率和零點能Tab.1 The vibrational frequency and zero point energy of the stationary points
2.2 反應(yīng)勢能面
G3MP2//MP2/6-311G(d,p)水 平 下 反 應(yīng) 通 道(Ⅰ)~(Ⅲ)的反應(yīng)焓吉布斯自由能觀活化能(Ea=ETS-ER)、速率決定步能壘(△V0≠K=ETS-ECR)、反應(yīng)能(△Er,0K=EPER)以及部分實驗值見表2。
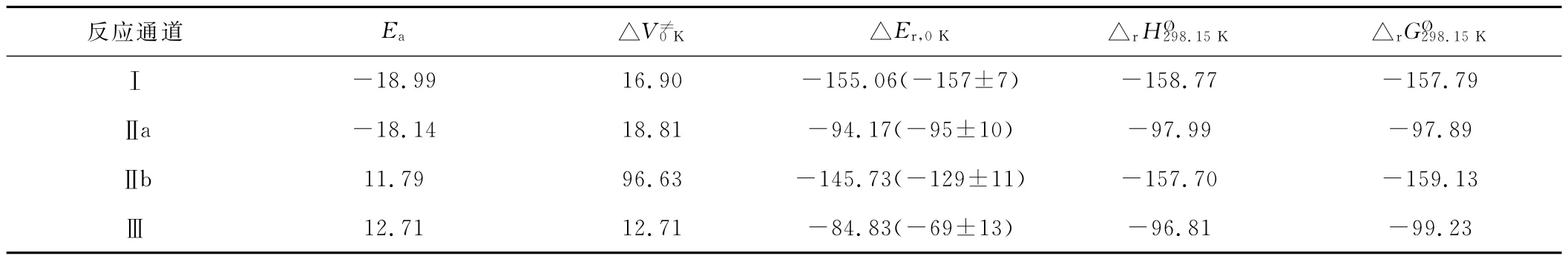
表2 G3MP2//MP2/6-311G(d,p)水平下的各種能量/kJ·mol-1Tab.2 Energies at the G3MP2//MP2/6-311G(d,p)level/kJ·mol-1
由表2可知,從熱力學(xué)上看,反應(yīng)為自發(fā)放熱過程,具有負(fù)的吉布斯自由能,說明低溫有利于該反應(yīng)的進行。各反應(yīng)路徑的反應(yīng)熱與文獻實驗值相接近。
在G3MP2//MP2/6-311G(d,p)水平上建立的反應(yīng)勢能面見圖2。
由圖2可知,通道Ⅰ的活化能(-18.99kJ·mol-1)最低,需克服的反應(yīng)能壘(16.90kJ·mol-1)較低且放熱(-155.06kJ·mol-1)最多,應(yīng)是該反應(yīng)體系的主反應(yīng)通道,CH3S和HCN是主要反應(yīng)產(chǎn)物。通道Ⅱa的反應(yīng)能壘(18.81kJ·mol-1)也較低且放熱明顯,說明產(chǎn)物CH3S和HNC較易生成,通道Ⅱb的反應(yīng)能壘(96.63kJ·mol-1)很高,估計產(chǎn)物 CH2SH+HCN在整個反應(yīng)體系中所占比例相對很少。通道Ⅲ的活化能較高,且放熱(-84.83kJ·mol-1)最少,因而對總反應(yīng)的貢獻不是很大。
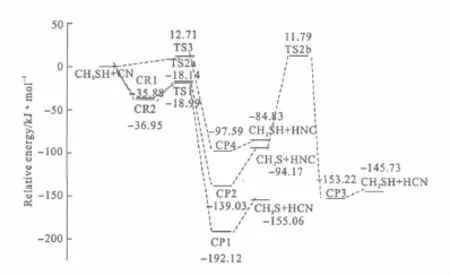
圖2 CH3SH+CN在G3MP2∥MP2/6-311G(d,p)水平上的勢能面Fig.2 Potential energy profile for the reaction of CH3SH with CN at the G3MP2∥MP2/6-311G(d,p)level
2.3 反應(yīng)速率常數(shù)
由于G3(MP2)具有很好的計算精度且省時,在G3(MP2)//MP2/6-311G(d,p)水平上,對反應(yīng)進行了動力學(xué)計算。利用RRKM理論計算了各反應(yīng)通道在200~1000K溫度范圍內(nèi)的速率常數(shù)。總反應(yīng)的速率常數(shù)為各反應(yīng)路徑速率常數(shù)的加和,即k=kⅠ+kⅡ+kⅢ。各分支反應(yīng)的速率常數(shù)、總反應(yīng)速率常數(shù)以及相應(yīng)的實驗值見表3。

表3 各分支速率常數(shù)、總反應(yīng)速率常數(shù)及實驗值/cm3·mol-1·s-1Tab.3 The calculated rate constant of each channel,total rate constants and the available experimental values/cm3·mol-1·s-1
由表3可知,在293K時,計算的總反應(yīng)速率常數(shù)值4.70×10-10cm3·mol-1·s-1與實驗值[8](2.7±0.3)×10-10cm3·mol-1·s-1符合較好;kⅠ、kⅡa的速率常數(shù)隨溫度的升高而降低,這與反應(yīng)活化能為負(fù)值有關(guān),通道Ⅰ是主反應(yīng)通道。kⅡb相對于kⅡa很小,所以通道Ⅱ的主要產(chǎn)物為CH3S+HNC。在所研究的溫度范圍內(nèi),kⅢ對總反應(yīng)速率的貢獻不大,可以忽略。表明CN自由基主要抽取-SH基團上的H,且CH3S+HCN是主要反應(yīng)產(chǎn)物,這與文獻[8]報道相符。
3 結(jié)論
在 MP2/6-311G(d,p)水平上全參數(shù)優(yōu)化了反應(yīng)各駐點的幾何構(gòu)型,在 G3MP2//MP2/6-311G(d,p)水平上構(gòu)建了CH3SH與CN自由基反應(yīng)的勢能面,并用RRKM理論計算了在200~1000K溫度范圍內(nèi)的反應(yīng)速率常數(shù),與實驗值基本吻合。結(jié)果表明:CN自由基主要抽取-SH基團上的H,且CN中的C抽取-SH上的H是主反應(yīng)通道,CH3S和HCN是主要反應(yīng)產(chǎn)物。
[1]Tyndall G S,Ravishankara A R.Atmospheric oxidation of reduced sulfur specie[J].Int J Chem Kinet,1991,23(6):483-527.
[2]Tevaultd E,Mowery R L,Smardzewsk R R.Ozone and oxygen atom reactions with dimethylsulfide and methanethiol in argon matrices[J].J Chem Phys,1981,74(8):4480-4487.
[3]Chang Y T,Loes G H.The reaction of atomic oxygen with methanethiol.A theoretical study of the structures and the potential energy surface[J].Chem Phys Lett,1993,205(6):543-549.
[4]Nicovich J M,Kreutter K D,Van Dijk C A.Temperature-dependent kinetics studies of the reactions bromine atom(2P3/2)+ hydrogen sulfide.tautm.mercapto + hydrogen bromide and bromine atom(2P3/2)+ methanethiol.tautm.methylthiol+ hydrogen bromide.Heats of formation of mercapto and methylthio radicals[J].J Phys Chem,1992,96(6):2518-2528.
[5]Butkovskaya N I,Setser D W.Chemical dynamics of the OH and OD radical reactions with H2S,CH3SCH3,and CH3SH studied by infrared chemiluminescence[J].J Phys Chem A,1998,102(32):6395-6405.
[6]Martínez E,Albaladejo J,Jiménez E,et al.Kinetics of the reaction of CH3S with NO2as a function of temperature[J].Chem Phys Lett,1999,308(1-2):37-44.
[7]Berkowitz J,Mayhew C A,Ruci'cB.Photoion-pair formation in Cl2[J].Chem Phys,1988,123(2):317-328.
[8]Briank D,Macdonald R G.Channeling of products in the hot atom reaction H + (CN)2→HCN/HNC + CN and in the reaction of CN with CH3SH[J].J Phys Chem A,2001,105(28):6817-6825.
[9]Lary D J.Atomospheric pseudohalogen chemistry[J].Atmos Chem Phys,2004,4:5381-5405.
[10]邊江魚.CH3SH+CN微觀反應(yīng)機理的理論研究[J].分子科學(xué)學(xué)報,2009,25(5):338-342.
[11]許保恩,李曉艷,曾艷麗,等.CH3SH與CN自由基的反應(yīng)機理及電子密度拓?fù)浞治觯跩].物理化學(xué)學(xué)報,2008,24(7):1245-1251.
[12]Frisch M J,Trucks G W,Schlegel H B,et al.2009Gaussian 09,Revision A.02[CP].Gaussian,Inc.,Wallingford CT.
[13]Zhang S W,Truong T N,VKLab,Version 1.0[CP].University of Utah,Salt Lake City USA,2001.
[14]Lide D R.CRC Handbook of Chemistry and Physics(84th ed)[M].Boca Raton:CRC Press,2003:1352-1367.
[15]May Ingo W,Pace E L.The vibrational spectra of methanethiol[J].Spectrochim Acta Part A:Molecular Spectroscopy,1968,24(10):1605-1615.

