ApoG2聯(lián)合紫杉醇對鼻咽癌細(xì)胞及其移植瘤的抑制作用觀察
鐘 梅,汪森明,石豐榕,朱震威
(南方醫(yī)科大學(xué)附屬珠江醫(yī)院,廣州510282)
鼻咽癌是我國常見的惡性腫瘤之一,發(fā)病率呈逐年上升趨勢[1],盡管近年來其治療有較大進(jìn)展,但腫瘤轉(zhuǎn)移或治療后復(fù)發(fā)率仍較高。Apogossypolo ne(ApoG2)是棉酚的一種新型衍生物,具有抗腫瘤活性高、毒性小、穩(wěn)定性好的特點(diǎn)[2]。紫杉醇(PTX)從紫杉樹皮中提取,是作用于細(xì)胞微管的主要抗腫瘤藥物之一,對多種腫瘤有明顯療效。近期我們觀察了ApoG2聯(lián)合PTX對人鼻咽癌CNE-2細(xì)胞及其移植瘤的抑制作用,并初步探討其可能機(jī)制,旨在為鼻咽癌的治療提供理論依據(jù)。
1 材料與方法
1.1 材料 Balb/c-nu裸鼠由廣東省實(shí)驗(yàn)動(dòng)物中心提供,4~6周齡,體質(zhì)量16~20 g,雌雄不拘,在無特定病原體(SPF)條件下飼養(yǎng)。動(dòng)物質(zhì)量和環(huán)境設(shè)施合格證號分別為:SCXK(粵)2008-0002、SYXK(粵)-2007-0081。人鼻咽癌CNE-2細(xì)胞株由南方醫(yī)科大學(xué)腫瘤研究所細(xì)胞中心提供(采用含10%胎牛血清的DMEM培養(yǎng)基,于37℃、5%CO2培養(yǎng)箱中培養(yǎng))。ApoG2由美國密歇根大學(xué)醫(yī)學(xué)院腫瘤中心徐梁教授惠贈(zèng)。PTX購自海南中化聯(lián)合制藥有限公司。兔源Bcl-2多克隆抗體為美國CST公司產(chǎn)品,兔SP檢測試劑盒(SP-9000)、DAB顯色試劑盒(ZLI-9031)、AP標(biāo)記山羊抗兔IgG均購自北京中杉公司。其余試劑為國產(chǎn)分析純。
1.2 ApoG2、PTX對CNE-2細(xì)胞生長的抑制作用觀察
1.2.1 ApoG2、PTX 干預(yù)及半數(shù)抑制濃度(IC50)、細(xì)胞抑制率測定 取對數(shù)生長期CNE-2細(xì)胞,計(jì)數(shù)為8×104個(gè)/mL,取每孔100 μL接種于96孔培養(yǎng)板,置于37℃、5%CO2孵箱中培養(yǎng),待24 h細(xì)胞貼壁后加入含不同藥物的培養(yǎng)液干預(yù)。①ApoG2干預(yù):加入含ApoG2完全培養(yǎng)液200 μL,ApoG2濃度分別為為 5、10、20、40、60 μmol/L;②PTX 干預(yù):加入含PTX 的完全培養(yǎng)液 200 μL,濃度分別為 0.001、0.01、0.1、1、2 μmol/L;③ApoG2 及 PTX 聯(lián)合干預(yù):加入含ApoG2及PTX的完全培養(yǎng)液200 μL,兩藥濃度不變。對照孔不加細(xì)胞懸液只加含0.1%DMSO培養(yǎng)液200 μL。加藥后每個(gè)濃度設(shè)3個(gè)復(fù)孔,繼續(xù)放入培養(yǎng)箱中培養(yǎng)。48 h后終止培養(yǎng),每孔加入MTT20 μL(5 mg/mL)培養(yǎng)4 h,離心吸去培養(yǎng)液,每孔加入150 μL DMSO震蕩10 min,使結(jié)晶物充分溶解。酶聯(lián)免疫檢測儀檢測490 nm波長處吸光度值(OD值)。計(jì)算48 h的IC50、細(xì)胞抑制率及兩藥相互作用系數(shù)(CDI)。
1.2.2 ApoG2、PTX干預(yù)及細(xì)胞凋亡率檢測 取對數(shù)生長期CNE-2細(xì)胞消化傳代,待細(xì)胞長至70%滿度時(shí),吸棄舊培養(yǎng)液分為四組。對照組不干預(yù);ApoG2 組予 ApoG2 20 μmol/L,PTX 組予 PTX 0.01 μmol/L,聯(lián)合組予 ApoG2及 PTX,藥物濃度同
1.2.1 。干預(yù)后繼續(xù)培養(yǎng)48 h,取5 ×105個(gè)細(xì)胞,常規(guī)低速離心5 min,棄上清液加入400 μL的Binding Buffer重懸細(xì)胞,加入5 μL的 Annexin V-FITC混勻,加入5 μL碘化丙啶(PI)混勻,室溫條件下避光反應(yīng)10 min,流式細(xì)胞儀檢測細(xì)胞凋亡率。
1.3 ApoG2、PTX對CNE-2細(xì)胞皮下移植瘤的抑瘤作用觀察
1.3.1 皮下移植瘤模型建立及ApoG2、PTX干預(yù)取于H-DMEM培養(yǎng)基中培養(yǎng)的對數(shù)生長期CNE-2細(xì)胞制備細(xì)胞懸液。于12只Balb/c-nu裸鼠右背部皮下各接種5×105個(gè)CNE-2細(xì)胞(約0.1 mL)。待肉眼可見局部腫瘤生長時(shí)將小鼠隨機(jī)分為四組(各3只)腹腔給藥:對照組注射生理鹽水;PTX組注射PTX 20 mg/kg(0.2 mL),隔日 1 次,共3 次;ApoG2組注射ApoG2 80 mg/kg(0.2mL),共5次;聯(lián)合組聯(lián)合應(yīng)用ApoG2及PTX,給藥劑量、方式及時(shí)間同單藥組。
1.3.2 觀察項(xiàng)目 ①腫瘤抑制率:待對照組腫瘤體積超過1 cm3(給藥15 d左右)時(shí)處理小鼠,完整剝離皮下瘤結(jié)節(jié),稱重,計(jì)算腫瘤抑制率。腫瘤抑制率=(對照組瘤重-實(shí)驗(yàn)組瘤重)/對照組瘤重。繪制移植瘤生長曲線。②腫瘤組織Bcl-2蛋白表達(dá):取各組移植瘤標(biāo)本,石蠟包埋,4 μm切片。常規(guī)二甲苯脫臘,梯度酒精水化后置于枸櫞酸緩沖液中微波加熱至92~98℃,2 min后改為小火10 min以修復(fù)抗原,自然冷卻至室溫,按SP試劑盒說明書完成免疫染色各步驟,以PBS代替一抗作為陰性對照。結(jié)果判定:每組選取3張切片進(jìn)行分析。Bcl-2陽性表達(dá)為腫瘤細(xì)胞胞質(zhì)染成棕黃色。高倍鏡(400×)下觀察10個(gè)高倍視野,計(jì)數(shù)1 000個(gè)細(xì)胞,計(jì)算陽性細(xì)胞百分率。
1.4 統(tǒng)計(jì)學(xué)方法 采用SPSS13.0統(tǒng)計(jì)軟件行統(tǒng)計(jì)學(xué)處理。數(shù)據(jù)以ˉx±s表示,兩樣本均數(shù)比較采用t檢驗(yàn),多個(gè)樣本均數(shù)比較應(yīng)用單因素方差分析(Oneway ANOVA)。P≤0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 細(xì)胞生長抑制情況
2.1.1 細(xì)胞抑制率 ApoG2、PTX單用及聯(lián)用48 h細(xì)胞抑制率見表1。由表1可見,ApoG2、PTX單用對細(xì)胞生長均有抑制作用,與對照組比較,F(xiàn)ApoG2=601.523,PApoG2=0.000;FPTX=482.730,PPTX=0.000;聯(lián)合組抑制率隨兩藥濃度增強(qiáng)逐漸增加,兩者之間存在交互效應(yīng)(F=12.590,P=0.000),CDI<1,兩者發(fā)揮協(xié)同效應(yīng)。作用48 h后ApoG2與PTX的IC50值分別為 45.41 μmol/L 和 0.13 μmol/L。

表1 ApoG2、PTX單用及聯(lián)用48 h CNE-2細(xì)胞抑制率(n=3,%,ˉx±s)
2.1.2 細(xì)胞凋亡率 20 μmol/L APoG2、0.01 μmol/L PTX及二者聯(lián)用48 h細(xì)胞凋亡率分別為:對照組(2.17 ±0.32)%,APoG2 組(4.39 ±0.30)%,PTX 組(18.81 ±1.32)%,聯(lián)合組(24.13±1.56)%。聯(lián)合組明顯高于單藥組,P<0.05。提示ApoG2與PTX聯(lián)用較各單藥應(yīng)用能更明顯誘導(dǎo)CNE-2細(xì)胞凋亡。
2.2 移植瘤生長抑制情況 皮下接種鼻咽癌CNE-2細(xì)胞4 d后肉眼可見局部腫瘤生長。
2.2.1 移植瘤生長情況 各組移植瘤生長曲線見圖1。對照組、PTX組、ApoG2組、聯(lián)合組治療初期腫瘤均逐漸增大.但對照組生長速度在各時(shí)間點(diǎn)上均快于3個(gè)治療組。從第5天開始各治療組和對照組相比,腫瘤體積的變化差異有顯著性(P<0.01)。
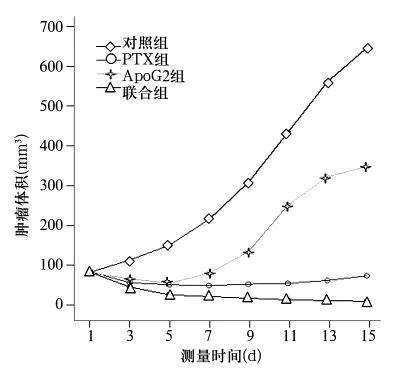
圖1 各組移植瘤生長情況
2.2.2 瘤重及抑瘤率 治療結(jié)束后各組平均瘤重及抑瘤率比較見表2。

表2 治療結(jié)束四組平均瘤重及抑瘤率比較(n=3,ˉx±s)
2.2.3 腫瘤組織Bcl-2蛋白表達(dá) Bcl-2表達(dá)率對照組為(91.29±3.61)%,ApoG2組為(67.12 ±4.57)%,PTX 組為(50.62 ±2.80)%,聯(lián)合組為(31.54±6.02)%;與對照組比較,PTX 組、ApoG2組和聯(lián)合組表達(dá)率均明顯降低,P<0.01;聯(lián)合組顯著低于PTX組和ApoG2組,P均<0.01。
3 討論
研究證實(shí),ApoG2是Bcl-2的小分子阻斷劑,能夠誘導(dǎo)多種細(xì)胞凋亡[3,4]。PTX是目前已經(jīng)明確的作用于細(xì)胞微管的抗腫瘤藥物[5],其通過促進(jìn)微管蛋白聚合抑制解聚,保持微管蛋白穩(wěn)定,抑制細(xì)胞有絲分裂,而對正常的細(xì)胞基本無影響,是目前治療鼻咽癌的重要化療藥物之一[6]。近年研究發(fā)現(xiàn),微管的完整性被破壞后可導(dǎo)致Bcl蛋白磷酸化,促使細(xì)胞發(fā)生凋亡;Bcl-2磷酸化可抑制Bcl-2與Bax二聚體的形成,抑制Bcl-2的功能[7]。
線粒體依賴性細(xì)胞凋亡通路是指調(diào)節(jié)線粒體膜表面Bcl-2家族蛋白的表達(dá),引起細(xì)胞色素C(Cytc)從線粒體內(nèi)膜釋放.促進(jìn)凋亡體(由Cyt-c、Apaf和Caspase-9)的形成,進(jìn)一步活化效應(yīng)性的Caspase,從而調(diào)控細(xì)胞凋亡。高表達(dá)的抗凋亡的Bcl-XL和Bcl-2蛋白可以與線粒體外膜VDAC(電壓依賴經(jīng)的離子通道)結(jié)合,保護(hù)線粒體膜的完整性,當(dāng)ApoG2結(jié)合抗凋亡蛋白并抑制其保護(hù)功能后,線粒體膜的完整性很快就被破壞;Bcl-2和Bcl-XL蛋白過表達(dá)均會(huì)抑制線粒體依賴性細(xì)胞凋亡通路,且會(huì)增加細(xì)胞對放化療的抵抗性。Arnold等[8]研究表明,ApoG2能抑制淋巴瘤細(xì)胞增殖,誘導(dǎo)細(xì)胞色素C從線粒體釋放到細(xì)胞質(zhì),促進(jìn)凋亡相關(guān)蛋白Caspase-3和Caspase-9活化,最終誘導(dǎo)淋巴瘤細(xì)胞發(fā)生凋亡。
Bcl-2是迄今為止功能最明確的細(xì)胞凋亡拮抗基因,其廣泛分布于細(xì)胞膜系統(tǒng)(特別是在線粒體膜上),有阻止細(xì)胞色素C釋放、抑制細(xì)胞凋亡的作用。抗凋亡的Bcl-2家族蛋白在抑制腫瘤細(xì)胞凋亡中起著關(guān)鍵作用,這類蛋白在許多類型的腫瘤中均呈高表達(dá),如鼻咽癌、胰腺癌、乳腺癌、胃癌和肺癌[9,10]。鑒于其可能與腫瘤的放療抵抗、化療耐藥以及不良預(yù)后相關(guān),抑制Bcl-2活性或降低Bcl-2的表達(dá)水平可能成為鼻咽癌治療的一條新途徑。
本研究結(jié)果顯示,ApoG2與PTX單藥對細(xì)胞的抑制作用隨藥物濃度提高而增強(qiáng),呈濃度依賴性,二者聯(lián)合應(yīng)用有協(xié)同作用;PTX與ApoG2聯(lián)用的凋亡率高于單藥應(yīng)用,但總體凋亡率并不高,原因可能是部分凋亡晚期細(xì)胞已碎裂成碎片,與壞死無法區(qū)別;細(xì)胞凋亡早期細(xì)胞內(nèi)結(jié)構(gòu)已發(fā)生變化,但細(xì)胞膜完整,染料無法進(jìn)入細(xì)胞內(nèi)以及結(jié)合外翻的細(xì)胞膜進(jìn)行染色。本研究結(jié)果顯示,ApoG2、PTX及兩者聯(lián)用均可抑制移植瘤生長,隨著作用時(shí)間的延長抑制作用更加明顯,此與前期研究及國外文獻(xiàn)報(bào)道相符[11,12];從第 5 天起至治療結(jié)束,聯(lián)合組腫瘤生長抑制率均明顯高于ApoG2組及PTX組,顯示ApoG2及PTX有明顯的協(xié)同作用,ApoG2可增強(qiáng)PTX的敏感性。為進(jìn)一步探討這種聯(lián)合效應(yīng)是否可特異性抑制靶蛋白的表達(dá),我們采用免疫組化法檢測了移植瘤組織Bcl-2蛋白的表達(dá)情況,結(jié)果提示PTX與ApoG2聯(lián)用可協(xié)同抑制Bcl-2蛋白表達(dá)。
綜上所述,ApoG2具有抗鼻咽癌及化療增敏作用,且無明顯毒副反應(yīng),可能是一種良好的治療鼻咽癌的新藥。
[1]Jia WH,Huang QH,Liao JY,et al.Trends in incidence and mortality of nasopharyngeal carcinoma over a 20-25 year period(1978/1983-2002)in Sihui and Cangwu counties in southern China[J].BMC Cancer,2006,6(期?):178.
[2]Kitada S,Leone M,Sareth S,et al.Discovery,characterization,and structure-activity relationships studies of proapoptotic polyphenols targeting B-cell lymphocyte/leukemia-2 proteins[J].J Med Chem,2003,46(20):4259-4264.
[3]Lin J,Wu YJ,Yang DJ,et al.Effect of apogossypolone on induction apoptosis in multiple myeloma cells and its mechanisms[J].J Exp Hematol,2009,17(1):92-98.
[4]Hu ZY,Zhu XF,Zhong ZD,et al.ApoG2,a novel inhibitor of antiapoptotic Bcl-2 family proteins,induces apoptosis and suppresses tumor growth in nasopharyngeal carcinoma xenografts[J].Int J Cancer,2008,123(10):2418-2429.
[5]Eum KH,Lee M.Crosstalk between autophagy and apoptosis in the regulation of paclitaxel-induced cell death in v-Ha-ras-transformed fibroblasts[J].Mol Cell Biochem,2011,348(1-2):61-68.
[6]Vermorken JB,Remenar E,van Herpen C.Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer[J].N Engl J Med,2007,357(17):1695-1704.
[7]Vantieghem A,Xu Y,Assefa Z,et al.Phosphorylation of Bcl-2 in G2/M phase-arrested cells following photodynamic therapy with hypericin involves a CDKl-mediated signal and delays the onset of apoptosis[J].J Biol Chem,2002,277(40):37718-37731.
[8]Arnold AA,Aboukameel A,Chen J,et al.Preclinical studies of Apogossypolone:a new nonpeptidic pan small-molecule inhibitor of Bcl-2,Bcl-XL and Mcl-1 proteins in follicular small cleaved cell lymphoma model[J].Mol Cancer,2008,7(20):453-463.
[9]Evans JD,Cornford PA,Dodson A,et al.Detailed tissue expression of bcl-2,bax,bak and bcl-x in the normal human pancreas and in chronic pancreatitis,ampullary and pancreatic ductal adenocarcinomas[J].Pancreatology,2001,1(3):254-262.
[10]Yan yan,Qiao Minze,Jia Xiumei,et al.FENG.Expressions of JAK1,p-STAT3 and bc-l 2 in Gastric Cancer and Their Significance[J].Cancer Res Prev Treat,2009,36(8):657-661.
[11]Niu XG,Wang SM,Ding WM.Inhibition and apoptosis effects of apogossypolone on breast cancer cell line MCF-7[J].Tumor,2010(12):1022-1026.
[12]Banerjee S,Choi M,Aboukameel A,et al.Preclinical studies of apogossypolone,a novel pan inhibitor of bcl-2 and mcl-1,synergistically potentiats cytotoxic effect of gemcitabine in pancreatic cancer cells[J].Pancreas,2010,39(3):323-331.

