1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷的中試研究
林 民,李 華,王 偉,龍 軍
(1.中國石化石油化工科學研究院,北京100083;2.中國石化長嶺分公司;3.湖南長嶺石化科技開發有限公司)
環氧丙烷是僅次于聚丙烯和丙烯腈的丙烯第三大衍生物[1],主要用于聚氨酯塑料、不飽和樹脂和表面活性劑的生產。我國環氧丙烷的產量從2007年的680kt增加到2011年的1 350kt,平均年增長率約13%;消費量從2007年的795kt增大到2011年的1 850kt,平均年增長率接近21%;進口量從2007年的147kt增加到2011年的300kt,平均年增長率接近21%。隨著環氧丙烷下游衍生物,特別是聚醚多元醇的快速增長,環氧丙烷的需求也將快速增長,預計2015年國內需求量將達到1 980kt左右,進口量將進一步增大。
現有的環氧丙烷合成工藝主要為氯醇法和共氧化法,國內生產環氧丙烷的裝置除中海殼牌石油化工有限公司和寧波鎮海煉化利安德化學有限公司從國外引進的兩套裝置采用共氧化法外,其余全部采用氯醇法。氯醇法轉化效率低、耗氯量大、設備腐蝕和污染嚴重,每生產1t環氧丙烷約副產40~60t含氯廢水,環境污染非常嚴重,目前多個地區已要求關閉氯醇法生產環氧丙烷的裝置。共氧化法也存在工藝復雜、流程長、對設備要求高、投資大、副產物多、廢氣污染嚴重、聯產問題突出等問題。因此,開發無污染、成本低的環氧丙烷生產新方法是國內外研究的熱點。
鈦硅分子篩(TS-1)是Enichim化學公司Taramasso等[2]發現的一種新型催化材料,被譽為20世紀80年代沸石催化的里程碑[3-9]。鈦硅分子篩催化的丙烯與雙氧水環氧化制備環氧丙烷的方法,克服了氯醇法和共氧法的不足,具有條件溫和、工藝簡單、環境友好、產品選擇性好、原子經濟利用率高等特點,是國際公認的“綠色”環保生產技術,是環氧丙烷合成技術發展的趨勢。
中國石化石油化工科學研究院(以下簡稱石科院)、中國石化長嶺分公司(以下簡稱長嶺分公司)和湖南長嶺石化科技開發有限公司合作開發了鈦硅分子篩催化的丙烯與雙氧水環氧化合成環氧丙烷技術,在實驗室、小試和側線試驗的基礎上,在湖南岳陽建成了1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷的中試裝置。本課題主要考察反應溫度、甲醇/雙氧水的摩爾比和雙氧水空速等對反應的影響,確定丙烯與雙氧水環氧化制備環氧丙烷的中試條件。
1 中試試驗
1.1 主要原料和催化劑的性質
原料丙烯取自長嶺分公司氣體分離裝置,其中丙烯體積分數不小于99.6%;氧化劑雙氧水購于中國石化巴陵分公司,其中過氧化氫的質量分數為27.5%~50%,穩定度不小于97%;溶劑甲醇為購于化學品工業市場的工業品。
環氧化催化劑HPO-1是以石科院開發的具有自主知識產權的空心鈦硅分子篩[10-11]為催化組元、經改性和成型后制備的丙烯雙氧水環氧化專用催化劑,其主要性質見表1。

表1 環氧化催化劑HPO-1的主要性質
1.2 分析方法
采用美國ThermoFisher公司生產的TraceISQ質譜分析儀分析丙烯與雙氧水環氧化產物的組成;利用HP-6890型氣相色譜儀,采用氣相色譜內標法對反應產物進行定量分析。雙氧水轉化率、環氧丙烷的選擇性以及各組分的選擇性計算式如下:
雙氧水轉化率:
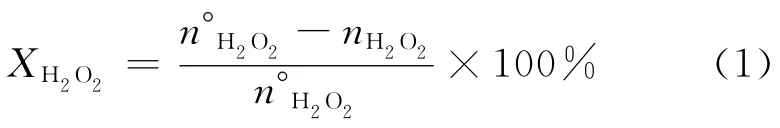
環氧丙烷選擇性:
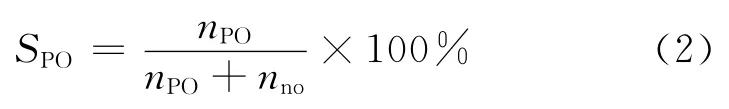
丙二醇醚選擇性:
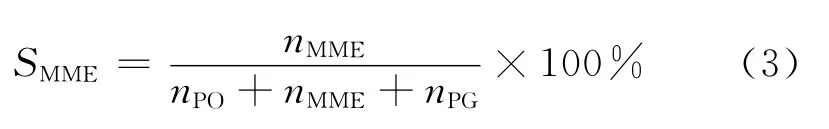
丙二醇選擇性:

式中:XH2O2為 H2O2轉化率,%;n°H2O2為初始加入的雙氧水的物質的量;nH2O2為反應產物中雙氧水的物質的量;SPO為環氧丙烷選擇性,%;nPO為反應生成的環氧丙烷的物質的量;nno為反應生成的副產物的物質的量;SMME為丙二醇醚的選擇性,%;nMME為反應生成的丙二醇醚的物質的量;SPG為丙二醇的選擇性,%;nPG為反應生成的丙二醇的物質的量。
1.3 中試裝置工藝流程
1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷的中試工藝流程示意見圖1。丙烯、甲醇和雙氧水在反應器底部混合后進入裝有環氧化催化劑HPO-1的反應器中,在催化劑床層丙烯與雙氧水發生環氧化反應,生成含有丙烯、環氧丙烷、甲醇和水的混合溶液。混合溶液進入丙烯分離塔,塔頂分離出丙烯,經丙烯提純塔提純后,返回反應器底部作為循環丙烯與新鮮丙烯一起重新進入反應器底部混合;從丙烯分離塔底部出來的環氧丙烷、甲醇和水的混合溶液進入環氧丙烷分離塔,從環氧丙烷分離塔塔頂出來的含少量甲醇的環氧丙烷物料進入環氧丙烷提純塔進一步分離,從塔釜得到高純度的環氧丙烷,塔頂含甲醇的環氧丙烷回環氧丙烷分離塔作為進料。環氧丙烷分離塔底部出來的釜料主要為甲醇和水,進入甲醇分離塔進行甲醇和水的分離,塔頂采出甲醇并循環回用,釜底水送往界區外處理。
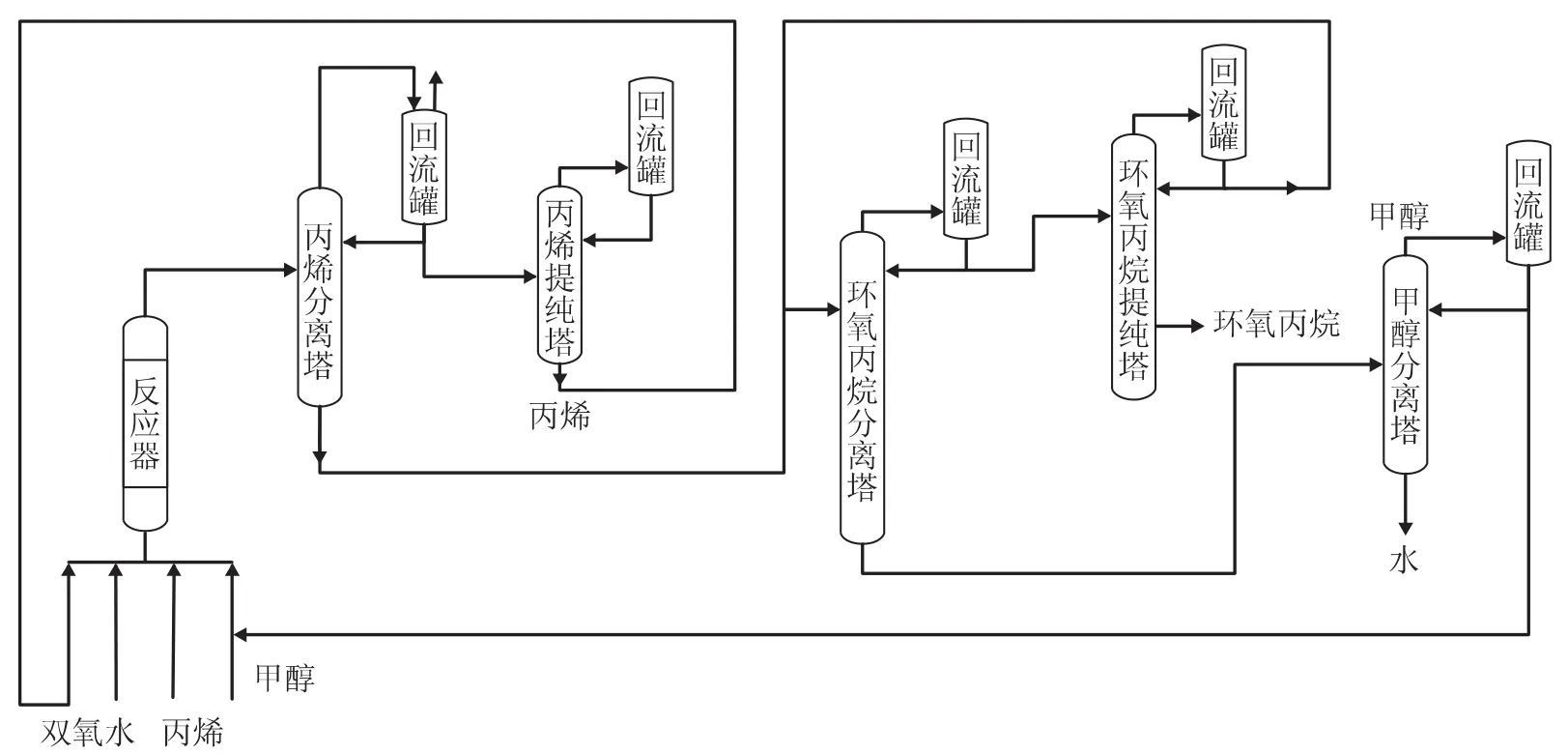
圖1 1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷中試流程示意
1.4 主要工藝條件
由于丙烯含有活潑氫,極易被深度氧化成為復雜含氧化合物,因此丙烯的環氧化反應采用雙氧水作為氧化劑,在緩和條件下進行。根據小試和側線試驗的結果,1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷中試的主要操作條件見表2。

表2 中試的主要操作條件
2 結果與討論
2.1 反應條件對反應性能的影響
2.1.1 反應溫度 根據Arrhenius方程,提高反應溫度有利于反應速率的增加,但丙烯與雙氧水環氧化生成環氧丙烷的反應是一個放熱的不可逆連串反應,而主要副反應也是放熱反應,各反應的活化能不同,反應溫度對各組分的影響也不同,因此反應溫度對環氧丙烷的穩定性存在影響[12]。
在中試固定床反應裝置上,在反應壓力1.5 MPa、雙氧水質量空速1.1h-1、甲醇與雙氧水的摩爾比6、丙烯與雙氧水的摩爾比2.5的條件下,考察反應溫度對環氧化催化劑HPO-1催化丙烯與雙氧水環氧化反應的雙氧水轉化率、環氧丙烷選擇性及其它產物選擇性的影響,結果分別見圖2和圖3。從圖2可以看出,隨著反應溫度的升高,雙氧水轉化率增加,環氧丙烷的選擇性下降。從圖3可以看出,隨著反應溫度的升高,丙二醇醚和丙二醇的選擇性均逐漸升高。因此,反應溫度的升高不僅使得環氧丙烷更易于與溶劑甲醇發生反應,生成丙二醇醚,而且環氧丙烷與水發生的水合反應也增加了,導致生成更多的丙二醇。但是溫度太低時,會導致雙氧水反應速率下降,殘余的雙氧水增多,使系統的安全性和穩定性受到影響。因此,選擇合適的反應溫度極為重要。不同的環氧化催化劑所需要的反應溫度會有所不同,對于本中試裝置采用的環氧化催化劑HPO-1而言,合適的反應溫度仍可為30~70℃。
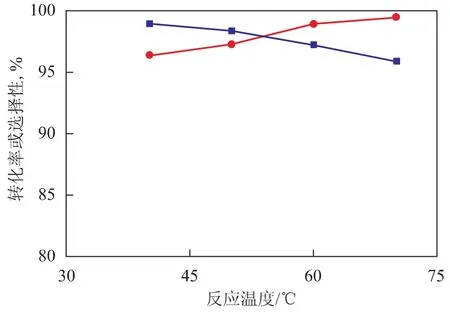
圖2 反應溫度對雙氧水轉化率和環氧丙烷選擇性的影響
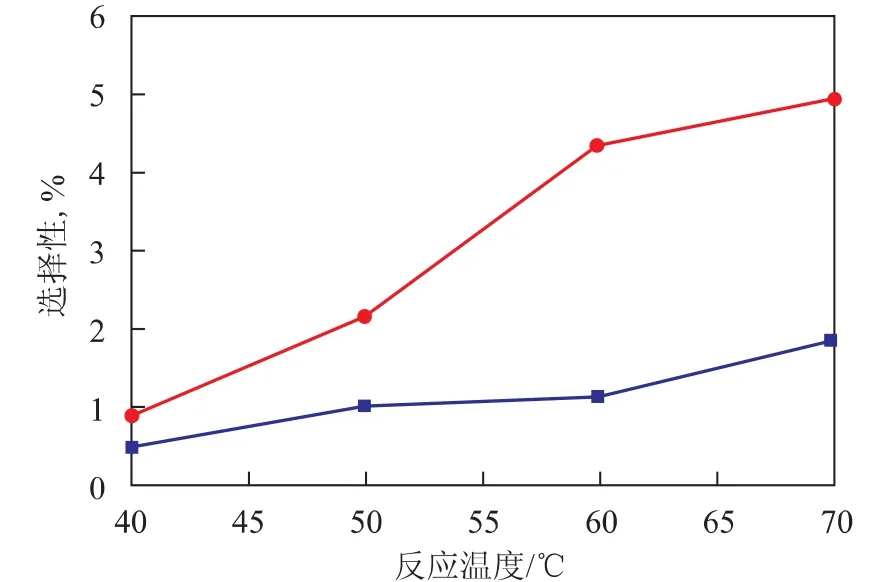
圖3 反應溫度對丙二醇醚和丙二醇選擇性的影響
2.1.2 甲醇與雙氧水的摩爾比 丙烯與雙氧水環氧化合成環氧丙烷是一個放熱反應,絕熱溫升較大,甲醇除與鈦硅分子篩形成活性中心外,同時還充當熱載體。因此許多研究和試驗通過使甲醇過量來實現丙烯與雙氧水環氧化合成環氧丙烷的過程。在反應溫度35℃、反應壓力2.0MPa、雙氧水質量空速1.20h-1、丙烯與雙氧水的摩爾比2.0的條件下,考察甲醇與雙氧水的摩爾比對雙氧水轉化率和環氧丙烷選擇性的影響,結果見圖4。從圖4可以看出,隨著甲醇與雙氧水摩爾比的增大,雙氧水轉化率和環氧丙烷選擇性增加,這主要是甲醇與環氧丙烷在催化劑活性位上競爭吸附、減少環氧丙烷在催化劑上進一步發生副反應的原因。但過高的甲醇與雙氧水摩爾比導致產物環氧丙烷的分離能耗增加,分離成本增大,而難以進行工業化生產。因此對于本中試裝置采用的環氧化催化劑HPO-1而言,合適的甲醇與雙氧水的摩爾比為5~25。
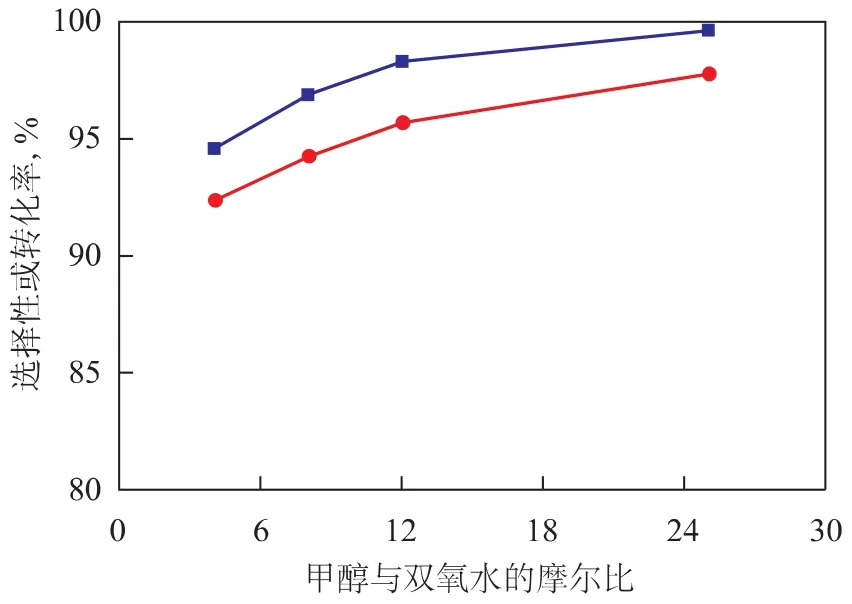
圖4 甲醇與雙氧水的摩爾比對雙氧水轉化率和環氧丙烷選擇性的影響
2.1.3 雙氧水質量空速 在反應溫度65℃、反應壓力1.0MPa、甲醇與雙氧水的摩爾比7、丙烯與雙氧水的摩爾比1.4的條件下,考察雙氧水質量空速對雙氧水轉化率和環氧丙烷選擇性的影響,結果見圖5。從圖5可以看出,隨著雙氧水質量空速的提高,反應物料與催化劑的接觸時間減少,環氧丙烷進一步發生副反應的幾率降低,環氧丙烷的選擇性增加,但雙氧水轉化率下降。因此對于本中試裝置采用的環氧化催化劑HPO-1而言,合適的雙氧水質量空速為0.12~1.20h-1。
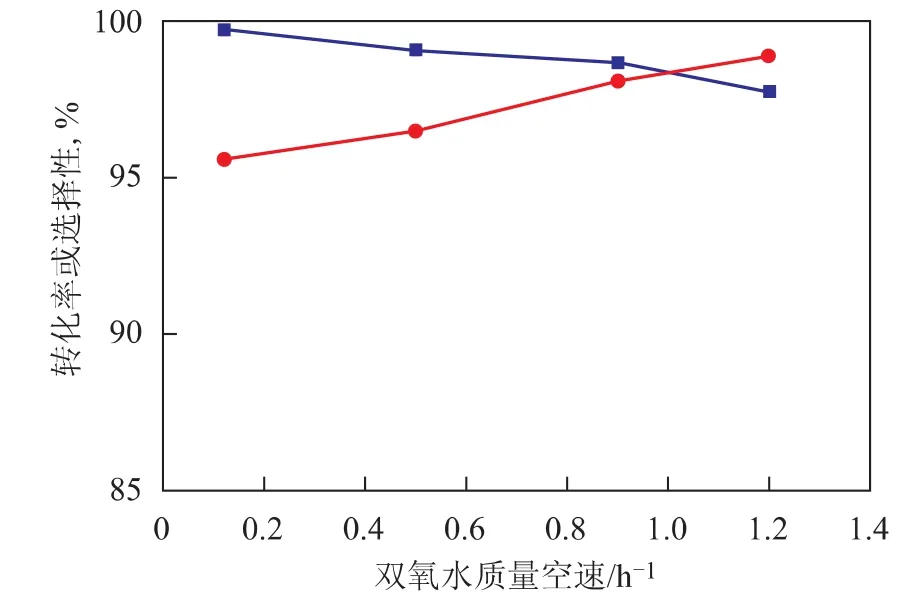
圖5 雙氧水質量空速對雙氧水轉化率和環氧丙烷選擇性的影響
2.2 中試裝置運行情況
在反應溫度30~70℃、反應壓力0.5~2.0 MPa、雙氧水質量空速0.12~1.20h-1、甲醇與雙氧水的摩爾比5~25、丙烯與雙氧水摩爾比1.2~2.5的條件下進行中試試驗,試驗期間雙氧水轉化率主要分布在96%~99%,環氧丙烷的選擇性主要分布在96%~98%;環氧化催化劑HPO-1穩定運行的時間已超過6 000h,催化劑的性能未見明顯下降。
反應器出口的反應產物經過產品分離,并經過雙共沸蒸餾工藝分離提純,所得環氧丙烷產品的純度不小于99.97%,已通過合成聚醚和聚氨酯驗證。中試生產的環氧丙烷產品目前已銷往生產丙二醇、油田破乳劑、碳酸丙烯酯、三異丙醇胺、丙烯酸羥丙酯和碳酸二甲酯等的廠家。
中試試驗基本驗證和重復了小試和側線試驗的結果,通過了中國石化組織的評審和驗收。目前已完成100kt/a丙烯與雙氧水環境友好制備環氧丙烷工業試驗的工藝包設計,并通過了中國石化組織的評審,計劃2013年建成投產。
3 結 論
(1)在實驗室研究、小試和側線試驗的基礎上,建立了1.0kt/a丙烯與雙氧水環氧化制備環氧丙烷中試裝置,確定中試工藝條件為:反應溫度30~70℃,反應壓力0.5~2.0MPa,雙氧水質量空速0.12~1.20h-1,甲醇與雙氧水的摩爾比5~25,丙烯與雙氧水的摩爾比1.2~2.5。
(2)在所確定的中試條件下,丙烯與雙氧水環氧化催化劑 HPO-1的穩定運行時間已超過6 000h,雙氧水轉化率為96%~99%,環氧丙烷的選擇性為96%~98%。
(3)采用雙共沸蒸餾工藝分離提純環氧丙烷,所得產品的純度不小于99.97%。
致謝:湖南長嶺石化科技開發有限公司的分析研究室、中國石化石油化工科學研究院科研處、中國石化長嶺分公司技術開發處和長盛公司對本項目提供了極大的支持和幫助,在此表示感謝!
[1]李濤.環氧丙烷的生產現狀及市場分析[J].石油化工技術與經濟,2012,28(3):21-25
[2]Taramasso M,Pereo G,Notari B.Preparation of porous crystalline synthetic material comprised of silicon and titanium oxides:The United States,US 4410501[P].1983-08-18
[3]Thangaraj A,Kumar R,Mirajkar S P,et al.Catalytic properties of crystalline titanium silicalites:Ⅰ.Synthesis and characterization of titanium-rich zeolites with MFI structure[J].Journal of Catalysis,1991,130(1):1-8
[4]Camblor M A,Corma A,Pérez-Pariente J.Synthesis of titanoaluminosilicates isomorphous to zeolite beta,active as oxidation catalysts[J].Zeolites,1993,13(2):82-87
[5]Madhusudan Reddy K M,Kaliaguine S,Sayari A.Synthesis of titanium containing silica ZSM-48(TS-48)using hexamethonium hydroxide as template[J].Catalysis Letters,1994,23:169-173
[6]Reddy J S,Kumar R,Ratnasamy P.Titanium silicalite-2:Synthesis,characterization and catalytic properties[J].Applied Catalysis,1990,58(1):1-4
[7]Martens J A,Buskens P H,Jacobs P A,et al.Hydroxylation of phenol with hydrogen peroxide on EUROTS-1catalyst original research article[J].Applied Catalysis A:General,1993,99(1):71-84
[8]Thangaraj A,Kumar R,Ratnasamy P.Catalytic properties of crystalline titanium silicalites:Ⅱ.Hydroxylation of phenol with hydrogen peroxide over TS-1zeolites[J].Journal of Catalysis,1991,131(1):294-297
[9]Reddy J S,Kumar R.Crystallization kinetics of a new titanium silicate with MEL structure(TS-2)[J].Zeolites,1992,12(1):95-100
[10]林民,舒興田,汪燮卿.環境友好催化劑鈦硅分子篩合成及應用研究[J].石油煉制與化工,1999,30(8):1-4
[11]陳曉暉,林民,陳憲,等,TS-1的丙烯環氧化性能研究[J].燃料化學學報,2001,29(5):426-429
[12]王祥生.鈦硅沸石的研究現狀及工業化前景[J].精細化工,1996,13(1):30-34

