壇紫菜葉狀體營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞葉綠素?zé)晒馓匦员容^
李家富,張 濤,陸勤勤,朱建一,沈宗根,劉兆普,王長(zhǎng)海
(1.南京農(nóng)業(yè)大學(xué) 資源與環(huán)境科學(xué)學(xué)院,江蘇 南京 210095;2.常熟理工學(xué)院 應(yīng)用技術(shù)研究院,江蘇 常熟 215500;3.江蘇省海洋水產(chǎn)研究所,江蘇 南通 226007)
壇紫菜(Porphyra haitanensis)是我國(guó)特有的暖溫帶物種,也是我國(guó)東南沿海廣泛栽培的重要經(jīng)濟(jì)紅藻。壇紫菜藻體由殼孢子萌發(fā)生長(zhǎng)而成,藻體屬單倍體,具配子體性質(zhì)。壇紫菜藻體營(yíng)養(yǎng)細(xì)胞生長(zhǎng)分布均勻,有性生殖器官分為果胞和精子囊器,一般由藻體的末梢邊緣部分營(yíng)養(yǎng)細(xì)胞轉(zhuǎn)化而來(lái),精子囊器細(xì)胞在形成時(shí),顏色逐漸淡化呈現(xiàn)白色或黃白色;果胞及受精分裂形成的果孢子囊中細(xì)胞顏色較營(yíng)養(yǎng)細(xì)胞深,呈深紫紅色[1]。紫菜葉狀體生長(zhǎng)在潮間帶,前人對(duì)葉狀體營(yíng)養(yǎng)細(xì)胞和生殖細(xì)胞的生長(zhǎng)特性進(jìn)行了研究[2-3],對(duì)生殖細(xì)胞的生理特征主要是對(duì)條斑紫菜和半葉紫菜進(jìn)行了研究[4]。
葉綠素?zé)晒饧夹g(shù)在研究PSII對(duì)光能的吸收、分配、耗散等方面具有獨(dú)特優(yōu)勢(shì),能夠快速、準(zhǔn)確、無(wú)損傷地檢測(cè)植物光合電子傳遞能力等“內(nèi)在性”特征,是光合作用尤其是 PSII功能研究的天然探針[5]。調(diào)制熒光技術(shù)首先應(yīng)用在高等植物PSII原初反應(yīng)和猝滅分析中,是研究光合生理特性的重要方法[6-7],在大型藻類中的應(yīng)用則較晚,但已有研究表明該技術(shù)也能客觀反映藻類光合特性[8-13]。
本文以壇紫菜葉狀體為材料,對(duì)不同生殖細(xì)胞及營(yíng)養(yǎng)細(xì)胞葉綠素?zé)晒馓匦赃M(jìn)行了研究,以求進(jìn)一步了解紫菜葉狀體發(fā)育過(guò)程中的光合特性。
1 材料與方法
1.1 試驗(yàn)材料
用于測(cè)試的壇紫菜(圖 1)于 11月采自江蘇省南通紫菜栽培海區(qū),2 h內(nèi)帶回實(shí)驗(yàn)室,挑選健康完整藻體進(jìn)行預(yù)培養(yǎng),海水暗沉淀,培養(yǎng)溫度為 15℃,光照強(qiáng)度為50 μmol/(m2·s)。預(yù)培養(yǎng)1 d后進(jìn)行葉綠素?zé)晒獾戎笜?biāo)的測(cè)定,實(shí)驗(yàn)進(jìn)行3次重復(fù)測(cè)定,測(cè)定區(qū)域如圖1序號(hào)標(biāo)示。
1.2 試驗(yàn)方法
1.2.1 實(shí)際量子效率的測(cè)定

圖1 壇紫菜Fig.1 Porphyra haitanensis
樣品 PSII實(shí)際量子效率采用 Water-PAM(Walz,Effeltrich,Germany)進(jìn)行測(cè)定。將探頭垂直對(duì)準(zhǔn)藻體不同生殖細(xì)胞或營(yíng)養(yǎng)細(xì)胞部位,首先利用0.3 μmol /(m2·s)調(diào)制紅光和 64 μmol /(m2·s)光化光,測(cè)得該光照條件下熒光值(Ft);隨后提供 0.8 s約4 000 μmol /(m2·s)飽和脈沖光,測(cè)得此光化光條件下最大熒光值(Fm′)。按以下公式計(jì)算 PSII實(shí)際量子效率(ΔF/Fm′):
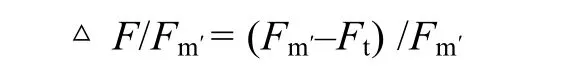
1.2.2 快速光曲線的測(cè)定
對(duì)樣品依次提供0至1 020 μmol /(m2·s)共8個(gè)光強(qiáng)梯度,待不同光強(qiáng)下熒光值(Ft)達(dá)到穩(wěn)定后(約20 s),提供 0.8 s約 4 000 μmol /(m2·s)的飽和脈沖光以測(cè)得該光強(qiáng)下最大熒光(Fm′),按以下公式計(jì)算相對(duì)電子傳遞速率(rETR):

式中,I表示光照強(qiáng)度;A表示樣品的吸光系數(shù),本文中設(shè)定為0.85;0.5表示光能由兩個(gè)光系統(tǒng)平均分配。
以光照強(qiáng)度作為X軸,rETR為Y軸制作曲線即快速光曲線。參照 Platt等的方法,對(duì)快速光曲線進(jìn)行擬合,分別獲得初始斜率、最大相對(duì)電子傳遞速率、半飽和光強(qiáng)等參數(shù):
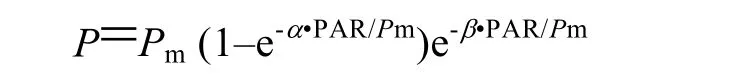
式中,P表示給定光強(qiáng)下的相對(duì)電子傳遞速率(rETR);α表示快速光曲線初始斜率;Pm表示最大相對(duì)電子傳遞速率(rETRmax)。
按以下公式計(jì)算半飽和光強(qiáng)(Ik):

1.2.3 qP和NPQ的測(cè)定
樣品暗適應(yīng)20 min后,經(jīng)遠(yuǎn)紅光照射20 s,然后打開(kāi)測(cè)量光,測(cè)得最小熒光值(Fo);然后提供0.8 s飽和脈沖光,測(cè)定最大熒光值(Fm);隨后關(guān)閉光源,40 s后打開(kāi)活化光(64 μmol /(m2?s)),之后每隔 20 s照射一次飽和脈沖光,直至該活化光下最大熒光值(Fm′)達(dá)到穩(wěn)定。由以下公式計(jì)算光化學(xué)猝滅(qP)和非光化學(xué)猝滅(NPQ):
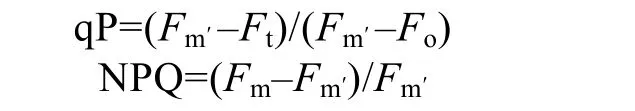
1.3 統(tǒng)計(jì)分析
實(shí)驗(yàn)數(shù)據(jù)采用 t-檢驗(yàn)分析,顯著水平設(shè)為P<0.05。
2 實(shí)驗(yàn)結(jié)果
2.1 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞實(shí)際量子效率差異
在給定的光強(qiáng)下,壇紫菜雌雄藻體營(yíng)養(yǎng)細(xì)胞的△F/Fm′值非常接近,均維持在0.45左右(圖2)。雌藻體營(yíng)養(yǎng)細(xì)胞與雌性生殖細(xì)胞的△F/Fm′值無(wú)顯著差異,但雄藻體營(yíng)養(yǎng)細(xì)胞△F/Fm′值顯著高于雄性生殖細(xì)胞(P<0.05)。雌、雄生殖細(xì)胞間△F/Fm′值存在差異,雌性生殖細(xì)胞△F/Fm′值顯著高于雄性生殖細(xì)胞(P<0.05)。
2.2 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞快速光曲線比較
快速光曲線(RLC)的測(cè)定結(jié)果表明,隨著光照強(qiáng)度的提高,樣品相對(duì)電子傳遞速率(rETR)逐步上升,隨后達(dá)到一個(gè)相對(duì)平穩(wěn)的階段(圖3)。雌、雄藻體營(yíng)養(yǎng)細(xì)胞的 RLC沒(méi)有明顯差異,rETR在光照強(qiáng)度為400 μmol /(m2·s)左右均達(dá)到穩(wěn)定階段,并維持在11至 15之間。雌性生殖細(xì)胞與營(yíng)養(yǎng)細(xì)胞RLC存在一定差異,營(yíng)養(yǎng)細(xì)胞的rETR略高于生殖細(xì)胞,但差異不顯著。雄藻體營(yíng)養(yǎng)細(xì)胞的rETR明顯高于雄性生殖細(xì)胞,當(dāng)光強(qiáng)超過(guò) 200 μmol /(m2·s),營(yíng)養(yǎng)細(xì)胞的rETR顯著高于雄性生殖細(xì)胞(P<0.05)。由生殖細(xì)胞RLC的比較可知,雌性生殖細(xì)胞RLC略高于雄性生殖細(xì)胞,但差異不顯著。
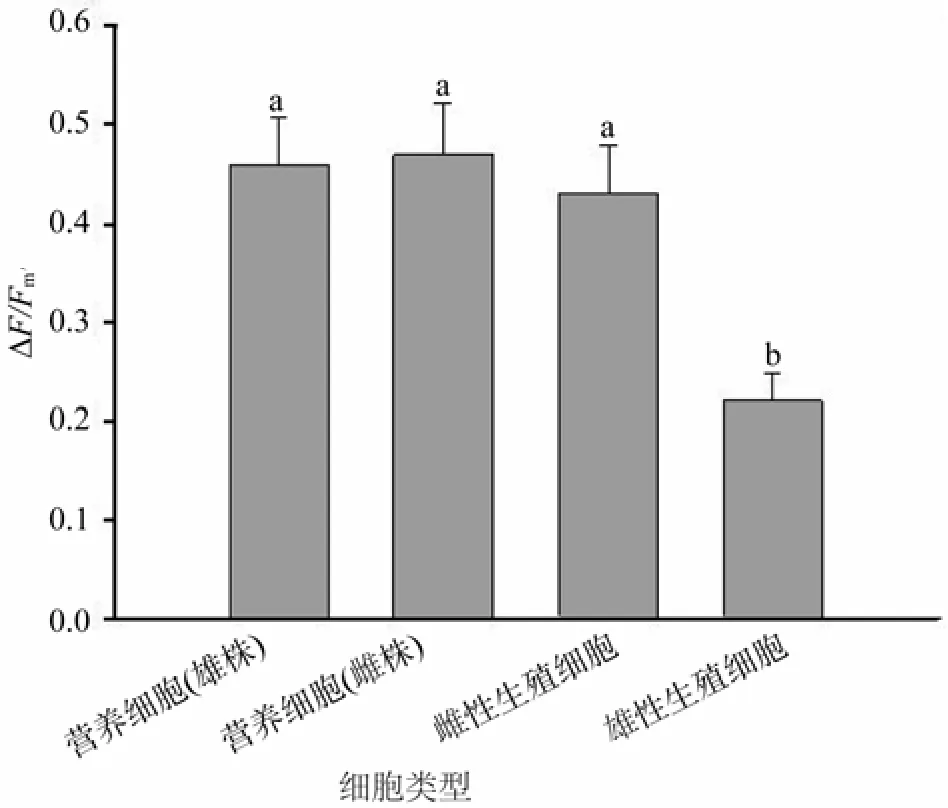
圖2 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞實(shí)際量子效率比較Fig.2 Compare of yield between vegetative and germ cells of P.haitanensis

圖3 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞快速光照曲線比較Fig.3 Compare of rapid light curves between vegetative and germ cells of P.haitanensis
通過(guò)對(duì)RLC擬合,獲得了初始斜率(α)、相對(duì)最大電子傳遞速率(rETRmax)和半飽和光強(qiáng)(Ik)等能夠反映樣品光合作用實(shí)際狀態(tài)的重要參數(shù)。從表1可見(jiàn),雌藻體營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞 α、rETRmax和 Ik等參數(shù)比較均無(wú)顯著差異;雄藻體營(yíng)養(yǎng)細(xì)胞 α和rETRmax均顯著高于雄性生殖細(xì)胞(P<0.05),Ik無(wú)顯著差異;雌性生殖細(xì)胞 α顯著高于雄性生殖細(xì)胞(P<0.05),但rETRmax和Ik無(wú)顯著差異。
2.3 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞qP和NPQ比較
誘導(dǎo)曲線的測(cè)定是通過(guò)對(duì)樣品反應(yīng)中心吸收的光能分配進(jìn)行測(cè)定分析,計(jì)算光化學(xué)猝滅(qP)和非光化學(xué)猝滅(NPQ或 qN)[14]。qP反映 PSII原初電子受體QA的還原狀態(tài),qP值越大則PSII電子傳遞活性越高[15]。考慮到測(cè)定的簡(jiǎn)便性,本試驗(yàn)使用NPQ作為反映非光化學(xué)猝滅的指標(biāo)。從表 2可見(jiàn),在 64 μmol /(m2?s)活化光條件下,雌藻體營(yíng)養(yǎng)細(xì)胞與雌性生殖細(xì)胞 rETR、qP和NPQ均無(wú)顯著差異,但雌藻體營(yíng)養(yǎng)細(xì)胞、雌性生殖細(xì)胞和雄藻體營(yíng)養(yǎng)細(xì)胞rETR和qP均顯著高于雄性生殖細(xì)胞,NPQ則無(wú)顯著差異。
3 討論
葉綠素?zé)晒饧夹g(shù)在植物光合生理研究中已有廣泛的應(yīng)用,能夠客觀反映光合生物自身的光合特性及環(huán)境適應(yīng)能力[16-18]。通過(guò)葉綠素?zé)晒鉁y(cè)定方法中的快速光曲線(RLC)和誘導(dǎo)曲線的測(cè)定,可從多個(gè)角度研究樣品對(duì)光能的利用能力及對(duì)吸收光能的分配特征。本研究表明,壇紫菜雌、雄藻體營(yíng)養(yǎng)細(xì)胞葉綠素?zé)晒鈪?shù)間均無(wú)顯著差異,說(shuō)明無(wú)論是雌藻體還是雄藻體,其營(yíng)養(yǎng)細(xì)胞的光能實(shí)際利用效率、光合電子傳遞能力及對(duì)光強(qiáng)的適應(yīng)能力等較為一致。

表1 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞快速光曲線參數(shù)比較Tab.1 Compare of rapid light curve parameters between vegetative and germ cells of P.haitanensis

表2 營(yíng)養(yǎng)細(xì)胞與生殖細(xì)胞qP和NPQ比較Tab.2 Compare of induction curve parameters between vegetative and germ cells of P.haitanensis
盡管雌性生殖細(xì)胞結(jié)構(gòu)形態(tài)和藻體顏色上與營(yíng)養(yǎng)細(xì)胞存在差異,我們的試驗(yàn)結(jié)果表明二者的葉綠素?zé)晒馓卣鞑o(wú)明顯不同,雌藻體營(yíng)養(yǎng)細(xì)胞ΔF/Fm′和α、rETRmax和Ik等參數(shù)僅略高于雌性生殖細(xì)胞,但差別并沒(méi)有達(dá)到顯著水平,雄藻體營(yíng)養(yǎng)細(xì)胞與雌性生殖細(xì)胞的光合熒光參數(shù)同樣差異不顯著,這說(shuō)明雌性生殖細(xì)胞與雌、雄藻體營(yíng)養(yǎng)細(xì)胞光能利用能力相似。
光合色素的含量與細(xì)胞光合活性密切相關(guān),光合色素含量較高通常會(huì)使得細(xì)胞光能利用能力提高[19-21],這種聯(lián)系可能也是導(dǎo)致雄性生殖細(xì)胞葉綠素?zé)晒鈪?shù)與營(yíng)養(yǎng)細(xì)胞間顯著差異的重要原因,雄性生殖細(xì)胞對(duì)光能的利用能力明顯低于營(yíng)養(yǎng)細(xì)胞,且在給定光照條件下,雄性生殖細(xì)胞的實(shí)際量子效率也低于營(yíng)養(yǎng)細(xì)胞。雄性生殖細(xì)胞rETRmax顯著低于營(yíng)養(yǎng)細(xì)胞,而 Ik沒(méi)有明顯區(qū)別,這說(shuō)明在給定光照條件下,雄性生殖細(xì)胞相對(duì)電子傳遞速率較營(yíng)養(yǎng)細(xì)胞低,但二者對(duì)光照強(qiáng)度的適應(yīng)能力相似。上述結(jié)果與光合色素含量的研究相一致,即雄性生殖細(xì)胞色素較營(yíng)養(yǎng)細(xì)胞和雌性生殖細(xì)胞明顯淺淡,稍帶黃、白色,這種顏色的差異是因?yàn)榧?xì)胞間光合色素含量和比例的不同所引起的[22]。誘導(dǎo)曲線的測(cè)定結(jié)果表明,在給定活化光條件下,營(yíng)養(yǎng)細(xì)胞rETR和qP均顯著高于雄性生殖細(xì)胞,即雄性生殖細(xì)胞電子傳遞速率和光化學(xué)猝滅均處較低水平,其吸收的光能用于光合電子傳遞部分明顯低于營(yíng)養(yǎng)細(xì)胞。雄性生殖細(xì)胞NPQ與營(yíng)養(yǎng)細(xì)胞相似,該參數(shù)與光適應(yīng)能力相關(guān)。結(jié)合ΔF/Fm′、RLC和誘導(dǎo)曲線的測(cè)定結(jié)果,推知在不同光照強(qiáng)度下,雄性生殖細(xì)胞所吸收的光能用于光合電子傳遞所占比例明顯低于營(yíng)養(yǎng)細(xì)胞,而用于熱耗散的比例明顯高于營(yíng)養(yǎng)細(xì)胞,雄性生殖細(xì)胞的這種高熱耗散比例可能是其光適應(yīng)能力與營(yíng)養(yǎng)細(xì)胞相似的主要原因,通過(guò)提高將吸收的光能以熱耗散的形式消耗,從而適應(yīng)環(huán)境光照強(qiáng)度。
[1]王素娟,裴魯青,段德麟.中國(guó)常見(jiàn)海藻超微結(jié)構(gòu)[M].寧波: 寧波出版社,2004.
[2]Lin A P,Wang G C,Yang F,et al.Photosynthetic parameters of sexually different parts of Porphyra katadai var.hemiphylla (Bangiales,Rhodophyta)during dehydration and rehydration[J].Planta,2009,229: 803-810.
[3]Yang R L,Zhou W,Shen S D,et al.Morphological and photosynthetic variations in the process of spermatia formation from vegetative cells in Porphyra yezoensis Ueda (Bangiales,Rhodophyta)and their responses to desiccation [J].Planta,2012,135(5): 885-893.
[4]楊睿靈,喬洪金,周偉,等.條斑紫菜葉狀體不同區(qū)域光合活性的研究[J].海洋科學(xué),2011,8: 63-66.
[5]Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]// Schulze E D,Caldwell M M.Ecophysiology of Photosynthesis.Springer-Verlag,Berlin,1995: 49-70.
[6]張守仁.葉綠素?zé)晒鈩?dòng)力學(xué)參數(shù)的意義及討論[J].植物學(xué)通報(bào),1999,16: 444-448.
[7]Henley W J,Levavasseur G,Franklin L A,et al.Photoaccllimation and photoinhibition in Ulva rotundata as influenced by nitrogen availability [J].Planta,1991,184: 235-243.
[8]Hanelt D.Photoinhibition of photosynthesis in marine macrophytes of the South Chinese Sea [J].Mar Ecol Progr Ser,1992,82: 199-206.
[9]Herbert S K.Fluorescence characteristics of photoinhibition and recovery in a sun and shade species of the red algal genus Porphyra[J].Plant Physiol,1988,86:946- 951.0
[10]Zhang T,Shen Z,Xu P,et al.Analysis of photosynthetic pigments and chlorophyll fluorescence characteristics of different strains of Porphyra yezoensis[J].J Appl Phycol,2011,DOI 10.1007/s10811-011-9708-x.
[11]張濤,沈宗根,姚春燕,等.基于葉綠素?zé)晒饧夹g(shù)的紫菜光適應(yīng)特征研究[J].海洋學(xué)報(bào),2011,33:140-147.
[12]姚春燕,張濤,姜紅霞,等.條斑紫菜不同品系藻體光合色素及葉綠素?zé)晒鈪?shù)比較[J].南京師大學(xué)報(bào)(自然科學(xué)版),2010,33(2): 81-86.
[13]趙小波,張學(xué)成,許璞.不同品系條斑紫菜光合效率比較研究[J].中國(guó)海洋大學(xué)學(xué)報(bào)(自然科學(xué)版).2010,40(2): 57-62.
[14]Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]//Schulze E-D,Caldwell M M .Ecophysiology of Photosynthesis.Springer-Verlag,Berlin,1995: 49-70.
[15]韓博平,韓志國(guó),付翔.藻類光合作用機(jī)理與模型[M].北京: 科學(xué)出版社,2003: 59.
[16]張其德,盧從明,張啟峰,張世平.幾組雜交組合的雜交稻及其親本光合特性的比較研究[J].生物物理學(xué)報(bào),1996,12 (3): 511-516.
[17]Schreiber U.Pulse-amplitude (PAM)fluorometry and saturation pulse method[C]//Papageorgiou G G.Chlorophyll fluorescence: A Signature of Photosynthesis.Advances in Photosynthesis and Respiration Series,Kluwer Academic Publishers,Dordrecht,The Netherlands,2004: 100-125.
[18]White A J,Critcley C.Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus [J].Photosynth Res,1999,59: 63-72.
[19]周百成,武寶軒,曾呈奎,等.條斑紫菜的色素系統(tǒng)和光合作用的差異性[J].植物生物學(xué),1966,9:427-429.
[20]Li Y,Wang G,Xu P,et al.Induction and characterization of green pigmentation mutant in Porphyra yezoensis Ueda [J].Aquacult,2008,282: 117-123.
[21]潘光華.不同性別來(lái)源的半葉紫菜華北變種和壇紫菜的生長(zhǎng)發(fā)育以及生化特征比較[D].青島: 中國(guó)海洋大學(xué),2006.
[22]張學(xué)成,秦松,馬家海,等.海藻遺傳學(xué)[M].北京:中國(guó)農(nóng)業(yè)出版社,2004: 184-225.

