攀枝花預氧化鈦精礦的H2還原行為
危雪梅,魯雄剛,肖 瑋
(上海大學 上海市現代冶金與材料制備重點實驗室,上海 200072)
隨著鈦工業的發展,高品位的天然金紅石資源日趨枯竭,利用鈦鐵礦制取富鈦料的工藝越來越受到人們的關注[1?2]。目前,大規模應用的鈦鐵礦處理方法主要有電爐熔爐法、硫酸法和鹽酸浸出法[3?4]。其中鹽酸浸出法因為快速浸出、有效去除雜質、酸循環利用等優點逐漸成為攀枝花鈦鐵礦處理的主要工藝[5]。而鈦鐵礦的氧化?還原是鹽酸浸出工藝中的關鍵步驟。因此,研究鈦鐵礦的還原行為對于鈦鐵礦富集方法具有重要的意義。
由于固體碳還原需要高溫和較長時間,相比較而言,氫氣還原具有速率更快、還原更徹底并且產物不污染空氣的優勢。考慮到低碳經濟、節能減排的發展要求,氫氣或者富氫氣體還原越來越受到人們的重視[2,6]。煤還原攀枝花鈦鐵礦過程中形成M3O5(M=Ti,Fe, Mg等)和TinO2n?1等導致鐵離子活度降低的物相,同時雜質在未反應區域富集,阻礙了鈦鐵礦的進一步還原。因此,物相轉變和雜質的遷移過程是研究氫氣還原的重點[7]。
預氧化處理能提高還原的速率和產物的金屬化率[8?9]。因此,本文作者以攀枝花預氧化鈦精礦為研究對象,通過熱重恒溫實驗,采用X射線衍射、光學顯微鏡及和掃描電子顯微鏡等微觀測試手段,研究預氧化鈦精礦在 H2還原反應中的宏觀動力學以及還原過程中的物相轉變及顯微結構變化規律,探討預氧化鈦精礦的H2還原行為。
1 實驗
1.1 原料性能
實驗用預氧化鈦精礦為攀枝花鋼鐵公司的細粒浮選鈦精礦在850 ℃氧化30 min后的產物,其平均粒度為29 μm,主要化學成分及XRD譜分別見表1及圖1。可以判斷,預氧化鈦精礦中Fe2+全部氧化成Fe3+,主要化學成分為三價鐵板鈦礦(Fe2TiO5),同時還含有少量的赤鐵礦(Fe2O3)和金紅石(TiO2)相。還原氣體為99.99%的H2,保護氣體為99.99%的Ar。

表1 氧化鈦精礦的主要化學成分Table 1 Main chemical components of oxidized ilmenite(mass fraction, %)
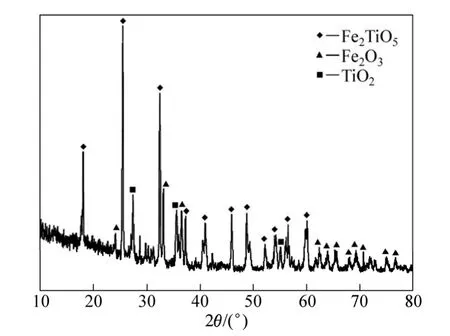
圖1 預氧化鈦精礦的XRD譜Fig. 1 XRD pattern of pre-oxidized ilmenite
1.2 研究方法
每次稱取1 000 mg樣品,置于Cahn Thermax700型大載荷熱重分析儀中,在Ar氣氛下,以10 ℃/min升溫速率快速升溫,達到設定溫度后切換成H2,恒溫還原至設定時間后,通 Ar保護冷卻,氣體流量均為100 mL/min,反應結束后取出樣品。根據熱重數據,計算還原過程的質量損失率和還原度,根據不同溫度和時間下還原度的變化規律,對宏觀動力學機理進行分析。 使用日產D/Max?2550型X射線衍射儀對還原產物的物相變化規律進行分析。 采用光學顯微鏡、HITACHI SU?1500型掃描電鏡對所得產品的顯微結構、形貌及元素遷移進行分析。
樣品質量損失率(Rm)主要是由于氧的質量損失,計算公式為

式中:m0為樣品還原前的質量,g;mt為樣品還原到t時刻的質量,g。
還原度(R)的計算公式為[6,10]

式中:m0為樣品還原前的質量,g;mt為樣品還原到t時刻的質量,g;Δm∞為還原過程中鐵氧化物全部被還原為金屬鐵的最大質量損失量,g。
2 結果與分析
2.1 等溫還原實驗
以H2為還原劑的等溫還原實驗中,不同還原溫度下質量損失率和還原時間的關系如圖2所示。 由圖2可以看出,當還原溫度從800 ℃提高到1 050 ℃時,質量損失率有大幅度增加。 當溫度由1 050 ℃提高到1 150 ℃時,開始階段質量損失率大幅提升,還原50 min后,溫度對質量損失率的影響減小;當還原溫度為1 000~1 150 ℃時,在還原反應的初期,質量損失率增加很快,還原50 min后,質量損失率隨著還原時間的延長增加緩慢,最終反應趨于平衡。當預氧化鈦精礦在1 100℃還原80 min后,質量損失率趨于穩定,達到12.06%。
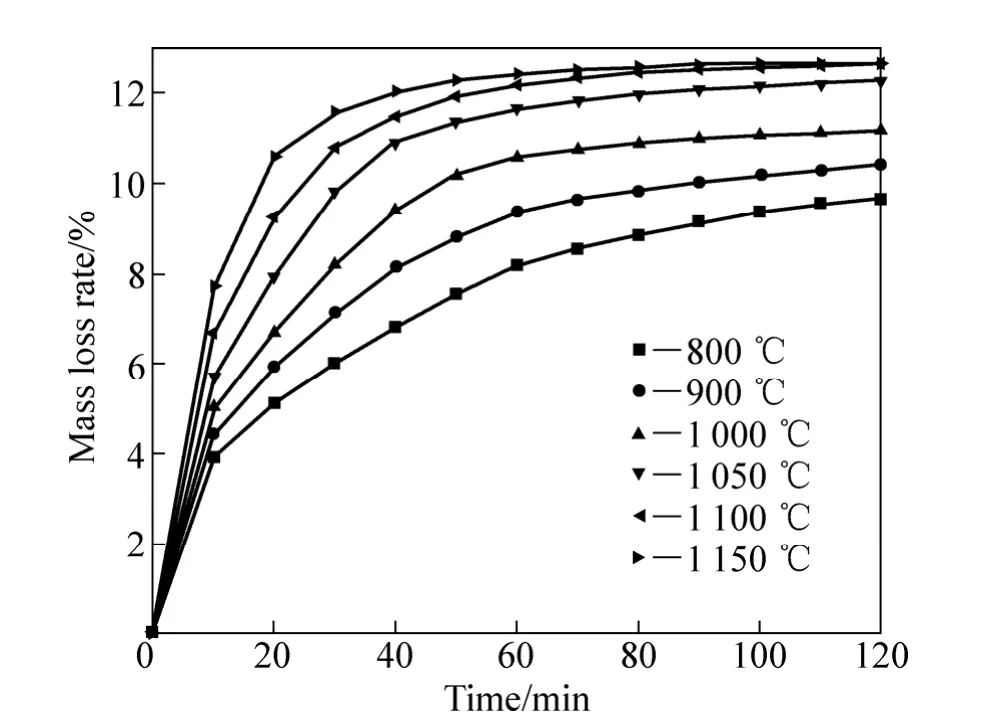
圖2 不同還原溫度下質量損失率與還原時間的關系Fig. 2 Relationship between mass loss rate and reduction time at different temperatures
通過式(2)計算出還原度R,結果如圖3所示。當還原溫度為1 000~1 150℃時,在還原反應的初期,還原度增加很快,還原50 min后,還原度隨著還原時間的延長增加緩慢。根據相關研究結果,預氧化鈦精礦的還原反應分兩步進行:第一步是 Fe3+→Fe2+反應,第二步是Fe2+→Fe反應。在反應開始階段,第一步反應和第二步反應同時進行,當還原進行到一定時間后只有第二步反應進行[10]。反應進行到后期,還原度增加緩慢,這與礦物中含有氧化鎂、氧化錳等雜質阻礙反應進一步還原有關[1]。當預氧化鈦精礦在1 100 ℃還原80 min后,還原度趨于穩定,達到96.04%。
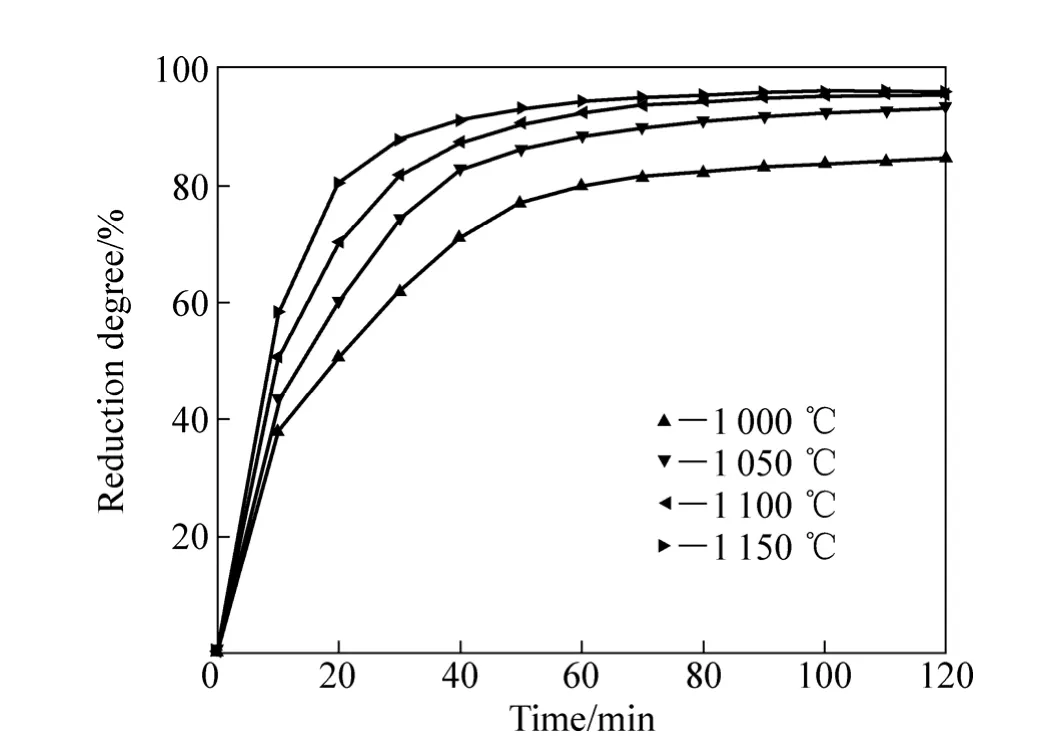
圖3 不同還原溫度下還原度與還原時間的關系Fig. 3 Relationship between reduction degree and reduction time at different temperatures
2.2 反應動力學
為查明H2還原氧化鈦精礦的反應控制環節,先將如圖3 所示的還原度R轉換成還原分數x(x=R/100%),然后用x與時間t的關系,分別以1?(1?x)1/3對時間t、1?2x/3?(1?x)2/3對時間t以及 1?2(1?x)2/3+(1?x)1/3對t/[1?(1?x)1/3]進行線性回歸。計算結果表明,在1 000~1 150 ℃,1?(1?x)1/3與t最符合線性關系,這表明在試驗溫度范圍內還原反應為界面化學反應控制。
根據Arrhenius方程:

式中:Ea為化學反應的活化能,J/mol;A為指數前系數;k為速率常數,min?1;R為摩爾氣體常數,其值為8.314 J/(mol·K);T為熱力學溫度,K。作關于lnk和1/T的線性回歸曲線,其線性擬合結果如圖4所示。所以Ea=11 456.7×8.314=95.25 kJ/mol。
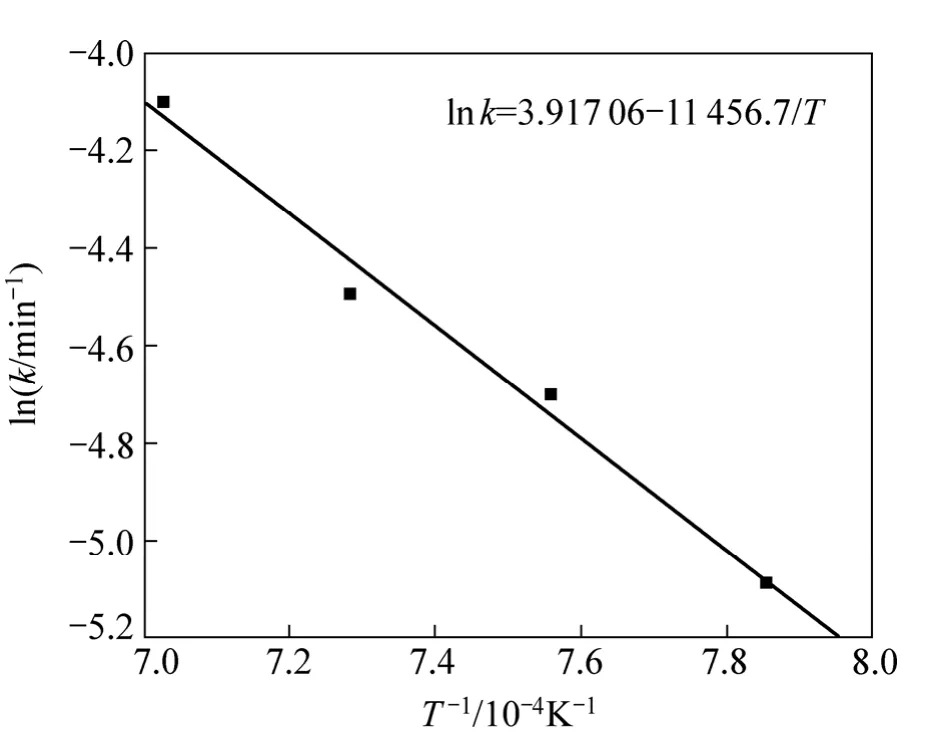
圖4 ln k和1/T的關系Fig. 4 Relationship between ln k and 1/T
2.3 熱力學計算
采用HSC軟件計算Fe2TiO5、Fe2O3和H2間發生反應的標準吉布斯自由能變化(ΔGΘ),結果如圖 5所示。圖中的序號對應于下列反應方程式:
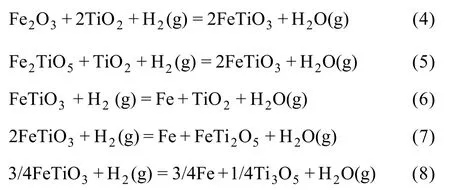
由標準吉布斯自由能變化曲線可以看出,Fe2TiO5和Fe2O3很容易被H2還原為FeTiO3;隨著溫度升高,FeTiO3還原反應的 ΔGΘ降低,生成金屬鐵、FeTi2O5和低價的鈦氧化物。
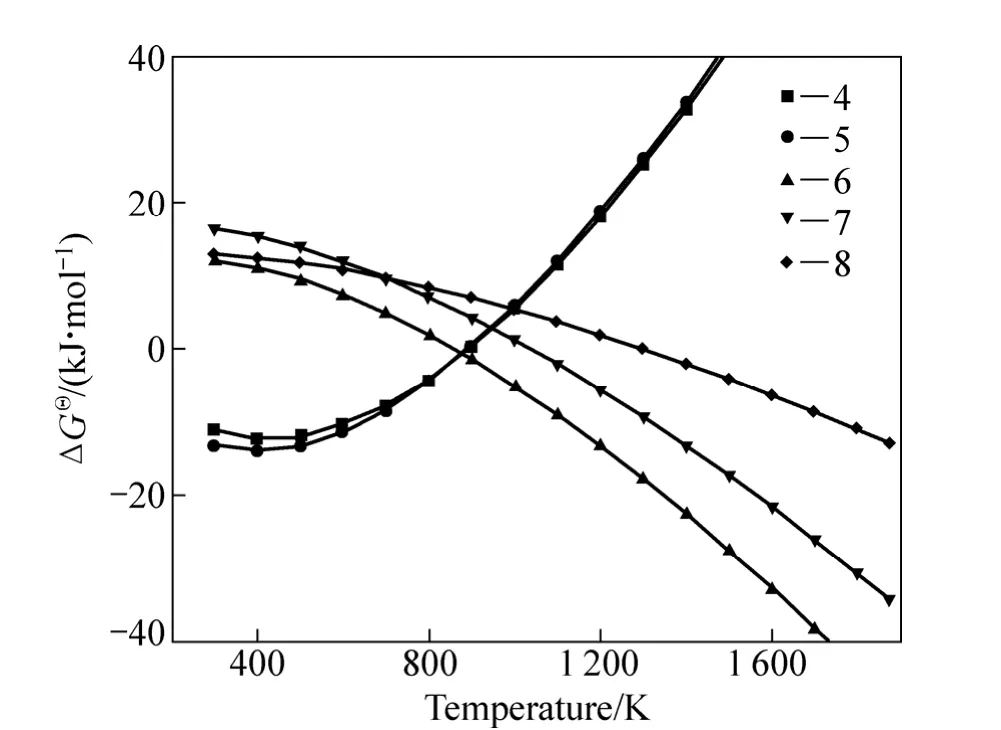
圖5 反應式(4) ~ (8)的 ΔGΘ和T的關系Fig. 5 Relationship between ΔGΘ and T for reactions (4)?(8)
2.4 預氧化鈦精礦還原過程的物相變化
為了解攀枝花預氧化鈦精礦還原過程中產物的物相變化規律,揭示預氧化鈦精礦還原反應歷程,采用XRD 測定預氧化鈦精礦還原前后的物相組成。 圖 6所示為預氧化鈦精礦利用 H2在不同溫度下恒溫還原80 min所得還原產物的XRD譜。
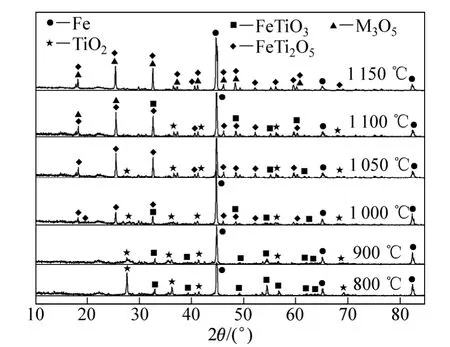
圖6 不同溫度下預氧化鈦精礦還原80 min產物的XRD譜Fig. 6 XRD patterns of products reduced for 80 min by hydrogen at different temperatures
由圖1可知,預氧化鈦精礦的主要化學成為三價鐵板鈦礦(Fe2TiO5),同時還含有少量的赤鐵礦(Fe2O3)和金紅石(TiO2)相。由圖6可以看出,在 800 ℃時,還原產物中 Fe2TiO5和 Fe2O3消失,出現了鈦鐵礦(FeTiO3)和金屬鐵相,由此可以推測預氧化鈦精礦還原過程中 Fe2TiO5和 Fe2O3全部轉化為 FeTiO3,即反應(4)和(5)反應完全,同時部分 FeTiO3還原成金屬鐵和TiO2,即發生了反應(6)。
當還原溫度為900 ℃時,金屬鐵的衍射峰增強,鈦鐵礦的衍射峰減弱,這是反應(6)進一步進行的結果。當溫度升高到1 000 ℃時,預氧化鈦精礦還原產物開始出現亞鐵板鈦礦(FeTi2O5),鈦鐵礦的衍射峰減弱,這是發生反應(7)的結果。當溫度繼續升高時,金屬鐵和亞鐵板鈦礦(FeTi2O5)的特征衍射峰繼續增強,而TiO2的特征衍射開始減弱。
當還原溫度為1 100 ℃時,在XRD 測定結果中檢測到FeTi2O5相中含有M3O5(M=Ti,Fe,Mg等)相;當溫度升高到1 150 ℃時,M3O5衍射峰增強。這是因為在反應(7)和(8)進行過程中,礦石中的MgO等雜質會固溶于FeTi2O5中,增加了FeTi2O5的穩定性,最終將形成固溶有 FeO、MgO、TiO2、Ti3O5等的M3O5(M=Ti,Fe,Mg等)型固溶體,尤其是在出現液相之后, M3O5型固溶體導致氧化物的活度變得越來越小,使得鐵氧化物的還原變得困難[3?4,7?8,11]。預氧化鈦精礦在1 100 ℃還原80 min后的產物主要為金屬鐵、TiO2和M3O5型固溶體。
2.5 預氧化鈦精礦還原產物的形態以及Mg的分布
以往的研究表明[7?8,12?15]:鈦精礦在固體碳還原反應過程中,MgO、MnO2等雜質的遷移行為對反應速率及進程有重要影響。試驗所用預氧化鈦精礦中 Mg含量高達6.06%,而Mn含量較低。為了揭示攀枝花預氧化鈦精礦氫氣還原的微觀機理,對預氧化鈦精礦還原產物的顯微結構及Mg、Fe和Ti的分布情況進行了分析。圖7(a)和(b)所示分別為攀枝花預氧化鈦精礦在1 100 ℃還原40 min和80 min后還原產物的金相顯微結構。
從圖 7(a)可見,還原產物顆粒幾乎都存在未反應內核,大顆粒金屬鐵主要分布在顆粒邊緣及孔隙處,微小蠕蟲狀金屬鐵鑲嵌于顆粒內部和邊緣。 從圖7(b)可見,還原產物仍有部分顆粒存在未反應的內核,金屬鐵粒子明顯增多,生成的金屬鐵粒子明顯增大,微小蠕蟲狀金屬鐵粒子由顆粒邊緣繼續向顆粒內部發展。

圖7 在1 100 ℃還原攀枝花氧化鈦精礦還原產物金相顯微結構Fig. 7 Microstructures of Panzhihua pre-oxidized ilmenite reduced at 1 100 ℃ for 40 min (a) and 80 min (b)
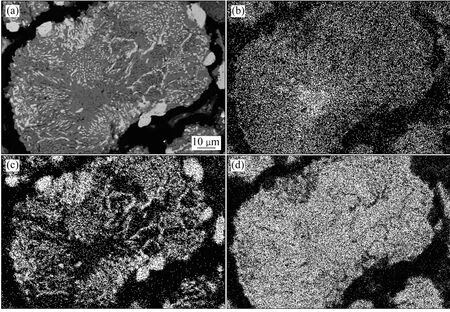
圖8 在1 100 ℃還原80 min后攀枝花預氧化鈦精礦還原產物的BSE像Fig. 8 BSE image (a) of Panzhihua pre-oxidized ilmenite reduced at 1 100 ℃ for 80 min, and surface distributions of elements Mg(b), Fe (c) and Ti (d)
通過掃描電鏡對預氧化鈦精礦在1 100 ℃還原80 min后還原產物的顯微結構及主要元素的面分布進行了研究,結果如圖8所示。從圖8背散射成像可以看出,攀枝花預氧化鈦精礦在1 100 ℃還原 80 min 后,還原產物中的顆粒內部出現了因金屬鐵的大量生成而形成的孔洞, Mg在未反應的內核出現富集現象。
由XRD譜可知,在1 100 ℃還原80 min后,攀枝花預氧化鈦精礦還原產物主要由金屬鐵、M3O5和TiO2組成。結合元素面分布(見圖 8(b)~(d))可知,圖8(a)中顆粒亮色部分主要是金屬鐵相,灰色部分主要是 M3O5和 TiO2相。以往的研究表明[7],少量的 Mn和Mg等雜質離子能使M3O5型連續固溶體穩定。攀枝花預氧化鈦精礦還原過程中Mg的這種富集現象,必將會在未反應內核處形成大量穩定的 M3O5型固溶體,從而使得鐵氧化物的活度降低,還原反應速率降低。
3 結論
1) 攀枝花預氧化鈦精礦在1 100 ℃還原80 min后還原度達到96.04%,在1 000~1 150 ℃溫度范圍內,預氧化鈦精礦的還原過程受界面化學反應控制,反應的表觀活化能為 95.25 kJ/mol。
2) 預氧化鈦精礦在還原過程中形成亞鐵板鈦礦(FeTi2O5),FeO、MgO、TiO2、Ti3O5等固溶于其中形成M3O5型(M=Fe,Ti,Mg等)固溶體,使得鐵離子活度降低,不利于預氧化鈦精礦的繼續還原。預氧化鈦精礦在1 100 ℃還原80 min后還原產物主要由金屬鐵、TiO2和M3O5型固溶體構成。
3) 預氧化鈦精礦還原產物顆粒金屬鐵粒子由顆粒邊緣向顆粒內部發展,顆粒內部出現因金屬鐵的大量生成而形成的孔洞。Mg 在未反應內核出現富集現象,阻礙了預氧化鈦精礦的進一步還原。
[1]WANG Yu-ming, YUAN Zhang-fu, GUO Zhan-cheng, TAN Qiang-qiang, LI Zhao-yi, JIANG Wei-zhong. Reduction mechanism of natural ilmenite with graphite[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(4)∶ 962?968.
[2]WANG Yu-ming, YUAN Zhan-fu, MATSUURA H,TSUKIHASHI F. Reductive extraction kinetics of titania and iron and ilmenite by H2-CO gas mixtures[J].ISIJ International,2009, 49(2)∶ 164?170.
[3]楊紹利, 盛繼孚. 鈦鐵礦熔煉鈦渣與生鐵技術[M]. 北京∶ 冶金工業出版社, 2006∶ 42?47.YANG Shao-li, JI Fu-sheng. Ilmenite smelting titanium slag and pig iron technology[M]. Beijing∶ Metallurgical Industry Press,2006∶ 42?47.
[4]鄧國珠. 鈦冶金[M]. 北京∶ 冶金工業出版社, 2010∶ 56?96.DENG Guo-zhu. Titanium metallurgy[M]. Beijing∶ Metallurgical Industry Press, 2010∶ 56?96.
[5]TAN Ping, HU Hui-ping, ZHANG Li. Effects of mechanical activation and oxidation-reduction on hydrochloric acid leaching of Panxi ilmenite concentration[J]. Transactions of Nonferrous Metals Society of China, 2011, 21∶ 1414?1421.
[6]SI Xing-guo, LU Xiong-gang, LI Chuang-wei, LI Chong-he,DING Wei-zhong. Phase transformation and reduction kinetics during the hydrogen reduction of ilmenite concentrate[J]. Journal of University of Science and Technology Beijing, 2012, 19(5)∶384?390.
[7]郭宇峰, 游 高, 姜 濤, 邱冠周. 攀枝花鈦鐵礦固態還原行為[J]. 中南大學學報∶ 自然科學版, 2010, 41(5)∶ 1639?1644.GUO Yu-feng, YOU Gao, JIANG Tao, QIU Guan-zhou.Solid-state reduction behavior of Panzhihua ilmenite[J]. Journal of Central South University∶ Science and Technology, 2010,41(5)∶ 1639?1644.
[8]郭宇峰, 呂亞男, 姜 濤, 邱冠周. 預氧化在攀枝花鈦鐵礦固態還原過程中的作用[J]. 北京科技大學學報, 2010, 32(4)∶413?419.GUO Yu-feng, Lü Ya-nan, JIANG Tao, QIU Guan-zhou. Effect of pre-oxidation on Panzhihua ilmenite in solid state reduction process[J]. Journal of University of Science and Technology Beijing, 2010, 32(4)∶ 413?419.
[9]肖 瑋, 魯雄剛, 危雪梅, 丁偉中. 鈦鐵礦預氧化的物相轉變及對氣基還原的影響[J]. 中國稀土學報, 2012, 30∶ 392?296.XIAO Wei, LU Xiong-gang, WEI Xue-mei, DING Wei-zhong.Phase Transitions of ilmenite preoxidation and effect on gaseous reduction[J]. Journal of Chinese Society of Rare Earths, 2012, 30∶392?296.
[10]SUN Kang, TAKASHI R, YAGI J. Reduction kinetics of cement-bonded natural ilmenite pellets with hydrogen[J]. ISIJ International, 1992, 32(4)∶ 496?504.
[11]PESL J, ERIC R H. High temperature carbothermic reduction of Fe2O3-TiO2-MxOyoxide mixtures[J]. Mineral Engineering, 2002,15 (11)∶ 971?984.
[12]WANG Yu-ming, YUAN Zhan-fu. Reductive kinetics of the reaction between a natural ilmenite and carbon[J]. International Journal of Minerals Processing, 2006, 81(3)∶ 133?140.
[13]MERK R, PICKLES C A. Reduction of ilmenite by carbon monoxide[J]. Canadian Metallurgical Quarterly, 1988, 27(3)∶179?185.
[14]SURESH K G, RAJAKUMAR V, GRIEVESON P. Kinetics of reduction of ilmenite with graphite at 1 000 to 1 100 ℃[J].Metallurgical Transactions B, 1987, 18(4)∶ 713?717.
[15]JONES D G. Optical microscopy and electron-probe microanalysis study of ilmenite reduction[J]. Transactions of the Institution of Mining and Metallurgy, 1974, 83∶ 1?9.

