綠竹花發育相關基因BoAP3的克隆與分析
朱龍飛,徐英武,林新春
(浙江農林大學 亞熱帶森林培育國家重點實驗室培育基地,浙江 臨安 311300)
MADS-box基因家族是一類轉錄因子,最先從酵母的轉錄因子MCM1、擬南芥Arabidopsis thaliana的AG基因、金魚草Antirrhinum majus的DEF(DEFICIEMNS)基因和人的轉錄因子SRF(SRF4)中鑒定出來,在決定植物開花時間和花形態建成中均起著非常重要的作用[1-3]。通過對擬南芥和金魚草的研究,Bowman等[4]提出了花器官發育的ABC模型,將同源異型基因分成A,B和C等3類。花器官的性質便是由這3類同源異型基因所決定。A類基因獨自作用形成萼片,A類和B類基因共同作用形成花瓣,B類和C類基因共同作用形成雄蕊,C類基因獨自作用形成雌蕊。APETALA3(AP3)/DEFICIENS(DEF)為植物花器官發育B類基因,調控植物雄蕊的發育[5],AP3及其同源基因根據其編碼的蛋白質C端一段特異序列的不同可以分為3個基因系:paleoAP3系,eu-AP3系和TM6系[6]。近年來,AP3同源基因在很多物種中都得到了相關報道[7],但在竹子中沒有這類報道。竹類植物是多年生植物,也是重要的經濟植物,竹子開花會造成竹林成片死亡的現象,對生態環境和社會經濟帶來很大的影響,因此,對竹子開花的研究具有十分重要的意義。本實驗以綠竹Bambusa oldhamii組培苗為實驗材料,利用cDNA末端快速擴增技術(RACE)技術獲得了BoAP3基因的cDNA全長,利用生物信息學對其進行了分析,同時也對其表達模式進行了分析,旨在為進一步研究竹類花發育的分子調控機制奠定基礎。
1 材料與方法
1.1 材料
綠竹花芽和營養芽分別來自浙江農林大學組培室繼代1周的開花試管苗和營養試管苗[8],長度為1 cm左右。采用Trizol法提取其總核糖核酸(RNA),-70℃保存備用。
1.2 綠竹AP3基因的克隆與序列分析
按照Reverse Transcription System(日本TAKARA公司)反轉錄試劑盒說明書合成花芽cDNA第1鏈。通過網絡搜索(http://www.ncbi.nlm.nih.gov/nucleotide/),根據禾本科Poaceae AP3-like同源基因序列由Primer 5.0設計一段保守序列引物,上游引物為5′-CGGGGATCATGAAG AAGGCG-3′,下游引物為5′-TCATACTGCTCGATCCATAG-3′,由中國上海生工生物工程技術有限公司合成。根據擴增的保守序列設計 RACE引物,3′RACE第 1輪引物為 5′-TGATATCTGTGCCTGGG CTG-3′,第 2輪引物為:5′-TAGGCTGGTCCCGATGCCCT-3′。 5′RACE 第 1 輪引物為 5′-CCATCATCATGTTCTCCTCC-3′, 第 2 輪引物為 5′-CGCACGGGGATCATGAAGAA-3′。根據RACE結果設計開放閱讀框(open reading frame,ORF)引物,上游引物為 5′-ATGGGGCGCGGCAAG-3′, 下游引物為 5′-TTAACCGAGGCGCAGGTCGC-3′。 聚合酶鏈式反應(PCR)擴增目的條帶采用凝膠回收試劑盒(中國上海生工)回收。將回收條帶插入pMD-20T載體(日本TAKARA公司),熱激法轉化DH5α(日本TAKARA公司),在氨芐青霉素平板上進行藍白斑篩選,挑取正向克隆,搖菌過夜,利用質粒提取試劑盒提取質粒,酶切鑒定送到中國上海生工生物工程服務有限公司測序。測序結果在美國國立生物技術信息中心(NCBI)網站上BLAST比對,用DNAMAN軟件進行序列氨基酸編輯(圖1),CLUSTAL軟件采用Neighbor-Joining(NJ)分析方法進行系統進化分析,在此基礎上用MEGA 4.0軟件構建系統進化樹。
1.3 綠竹BoAP3基因的定量表達分析
以提取的綠竹開花試管苗的花芽和不開花試管苗的營養芽為材料,提取總RNA,參照試劑說明書分別進行反轉錄,利用ABI-7500定量聚合酶鏈式反應(PCR)儀對綠竹上述部位AP3基因的表達進行定量分析。以綠竹Actin基因為內標,ABI-7500反應程序為:95℃預變性5 min;95℃變性 15 s,59℃退火 1 min,40個循環。Actin上游引物為5′-TGAGCTTCCTGATGGG CAAG-3′, 下游引物為 3′-CCTGATA TCCACGTCGCACTT-5′。 BoAP3上游引物為5′-GGAGGTTCGCCACAGGAA-3′, 下游引物為 5′-GCTCCTGCTGCAGGTTCT-3′。

圖1 BoAP3推定氨基酸序列Figure1 Putative amino acid sequence of BoAP3
2 結果與分析
2.1 BoAP3序列分析
以禾本科保守序列設計引物擴增得到了180 bp的片段,3′RACE擴增得到了750 bp的片段,5′RACE擴增得到了300 bp的片段,將5′RACE和3′RACE獲得的序列進行拼接,結果顯示:該cDNA全長為998 bp,含有1個完整的ORF序列,長度為654 bp。核苷酸序列比對結果發現,該序列為AP3同源基因,該基因與水稻Oryza sativa,小麥Triticum aestivum,玉米Zea mays等植物的AP3基因序列有很高的同源性。DNAMAN分析顯示,該片段編碼218個氨基酸,蛋白分子量約為25.04 kD,等電點為8.97。Blastp結果顯示:該蛋白屬于MADS-box家族,具有植物MADS-box蛋白典型的特征,其編碼肽鏈包含2個保守區(MADS盒和K區)和2個非保守區(I區和C區)(圖1),氨基酸序列與來自其他單子葉植物的某些MADS盒基因高度同源,與水稻OsMADS16,玉米silky1以及小麥WAP3一致性(identity)分別為83.54%,82.72%和82.30%,與擬南芥AP3的一致性為43.62%。在MADS盒和K區的氨基酸序列非常保守(圖 2)。在NCBI上查找已經克隆出來的11個不同物種的AP3同源基因,采用clustalx對這些基因作氨基酸序列比對,采用NJ法構建系統進化樹(mega 4.0)分析顯示,BoAP3與小麥AP3關系最近,其次為水稻AP3,與金魚草DEF同源基因進化關系最遠,序列分析表明BoAP3蛋白屬于pale-oAP3 系(圖 3)。

圖2 BoAP3與其他物種相關MADS區蛋白氨基酸序列比較Figure2 Amino acid sequence comparison of BoAP3 and the related MADS domain proteins of other species
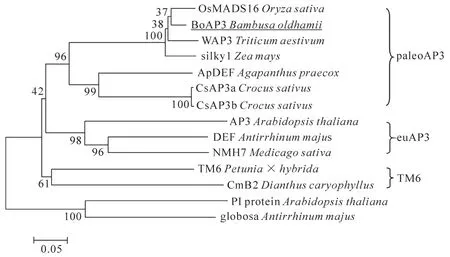
圖3 基于MADS盒基因氨基酸序列構建的系統樹分析Figure3 Phylogenetic analysis based on the amino acid sequence of MADS-box genes
2.2 BoAP3表達分析
2.2.1 標準曲線的制作 使用PCR產物作為模板,逐級稀釋10.0倍,做6個梯度,制作Actin和BoAP3的標準曲線。Actin和BoAP3的擴增曲線R2分別為1.000和0.998,表明模板重復性好,所采用的PCR體系和熱循環體系條件可以得到穩定的實驗結果。
2.2.2 BoAP3在花芽和營養芽中的表達水平 以同時繼代1周的開花試管苗的花芽和營養試管苗的營養芽cDNA為模板,以Actin為內參,研究 BoAP3基因在花芽和營養芽中的相對表達情況(圖4)。每個模板和引物組合做3個重復。每個引物和模板組合的Ct值的標準誤差較小,表明重復性好,且Actin和BoAP3引物擴增的Ct值均落在標準曲線Ct值的區間。定量結果表明:BoAP3在花芽的表達量明顯比營養芽高,是營養芽表達量的8.1倍。
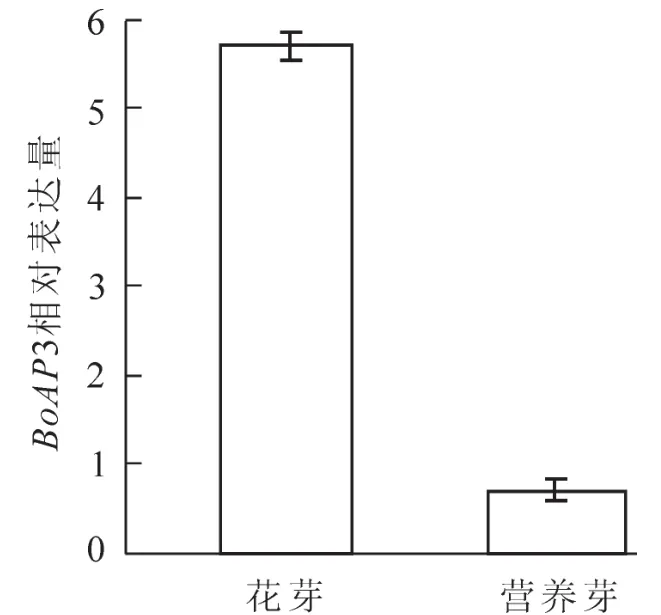
圖4 BoAP3基因在綠竹花芽和營養芽中的表達水平Figure4 Expression level of BoAP3 gene in flower buds and vegetative shoots of Bambusa oldhamii
3 結論與討論
為了探討MADS-box基因調節竹類花器官發育的作用,克隆得到綠竹中的AP3-like基因并命名為BoAP3,該基因具有MADS-box中B類基因的結構特征。依據基因C端序列的不同,AP3-like基因分為3個基因系,分別是paleoAP3系,eu-AP3系和TM6系。本研究中分離的BoAP3蛋白質序列與paleoAP3系最相近,具有paleoAP3基序(YGx-HDLRLA)[9-10](圖2),BoAP3與小麥、水稻等AP3-like同源基因所編碼的氨基酸同源性達到80%以上,且在系統進化樹上聚為一類。綜上所述,可以確定BoAP3是B類AP3-like基因。
到目前為止,已經從多個物種中克隆得到了花發育相關的B類基因(圖3),其表達模式有著顯著的差異。擬南芥中,AP3基因在花器官發育的第2輪和第3輪表達[11],而在金魚草中DEF基因在花器官發育4輪中都有表達,在非花組織不表達[12],玉米的silky1基因在花器官所有部位表達[13],熒光定量PCR結果可以看出,綠竹開花試管苗花芽的表達量是不開花試管苗營養芽表達量的8.1倍,這一結果表明BoAP3與花器官發育有密切關系。
[1]MANDEL M A, YANOFSKY M F.A gene triggering flower formation in Arabidopsis [J].Nature, 1998, 337:522-524.
[2]ROUNSLEY S D, DITTA G S, YANOFSKY M F.Diverse roles for MADS-box genes in Arabidopsis development[J].Plant Cell, 1995, 7:1259-1269.
[3]BECKER A,THEISSEN G.The major clades of MADS-box genes and their role in the development and evolution of flowering plants [J].Mol Phylogenet Evol, 2003, 29(3):464-489.
[4]BOWMAN J L, SMYTH D R, MEYEROWITZ E M.Genetic interactions among floral homeotic genes of Arabidopsis[J].Development, 1991, 112:1-20.
[5]WEIGEL D, MEYEROWITZ E M.The ABCs of floral homeotic genes:review [J].Cell, 1994, 78:203-209.
[6]GEMMA D M,IRVIN P,EYAL E, et al.Functional analyses of two tomato APETALA3 genes demonstrate diversification in their roles in regulating floral development[J].Plant Cell, 2006, 18:1833-1845.
[7]ZAHN L M,LEEBENS-MACK J,de PAMPHILIS C W,et al.To B or not to B a flower:the role of DEFICIENS and GLOBOSA orthologs in the evolution of the Angiosperms [J].J Heredity, 2005, 96(3):225-240.
[8]LIN Xinchun, HUANG Lichun, FANG Wei, et al.Understanding bamboo flowering based on large-scale analysis of expressed sequence tags [J].Gen Mol Res, 2010, 9(2):1085-1093.
[9]KRAMER E M, DORIT R L, IRISH V F.Molecular evolution of genes controlling petal and stamen Development:duplication and divergence within the APETALA3 and PISTILLATA MADS-box gene lineage [J].Genetics, 1998,149:765-783.
[10]YU Deyue, KOTILAINEN M, P?LL?NEN E, et al.Organ identity genes and modified patterns of flower development in Gerbera hybrida (Asteraceae) [J].Plant J, 1999, 17:51-62.
[11]JACK T, BROCKMAN L L, MEYEROWITZ E M.The homeotic gene APETALA3 of Arabidopsis thaliana encodes a MADS-box and is expressed in petals and stamens [J].Cell, 1992, 68(4):683-697.
[12]SOMMER H, BELTRAN J P, HUIJSER P, et al.Deficiens, a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus:the protein shows homology to transcription factors [J].EMBO J, 1990, 9(3):605-613.
[13]AMBROSE B A, LERNER D R, CICERI P, et al.Molecular and genetic analyses of the Silky1 gene reveal conservation in floral organ specification between eudicots and monocots [J].Mol Cell, 2000, 5(3):569-579.
[14]徐小雁,田敏,王彩霞,等.文心蘭花發育相關基因OAP3的克隆與表達分析[J].浙江農林大學學報,2011,28(6): 900-906.XU Xiaoyan, TIAN Min, WANG Caixia, et al.Cloning and expression analysis of a flowering-related gene,OAP3, in Oncidium [J].J Zhejiang A & F Univ, 2011, 28(6):900-906.

