碳源對圓酵母(Torula sp.)B84512發酵合成赤蘚糖醇及副產物甘油的影響*
高慧,竇文芳,陸茂林,許正宏,史勁松
1(江南大學藥學院,江蘇 無錫,214122)2(江蘇省微生物研究所,江蘇 無錫,214063)
赤蘚糖醇(1,2,3,4-丁四醇),分子式為 C4H10O4,相對分子質量為122.12。自然界中如海藻、蘑菇等、水果類、發酵食品、微生物中都廣泛存在,由于其口感清涼,且具有低熱量、低吸濕性及高耐受性[1-2]等特點,成為較受追捧的21世紀功能性食品添加劑。
國際上均采用微生物發酵法大批量生產赤蘚糖醇[3-4],葡萄糖、蔗糖、果糖是主要碳源[5]。耐高滲酵母在耗氧條件下以葡萄糖或蔗糖等為碳源時主要通過HMP途徑生成赤蘚糖醇[6-7],即通過磷酸戊糖途徑和糖酵解途徑產生足夠的還原力,生成大量的赤蘚糖-4-磷酸,而后在赤蘚糖還原酶的作用下脫磷酸生成赤蘚糖醇。代謝途徑如圖1所示,在該途徑中亦可以通過1,6-二磷酸果糖轉化為甘油,同時研究表明,甘油也是生產赤蘚糖醇的良好碳源。Waldemar Rymowicz等人[8]以甘油為碳源,發酵7天赤蘚糖醇的產量為170 g/L,產率為1 g/(L·h)。以甘油為碳源合成赤蘚糖醇的主要代謝途徑是在甘油激酶(Gut1p)作用下催化甘油生成3-磷酸甘油(G3P),再在線粒體中依賴FAD+的3-磷酸甘油脫氫酶(mtGPD)的催化下還原生成磷酸二羥丙酮(DHAP)。磷酸二羥丙酮在磷酸丙糖異構酶(pPI)的作用下異構化為3-磷酸甘油醛(GA3P)。3-磷酸甘油醛和果糖-1,6-二磷酸相互作用又可以生成木酮糖-5-磷酸和赤蘚糖-4-磷酸[9-11],繼而脫磷酸生成赤蘚糖醇。
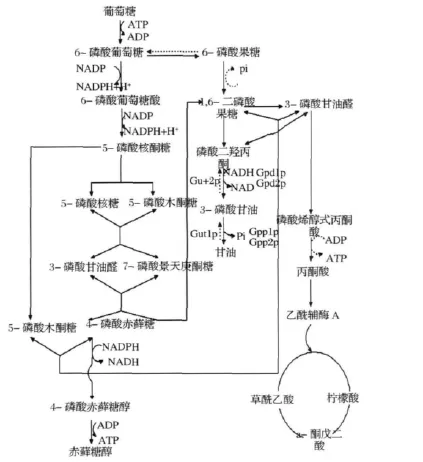
圖1 酵母體內赤蘚糖醇代謝途徑Fig.1 The metabolic of erythritol in yeast
江蘇省微生物研究所吳燕、楊曉偉等人[12]從土壤中篩選出1株產赤蘚糖醇的耐高滲菌株圓酵母B84512,并對其發酵過程培養基及培養條件進行了優化,但只針對不同糖濃度進行了研究,未涉及不同碳源對赤蘚糖醇合成的影響。本文在前期研究的基礎上,探討圓酵母B84512利用不同碳源及在補料發酵生成赤蘚糖醇的過程中主要副產物甘油的生成情況。通過對甘油生成與消耗代謝過程中關鍵酶酶活分析,旨在闡明圓酵母B84512內甘油生成途徑,為甘油途徑基因敲除奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌株
圓酵母(Torula)B84512,由江蘇省微生物研究所篩選。
1.1.2 試劑
赤蘚糖醇標準品、磷酸二羥丙酮(DHAP)、DL-α-磷酸甘油為sigma公司標準品,其他均為分析純試劑。
1.1.3 培養基
種子培養基:葡萄糖20%,酵母粉1%,尿素0.1%,CuSO4·5H2O 0.001%,MnSO4·H2O 0.001%,pH 6.0。
固體斜面培養基加2%瓊脂粉。
補料分批發酵培養基:葡萄糖 30%,酵母粉1%,尿素 0.1%,CuSO4·5H2O 0.001%,MnSO4·H2O 0.001%,pH 6.0。當糖降至20%左右時補加80%葡萄糖至總糖濃度達到40%、50%及60%。
1.2 實驗方法
1.2.1 菌體培養
將甘油管保藏菌株接種于10 mL YPD培養基中,往復式搖床30℃,200 r/min培養2 d后,用接種環挑取,1環菌液在斜面培養基中劃線,30℃培養箱恒溫培養3 d。挑取新鮮斜面菌株接種于10 mL種子培養基中,30℃,200 r/min培養2 d后轉接至二級種子培養基,繼續培養1 d后即可用于后續的發酵試驗。
1.2.2 不同碳源發酵對赤蘚糖醇及甘油的影響
分別以蔗糖、果糖、山梨醇、葡萄糖和甘油為碳源,按照1.2.1的培養方法進行菌體培養,發酵過程每隔10 h取樣,測定菌濃、殘糖以及赤蘚糖醇和甘油的量。
1.2.3 甘油和葡萄糖對圓酵母B84512合成赤蘚糖醇及甘油的影響
以初始濃度為30%的甘油為碳源發酵產赤蘚糖醇,按照1.2.1的培養方法進行菌體培養,測定甘油的消耗情況和赤蘚糖醇的生成情況,并與葡萄糖為碳源時進行比較。
1.2.4 發酵過程補加葡萄糖及補料終濃度對赤蘚糖醇的影響
以初始濃度為30%葡萄糖為碳源,按照1.2.1的方法培養菌體,當葡萄糖濃度降至20%左右補加濃度為80%的葡萄糖使總糖分別達到40%、50%及60%。發酵過程中定時取樣,考察對赤蘚糖醇產量的影響及副產物甘油的變化情況。
1.2.5 用于酶活測定細胞粗提物的制備
發酵液樣品12 000 r/min,4℃,離心10 min收集菌體,用預冷的滲透壓相同的破壁緩沖液洗滌1次,再重懸于破壁緩沖液(100 mmol/L pH7.5磷酸鹽緩沖液,含 1 mmol/L DTT,2 mmol/L MgCl2)中,稱取等量的濕菌體按質量比為(1∶8)~(1∶10)的比例用破壁緩沖液懸浮,4℃超聲破碎(工作3 s,間隔6 s)2 h,未破碎的細胞于4℃,10 000 r/min離心20 min去除,上清液即為用于酶活測定的粗酶提取物。
1.2.6 胞漿3-磷酸甘油脫氫酶酶活測定
反應體系包括20 mmol/L、pH 7.0咪唑-HCl緩沖液、1mmol/L DTT、1mmol/L MgCl2、0.09 mmol/L NADH和0.67 mmol/L DHAP組成,30℃反應1 min后,以加入DHAP為0時,線性范圍為5 min,340 nm處測定30 s和120 s時吸光度。定義:30℃下1 min消耗1 μmol/L NADH所需的酶量為1個酶活單位(U)。
1.2.7 3-磷酸甘油酯酶酶活測定
取酶液50 μL加入0.2 mol/L DL-α磷酸甘油10 μL,1 mol/L、pH 7.0 咪唑 10 μL,0.25 mol/L MgCl210 μL,再加入 20 μL 超純水,使總體積為 0.1 mL。30℃水浴反應至所需時間后加入2 mL 5%三氯乙酸終止反應,振蕩并于10 000 r/min離心10 min,取上清液測定無機磷含量。在30℃,pH 7.0條件下,每分鐘催化3-磷酸甘油生成1 μmol磷酸根所需的酶量為1個酶活單位(U)。
1.2.8 線粒體3-磷酸甘油脫氫酶酶活測定
反應體系組成為:0.5 mol/L、pH 7.6 Tris,0.05 mol/L DL-α-磷酸甘油,1 mg/mL MTT,1 mg/mL PMS。酶促反應溫度為30℃。在550 nm處測定MTT還原產物,用8.1×103M-1cm-1摩爾消光系數來計算底物轉化速率。將1 min還原1 μmol MTT定義為1個酶活單位(U)。
1.3 分析方法
1.3.1 發酵液中赤蘚糖醇和甘油的HPLC測定
色譜條件:色譜柱為Alltech Prevail Carbohydrate ES(4.6 mm × 250 mm,5 μm),流動相為乙腈∶水(75∶25);流速為1.0 mL/min;RI 2000型示差折光檢測器;柱溫為30℃。
1.3.2 發酵液中葡萄糖的測定
3,5-二硝基水楊酸法。
1.3.3 菌體生物量測定
將樣品稀釋至合適濃度后在600 nm處測定紫外吸收值。
2 結果與討論
2.1 不同碳源發酵對赤蘚糖醇和甘油產量的影響
如圖2-A所示,葡萄糖為碳源,赤蘚糖醇產量最高,為115 g/L;其次為果糖和蔗糖,赤蘚糖醇產量為83 g/L和71 g/L;以山梨醇為碳源,赤蘚糖醇產量最低,僅為28 g/L。此外,發酵過程中都伴隨著副產物甘油的產生。從圖2-B可以看出,發酵初期至中期甘油不斷積聚,以葡萄糖和果糖為碳源時,甘油的產量最高,分別達到54 g/L和52 g/L;以蔗糖、山梨醇及甘露糖為碳源時,甘油的產量較少,分別為22 g/L、21 g/L及25 g/L。可以看出,葡萄糖為圓酵母B84512發酵產赤蘚糖醇的最適碳源,蔗糖、果糖次之,山梨醇最差。但任何碳源在發酵過程中均會產生甘油,且在發酵中后期甘油逐漸被消耗,推測甘油極有可能被作為碳源用于合成赤蘚糖醇,故研究圓酵母B84512發酵生成赤蘚糖醇的過程中甘油的生成情況十分必要。
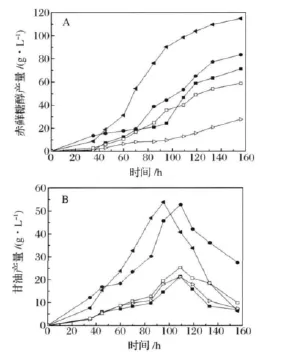
圖2 不同碳源對圓酵母B84512發酵產赤蘚糖醇及甘油影響Fig.2 The production of erythritol and glycerol with different carbon hydrate
2.2 甘油和葡萄糖對圓酵母B84512合成赤蘚糖醇及甘油的影響
在上述研究的基礎上,比較了甘油和葡萄糖作為碳源對圓酵母B84512發酵生成赤蘚糖醇的影響。從表1可以看出,以甘油為碳源時碳源的消耗速率及赤蘚糖醇的生成速率分別為1.58 g/(L·h)和0.61 g/(L·h),而以葡萄糖為碳源時碳源消耗速率為3.33 g/(L·h),赤蘚糖醇的生成速率為0.96 g/(L·h)。且以葡萄糖為碳源時赤蘚糖醇的得率也較甘油高。因此,圓酵母B84512以葡萄糖為碳源合成赤蘚糖醇的效率明顯優于甘油。
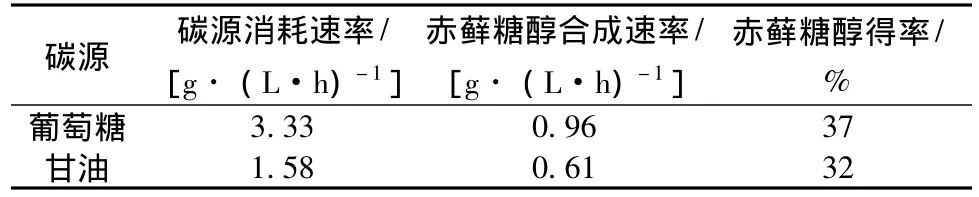
表1 甘油和葡萄糖為碳源對圓酵母B84512發酵產赤蘚糖醇情況比較Table 1 Comparison of erythritol fermentation performance by different carbon sources such as glycerol and glucose
2.3 葡萄糖補加對圓酵母B84512合成赤蘚糖醇及甘油的影響
以前期研究為基礎,嘗試通過發酵過程中補加葡萄糖,以增加赤蘚糖醇的產量并減少主要代謝副產物甘油的生成。控制分批補料發酵的初始葡萄糖濃度為30%,當葡萄糖濃度降低至20%左右補加葡萄糖,補料至不同終糖濃度發酵過程比較如圖3所示(包括葡萄糖消耗、菌濃、赤蘚糖醇生成及甘油變化)。總糖為40%時發酵250 h赤蘚糖醇的產量達到225 g/L,產率為0.9 g/(L·h)。終糖濃度為50%時發酵260 h赤蘚糖醇的產量提高到了253 g/L,產率為1.03 g/(L·h)。而補加葡萄糖至終濃度為60%是赤蘚糖醇產量僅為230 g/L,產率為0.85 g/(L·h)(圖3-A中箭頭所指方向為流加葡萄糖點)。
發酵過程中補料并不能抑制甘油的生成,反而與葡萄糖濃度呈正相關。葡萄糖終濃度為40%時甘油的產量最高可達到102 g/L,葡萄糖終濃度為50%和60%時甘油產量分別達到145 g/L和189 g/L。但如圖D所示,發酵中后期葡萄糖被消耗完,甘油量逐步降低,赤蘚糖醇產量持續增長。以甘油為碳源合成赤蘚糖醇的速率較分別為0.86 g/(L·h)、0.95 g/(L·h)和0.73 g/(L·h),均低于以葡萄糖為碳源時赤蘚糖醇的合成速率。此外,由于甘油的合成及分解代謝導致發酵周期延長,因此必須阻斷甘油合成途徑的關鍵酶以提高赤蘚糖醇的產率。
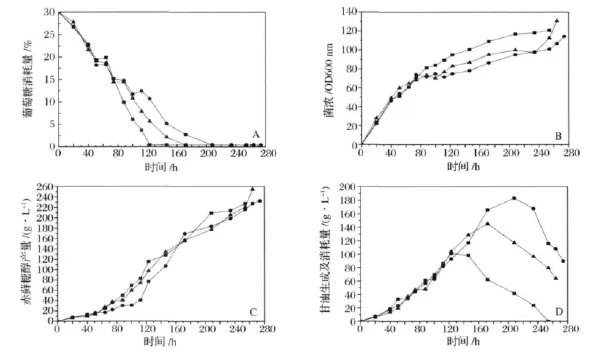
圖3 不同補料終濃度對圓酵母B84512發酵產赤蘚糖醇及甘油過程比較Fig.3 Comparison of erythritol fermentation performance by feding-batch glucose to different concentration
2.4 發酵過程中胞漿3-磷酸甘油脫氫酶、3-磷酸甘油酯酶和線粒體3-磷酸甘油脫氫酶酶活表征
通過測定胞漿3-磷酸甘油脫氫酶、3-磷酸甘油酯酶和線粒體3-磷酸甘油脫氫酶酶活以確定甘油合成途徑關鍵酶,以驗證文獻報道[11]的甘油合成及分解途徑是否適用于圓酵母B84512。從表2可以看出,在整個甘油發酵過程中,圓酵母B84512皆具有較高的ctGPD酶活并在80 h時出現酶活峰值;發酵過程中80 h內一直積累甘油,100 h后甘油開始消耗,ctGPD也進入低水平階段。而在80 h內,GPP的酶活一直處于高水平,也在80 h出現峰值。這一特征與圓酵母B84512以最高速率積累甘油在時間上吻合。在發酵過程中細胞中的GPP活性遠高于ctGPD,顯然,在由葡萄糖分解形成磷酸二羥丙酮,再在ctGPD的催化下還原為3-磷酸甘油,而后在GPP的催化下水解生成甘油的代謝途徑中,ctGPD成為圓酵母B84512甘油合成的限速酶,ctGPD的活力水平決定了甘油的合成和積累水平。
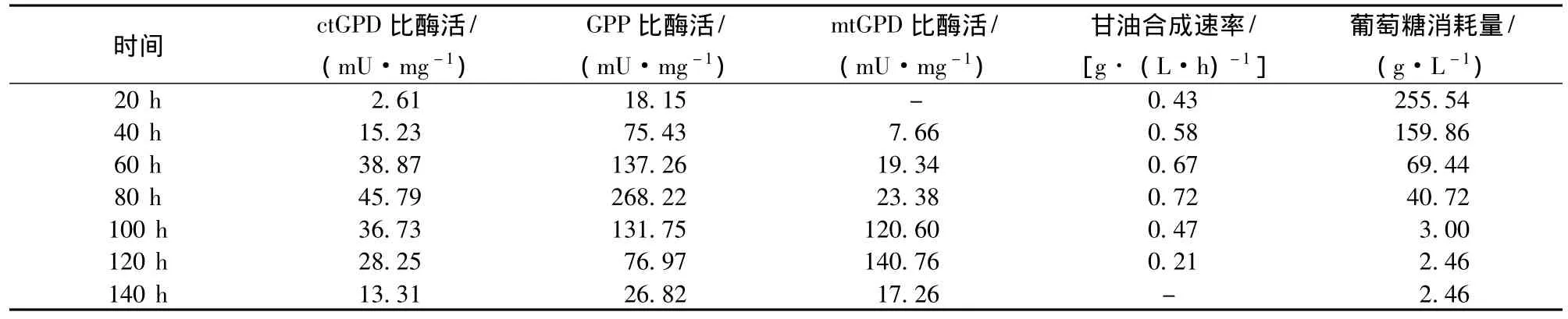
表2 甘油合成與消耗關鍵酶活力與甘油生成消耗速率及葡萄糖消耗關系Table 2 Specific activities of key enzyme and specific rate of glycerol and glucose formation and consumption in Torula sp.B84512
從表2可以看出,圓酵母B84512在甘油發酵的早期及中期幾乎無mtGPD酶活或酶活很低,糖濃度降至40 g/L以下mtGPD酶活迅速增加,此時mtGPD開始被誘導。隨著mtGPD的誘導,發酵液中的甘油含量開始下降,到發酵末期甘油消耗完畢,mtGPD酶活已經很低。mtGPD在葡萄糖存在時受到葡萄糖代謝過程中1,6-二磷酸果糖的抑制,而甘油則能誘導它的表達。100 h mtGPD酶活增加說明甘油開始大量向磷酸二羥丙酮方向生成,繼而生成赤蘚糖醇。
3 討論
對圓酵母B84512的發酵過程研究結果如下:葡萄糖是產赤蘚糖醇的最佳碳源。發酵過程中補加葡萄糖至終濃度為50%,赤蘚糖醇的產量最高,發酵260 h赤蘚糖醇的產量為253 g/L,產率為1.03 g/(L·h)。此外,發酵過程中伴隨著副產物甘油的生成,通過對甘油合成代謝及分解代謝過程中關鍵酶包括胞漿3-磷酸甘油脫氫酶、3-磷酸甘油酯酶和線粒體3-磷酸甘油脫氫酶酶活分析,發現發酵80 h內ctGPD及Gpp酶活持續增加且均在80 h達到峰值,這與80 h時甘油達到最高積累速率相符合。而在80 h內mtGPD酶活一直較低,受到1,6-二磷酸果糖的抑制,直到葡萄糖濃度降至40 g/L時才被甘油誘導。甘油在甘油激酶及線粒體3-磷酸甘油脫氫酶的作用下生成磷酸二羥丙酮,而后生成赤蘚糖醇。
雖然甘油可以再次分解生成赤蘚糖醇,但大大地延長了發酵時間,這在工業生產中是不經濟的。在合成甘油的代謝支路中,胞漿3-磷酸甘油脫氫酶(ctGPD)是合成途徑中關鍵酶。因此,下一步計劃對該酶進行基因敲除,減弱向甘油合成途徑的流量,縮短發酵周期,增加赤蘚糖醇的生成速率。
[1] Munro I C,Bemt W O,Borzelleca J F,et al.Erythritol:An interpretive summary of biochemical,metabolic,toxicological and clinical data [J].Food Chem Toxicology,1998,36(12):1 139-1 174.
[2] Braun M L,Niederpruem D J.Erythritol metabolism in wild-type and mutant strains of Schizophyllum commune[J].Journal of Bacteriology,1969,100(2):625-634.
[3] Kim K A,Noh B S,Lee J K.Optimization of culture conditions for erythritol production by Torula sp.[J].Journal of Microbiology and Biotechnology,2000,10(1):69 -74.
[4] Ryu Y W,Park C Y,Park J B.Optimization of erythritol production by Candida magnoliae in fed-batch culture[J].Journal ofIndustrialMicrobiology and Biotechnology,2000,25(2):100 -103.
[5] 范光先,張海平,諸葛健.耐高滲酵母產赤蘚糖醇的影響因素[J].無錫輕工大學學報,2001,20(2):133 -136,141.
[6] 葉嫻,董海洲.微生物發酵法生產赤蘚糖醇的研究[J].食品與藥品,2007,9(4):38 -39.
[7] Moon H J,Jeya M,Kim I W,et al.Biotechnological production of erythritol and its applications[J].Appl Microbiol Biotechnol,2010,86(4):1 017 -1 025.
[8] Rymowicz W,Rywińska A,Marcinkiewicz M.High-yield production of erythritol from raw glycerol in fed-batch cultures of Yarrowia lipolytica[J].Biotechnology Letters,2009,31(3):377 -380.
[9] 王正祥.產甘油假絲酵母過量合成甘油的機理[D].無錫:無錫輕工大學,1998.
[10] Wang Pin-Mei,Zheng Dao-qiong,Liu Tian-zhe,et al.The combination of glycerol metabolic engineering and drug resistance marker-aided genome shuffling to improve very-high-gravity fermentation performances of industrial Saccharomyces cerevisiae[J].Bioresource Technology,2012,108(3):203-210.
[11] Zhang Qing-rui,Xiu Zhi-long.Metabolic pathway analysis of glycerol metabolism in Klebsiella pneumoniae incorporating oxygen regulatory system[J].Biotechnology Progress,2009,25(1):103-115.
[12] 楊曉偉,吳燕,呂惠敏,等.赤蘚糖醇發酵工藝研究[J].生物技術,2005,15(4):63-65.

