橋本甲狀腺炎患者調節性T細胞的表達及其意義
楊治芳,吳 芳,湯佳珍,劉建英
橋本甲狀腺炎(HT)又稱慢性淋巴細胞性甲狀腺炎,是最常見的自身免疫性甲狀腺疾病之一,自身免疫損傷是本病導致甲狀腺功能減退(甲減)的主要機制。調節性T細胞(Treg)在阻止自身免疫反應、維持免疫耐受中發揮著重要作用[1],FOXP3是維持Treg發育和功能的關鍵轉錄因子[2]。本研究通過觀察不同甲狀腺功能狀況HT患者外周血Treg的表達,旨在探討HT的免疫學機制。
1 對象與方法
1.1研究對象選擇2010年10月—2012年10月我院內分泌科門診及住院部、甲狀腺外科住院部HT患者46例為病例組,年齡25~60歲,平均(40.9±11.2)歲;診斷標準:血清甲狀腺過氧化物酶抗體(TPO-Ab)和(或)甲狀腺球蛋白抗體(TGAb)水平明顯升高,甲狀腺外科手術后病理或細針穿刺涂片表現為淋巴細胞浸潤;根據患者甲狀腺激素水平分為甲狀腺功能正常組16例,亞臨床甲減組14例,臨床甲減組16例。選取同期在我院體檢的與病例組患者年齡、性別相匹配的健康人20例為對照組,年齡26~54歲,平均(39.4±7.5)歲。所有入選者無類風濕關節炎、系統性紅斑狼瘡、多發性硬化癥等自身免疫性疾病,近3個月內未服用過激素類藥物、免疫抑制劑等。
1.2主要試劑和儀器鼠抗人異硫氰酸熒光素(FITC)-CD4、別藻青蛋白(APC)-CD25、藻紅蛋白(PE)-FOXP3及同型對照單克隆熒光抗體、細胞固定劑與打孔劑均購自美國eBioscience公司;FACS Calibur流式細胞儀為BD公司生產。CD4+T細胞磁珠分離試劑盒購自Dynal公司。磁分離架為Dynal公司生產。Trizol購自Invitrogen公司,逆轉錄試劑盒購自Promega公司。熒光定量聚合酶鏈反應(PCR)儀為Bio-Rad公司生產。Sybe green定量PCR試劑盒購自Toyobo公司。
1.3方法
1.3.1外周血單個核細胞(PBMC)分離與收集獲得所有入選者知情同意及醫院倫理委員會批準后,抽取其外周靜脈血6 ml置于肝素抗凝管,2 ml置于血常規管;肝素抗凝管于采集后2 h內分離PBMC。Hank′s緩沖液稀釋外周血標本,密度梯度離心法收集PBMC,加1640完全培養基調整細胞數到2×106/ml。
1.3.2測定TregPBMC 1 ml加入5 μl FITC-CD4和5 μl APC-CD25單克隆熒光抗體,4 ℃避光20 min。磷酸鹽緩沖液(PBS緩沖液)洗滌后,加入固定/穿膜液400 μl,室溫避光40 min,PBS緩沖液洗滌后,加入緩沖液800 μl,室溫避光20 min。PBS緩沖液洗滌后,加入5 μl PE-FOXP3單克隆熒光抗體或同型對照PE-IgG1,4 ℃避光20 min,PBS緩沖液洗滌后,加入固定液100 μl,于1周內進行上機檢測。
1.3.3流式細胞檢測采用FACS Calibur型流式細胞儀進行檢測,WinMDI 2.9軟件進行分析。根據前向角和側向角圈定淋巴細胞群,設門,根據同型對照樣品調整熒光檢測器電壓,設定陰性細胞群≥99.5%,根據獨立細胞染色樣品調整儀器的熒光補償值。
1.3.4CD4+T細胞分離2 ml抗凝血中加入72 μl CD4磁珠,顛倒混勻2~3次,置低溫搖床內50 r/min混勻,4 ℃孵育30 min,置于磁分離架上2~3 min,棄上清液,用PBS緩沖液或2%胎牛血清(FCS)緩沖液洗滌4~5次,重懸于1 ml Trizol,-70 ℃保存,用于提取總RNA。
1.3.5CD4+T細胞FOXP3 mRNA的表達(1)提取總RNA:按照說明書方法提取,用紫外或可見光分光光度儀檢測總RNA的A260、A280濃度及A260/A280。(2)cDNA的合成:取1 μg RNA置于薄壁管,70 ℃變性10 min。依次加入10×逆轉錄反應緩沖液2 μl,25 mmol/L MgCl22 μl,脫氧核糖核苷三磷酸(dNTP)2 μl,寡脫氧胸苷酸(oligo-dT)1 μl,RNA酶抑制劑(RNasin)0.5 μl,鳥類成髓細胞白血病病毒(AMV)逆轉錄酶0.625 μl,加入去RNA酶水使終反應體積為20 μl,42 ℃ 60 min,95 ℃ 5 min,4 ℃冰浴(以上均在PCR儀完成)。所得cDNA放置于-20 ℃保存。(3)Sybe green熒光定量PCR:引物序列:FOXP3:上游5′-CAAGTTCCACAACATGCGAC-3′,下游5′-ATTGAGTGTCCGCTGCTTCT-3′,擴增長度91 bp。甘油醛-3-磷酸脫氫酶(GAPDH):上游5′-CCACATCGCTCAGACACCAT-3′,下游5′-GGCAACAATATCCACTTTA CCAGAGT-3′,擴增長度101 bp。反應條件:94 ℃ 20 s,60 ℃ 25 s,72 ℃ 30 s。均設3個復管,以GAPDH作為內參照,FOXP3 mRNA與GAPDH mRNA比值為其相對表達量。
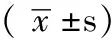
2 結果
2.1不同甲狀腺功能狀況HT患者臨床特征甲狀腺功能正常組、亞臨床甲減組、臨床甲減組患者的性別、年齡、體質指數(BMI)、TGAb、TPO-Ab水平比較,差異均無統計學意義(P>0.05);游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)、促甲狀腺激素(TSH)水平比較,差異均有統計學意義(P<0.05,見表1)。
2.2Treg占CD4+T細胞比例對照組Treg占CD4+T細胞比例為(4.67±1.21)%,病例組為(2.78±1.32)%,病例組Treg占CD4+T細胞比例低于對照組,差異有統計學意義(t=3.85,P<0.01);甲狀腺功能正常組、亞臨床甲減組、臨床甲減組Treg占CD4+T細胞比例比較,差異無統計學意義(P>0.05,見表1)。

表1 不同甲狀腺功能狀況HT患者臨床特征比較
注:*為χ2值;BMI=體質指數,FT3=游離三碘甲狀腺原氨酸,FT4=游離甲狀腺素,TSH=促甲狀腺激素,TGAb=甲狀腺球蛋白抗體,TPO-Ab=甲狀腺過氧化物酶抗體
2.3相關性分析Pearson相關分析結果顯示,Treg的表達與患者年齡(r=-0.242)、TPO-Ab水平(r=-0.268)呈負相關(P<0.05),而與患者性別(r=0.111)、BMI(r=0.004)、TGAb(r=0.149)水平無直線相關性(P>0.05)。
2.4CD4+T細胞FOXP3 mRNA的表達磁珠分離的CD4+T細胞經流式細胞儀檢測鑒定,純度達95%以上。對照組CD4+T細胞FOXP3 mRNA的相對表達量為(5.08±1.87),病例組(抽取20例)為(3.59±0.37),病例組CD4+T細胞FOXP3 mRNA表達水平低于對照組,差異有統計學意義(t=2.65,P<0.05)。
3 討論
HT是器官特異性自身免疫疾病,臨床表現差異較大,由于其在疾病早期無特殊臨床表現,往往發展為臨床甲減才被發現。臨床工作中主要依據TGAb和TPO-Ab水平來判斷HT患者進展為甲減的概率,但是部分患者TGAb和(或)TPO-Ab持續高水平陽性多年而甲狀腺功能正常;部分患者則很快進展為甲減,需要終生甲狀腺激素治療。目前,關于不同甲狀腺功能狀況HT患者Treg水平變化的研究報道較少。為防止HT甲減的出現及進展,有必要進一步探討其免疫學機制。
Treg的功能降低在自身免疫性甲狀腺疾病的發生發展中起重要作用[3]。動物實驗表明,Treg的數量減少和功能降低在Graves病向HT轉換、出現甲減的過程中起重要作用;McLachlan等[4]研究認為,Treg可能在HT患者出現甲減中起關鍵作用。本研究結果顯示,病例組Treg占CD4+T細胞比例及FOXP3 mRNA表達水平均明顯低于對照組,存在Treg的缺陷,而不同甲狀腺功能狀況HT患者Treg占CD4+T細胞比例間無差異,分析其原因可能是由于HT患者的甲狀腺功能狀況與自身免疫活動無直接相關性,也可能與本研究樣本量較小有關;同時,由于獲取的細胞數有限,本研究只抽取了病例組中20例HT患者檢測CD4+T細胞FOXP3 mRNA的表達,也未進行亞組分析。
Zhao等[5]研究認為HT患者Treg的表達水平隨著年齡增長而下降,但兩者的關系仍存在爭議;Karanikas等[6]研究表明,HT患者TPO-Ab水平升高與Th1細胞因子分泌增加相關,認為TPO-Ab水平升高利于自身反應性T細胞活動增強。本研究結果顯示,HT患者Treg的表達與年齡、TPO-Ab水平呈負相關,與文獻報道結果基本一致。
在HT的免疫進程中還有其他CD4+輔助性T細胞的參與,CD4+T細胞亞群中的Th17細胞是誘導自身免疫的輔助性T 細胞,與Treg功能相拮抗。Th17細胞觸發的免疫反應在碘誘導的HT自發性動物模型NOD-H2h4鼠發病中起著不可或缺的作用[7]。濾泡輔助性T細胞(Tfh細胞)通過細胞因子IL-6和IL-21來調節B細胞的功能,可對自身反應性B細胞產生過強的輔助信號,可能引起抗體介導的自身免疫性損傷。Tfh細胞調節異常時,非淋巴組織產生大量的IL-21,可激發廣泛效應,導致自身免疫性炎癥。新近研究表明,自身免疫性甲狀腺炎患者外周血中Tfh細胞比例明顯升高,且HT患者甲狀腺內可檢測到Tfh細胞,甲狀腺內IL-21和Bcl6 mRNA表達水平升高[8]。因此,如能在今后的研究中進一步擴大樣本量,加入Th17細胞和Tfh細胞作為檢測項目,將有助于進一步了解HT的免疫學機制。
1Goodman WA,Cooper KD,McCormick TS.Regulation generation:the suppressive functions of human regulatory T cells[J].Crit Rev Immunol,2012,32(1):65-79.
2Fontenot JD,Gavin MA,Rudensky AY,et al.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
3Nakano A,Watanabe M,Iida T,et al.Apoptosis-induced decrease of intrathyroidal CD4+CD25+regulatory T cells in autoimmune thyroid diseases[J].Thyroid,2007,17(1):25-31.
4McLachlan SM,Nagayama Y,Pichurin PN,et al.The link between Graves′disease and Hashimoto′s thyroiditis:a role for regulatory T cells[J].Endocrinology,2007,148(12):5724-5733.
5Zhao L,Sun L,Wang H,et al.Changes of CD4+CD25+Foxp3+regulatory T cells in aged Balb/c mice[J].J Leukoc Biol,2007,81(6):1386-1394.
6Karanikas G,Schuetz M,Wahl K,et al.Relation of anti-TPO autoantibody titre and T-lymphocyte cytokine production patterns in Hashimoto′s thyroiditis[J].Clin Endocrinol(Oxf),2005,63(2):191-196.
7Horie I,Abiru N,Nagayama Y,et al.T helper type 17 immune response plays an indispensable role for development of iodine-induced autoimmune thyroiditis in nonobese diabetic-H2h4 mice[J].Endocrinology,2009,150(11):5135-5142.
8Zhu C,Ma J,Liu Y,et al.Increased frequency of follicular helper T cells in patients with autoimmune thyroid disease[J].J Clin Endocrinol Metab,2012,97(3):943-950.

