蘇教版選修4“原電池工作原理”教學設計
步月華 李勝榮
(江蘇省丹陽高級中學 江蘇 丹陽 212300)
一、教材分析
本節內容為高中化學新課程(蘇教版)選修4 的專題1 第二單元的重要內容之一。該內容學生在化學2 已有一定的了解,本節是該內容的加深拓展,主要是增加了鹽橋的內容。本節課試圖以“教師巧妙引導,學生自主探究”的學習方式學習,大致分為:回顧原電池,改良原電池,設計原電池,書寫電極反應等幾個基本環節。在課程實施過程中,學生動手實驗,觀察現象,發現問題,提出疑問,分析討論,師生互動,最后找到解決辦法,培養了學生的問題意識、動手能力。
二、教學目標
1.知識與技能
(1)在化學2 的基礎上,進一步學習原電池工作原理,探究單液原電池的不足和改進;
(2)學習實驗研究的方法,能設計原電池,形成完備的原電池概念,理解構成原電池的條件,掌握電極反應式的書寫。
2.過程與方法
(1)通過實驗探究原電池原理,學會觀察、學會提問、學會思考;
(2) 通過對單液原電池與雙液原電池的設計對比,學會比較、評價設計方案。
3.情感態度與價值觀
(1)通過自主探究根據現象設疑,根據疑問求解的模式,進行自主學習,激發學習興趣,培養科學探究態度和科學創新精神;
(2)在小組合作的過程中,培養團結合作的探究學習觀念,強化合作意識。
三、教學思路
水果電池視頻引入→復習原電池工作原理→學生設計簡單原電池→通過實驗現象,學生發現單液原電池缺陷→教師啟發學生,引出“鹽橋”,找到改良方法→師生歸納、總結→學以致用

四、教學過程
[知識回顧]播放水果電池視頻,視頻中用1280 瓣的橙子給手機充電,場面非常震撼。
[教師] 同學們,剛才的視頻中蘊藏著什么化學原理?
[學生回答]原電池原理。
[教師]以下圖所示原電池裝置為例回憶復習原電池的工作原理。
[學生匯報]Zn 為負極,發生氧化反應:Zn-2e-=Zn2+,鋅棒逐漸溶解;Cu 為正極,溶液中的H+在Cu棒表面得電子發生還原反應:2H++2e-=H2↑,銅棒表面冒氣泡。電子從鋅棒流向銅棒,故電流表指針發生偏轉,溶液中陽離子向正極移動,陰離子向負極移動,形成閉合回路。
設計意圖:通過復習以稀硫酸為介質的Cu-Zn 原電池,迅速喚醒已學知識。
[板書]一、原電池工作原理
負極: Zn-2e-=Zn2+
正極:2H++2e-=H2↑
總反應:Zn+2H+=Zn2++H2↑
[教師]通過剛才對原電池原理的復習,請同學們來歸納構成原電池的條件。
[學生](1)兩個活潑性不同的電極,較活潑的為負極;(2)電解質溶液;(3)構成閉合回路;(4)存在自發進行的氧化還原反應。
[教師]對學生的回答補充提升。
內因:自發進行的氧化還原反應;
外因:(1)兩個電極(導體,可同,可不同)
負極:失電子,氧化反應
正極:得電子,還原反應
(2)電解質(提供自由離子——溶液,熔融或固體均可)
(3)閉合回路(“電子岸上走,離子水中游”)
設計意圖:拓展已有知識,加深學生對構成原電池條件的認識。
[引入新知]
提出疑問: 反應Zn+Cu2+=Zn2++Cu 是吸熱反應還是放熱反應? 如何驗證?
探究活動一: 向一只試管中加入1.0mol/LCuSO4溶液30mL,再加入適量Zn 粉,用溫度計測量溶液的溫度,觀察溫度的變化。
教師演示,請一位同學走上講臺觀察實驗現象,并向大家匯報所觀察到的現象。
[學生匯報] 溫度計示數上升,故該反應放熱。
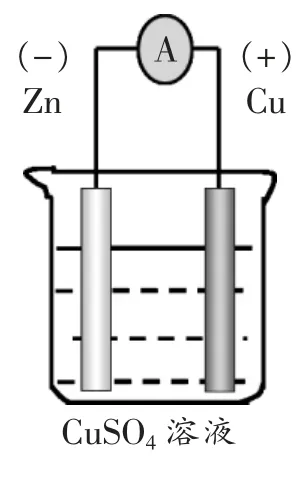
[教師] 既然這是一個對外釋放能量的氧化還原反應,能否將該反應“Zn+Cu2+=Zn2++Cu”設計成原電池? 請畫出裝置圖,寫出電極反應。
[學生]上黑板板演裝置圖及電極反應式。
裝置圖:如左圖。
電極反應: 負極:Zn-2e-=Zn2+
正極:Cu2++2e-=Cu
總反應:Zn+Cu2+=Zn2++Cu
[教師]請大家根據黑板上的裝置圖搭建實驗裝置,觀察現象。
[學生]4 人一組,進行分組實驗。
[教師]請學生匯報實驗現象。
[學生]Zn 棒和Cu 棒表面均有紅色物質析出(用時8分鐘),電流表示數不穩定,逐漸減小。
[教師激疑]Zn 棒表面為什么會有銅析出?
[學生回答]Zn 棒與CuSO4溶液直接接觸,故會發生置換反應,所以Zn 棒表面有紅色物質析出。
[教師補充]對,有這種可能。還有一種可能,Zn 棒不純,Zn 與自身的雜質構成原電池,所以Zn 棒表面會有紅色物質析出。
[教師分析]原電池是在兩處進行的氧化還原反應,一處失電子,一處得電子,正因為在兩處進行,才有電子的定向移動,才有電流的產生,化學能才能轉化為電能。要是在一處進行,就沒有電子的定向移動,就不會產生電流。所以我們不希望鋅與硫酸銅直接發生置換反應,即不希望得失電子都在鋅表面進行。
[教師激疑]如何改進原電池,使化學能盡可能轉化為電能?
[學生]讓Zn 與CuSO4溶液不直接接觸,但仍然形成閉合回路。
設計意圖:先動手設計,后從自己的設計中發現單液原電池的缺陷,激起學生進一步探究改進方法。培養了學生的動手能力和問題意識。
[新知介紹]
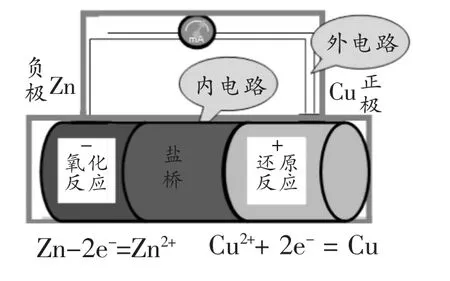
探究活動二:用鹽橋將置有鋅片的ZnSO4溶液和置有銅片的CuSO4溶液的燒杯連接起來,然后將鋅片和銅片分別用導線與電流表相連,觀察現象。
[教師]進行演示實驗,請學生說出實驗現象。
[學生] 電流表指針偏轉,且電流穩定。
[教師]介紹鹽橋:鹽橋中一般裝有含KCl 飽和溶液的瓊脂,K+和Cl-能在瓊脂內自由移動。當將鹽橋拿開,電流表指針不偏轉,故鹽橋起著形成閉合回路的作用。
[教師]走向學生,向學生展示鹽橋,并提問:瓊脂像什么?
[學生]果凍、牙膏、豆腐、漿糊等。
[教師]瓊脂會流出來嗎?
[學生]不會。
[教師]對,瓊脂與果凍、牙膏、豆腐、漿糊一樣,是一種不能流動的固液混合物,以固體為主。
[交流討論]
判斷導線中電子的流向及鹽橋中離子的移動方向,寫出電極反應及總反應。
[學生回答] 電子從鋅棒流向銅棒,鹽橋中陽離子(K+)向正極區溶液移動,陰離子(Cl-)向負極區溶液移動。電極反應為:
負極:Zn-2e-=Zn2+
正極:Cu2++2e-=Cu
總反應:Zn+Cu2+=Zn2++Cu
[教師總結]負極區Zn-2e-=Zn2+,鋅離子進入溶液,使負極區溶液帶正電荷,阻止Zn 繼續失電子進入溶液,從而使原電池反應不能順利進行,故鹽橋中的陰離子(Cl-)將向負極區溶液移動,中和正電荷,使溶液呈電中性,這樣原電池反應才能持續進行。同理,鹽橋中的陽離子(K+)將向正極區溶液移動。正極區和負極區的電解質溶液要不與電極材料反應,一般我們選擇與電極材料對應的鹽溶液,故實驗中我們選擇Zn/ZnSO4溶液、Cu/CuSO4溶液。

設計意圖:通過探究實驗來考察學生對原電池基礎知識的理解,通過對實驗過程中相關問題的探討,幫助學生更好地理解雙液原電池,有助于學生分析問題,解決問題能力的提高。
觀看視頻:探究活動二實驗的微觀模擬動畫。
設計意圖:通過形象的動畫展示,加強形象思維。
[板書]二、雙液原電池的優點
單液原電池的缺陷:電極材料與電解質溶液直接接觸反應,化學能部分轉化為熱能,降低了電池的能量利用效率。
雙液原電池的優點:避免了電極材料與電解質溶液的直接反應,提高了電池效率,增加了電池壽命。
[學以致用]設計原電池
例1:將反應Fe+2Fe3+=3Fe2+,設計成原電池,畫出裝置圖。
[教師分析]將總反應拆成兩個半反應,負極:Fe-2e-=Fe2+;正極:2Fe3++2e-=2Fe2+。根據電極反應式應選擇Fe 作負極,正極材料只要能導電,活動性比Fe 弱就行,若設計成單液原電池,則電解質溶液中必須含有Fe3+。若設計成雙液原電池,正極區電解質溶液中必須含有Fe3+,負極區電解質溶液與負極材料配套選擇含有Fe2+的溶液,裝置圖如下所示:

[板書]三、設計原電池思路
1.寫出總反應的離子方程式,并標出電子轉移方向和數目。
2.寫出正負極反應式。
3.確定電極材料和電解質溶液。
設計意圖:通過設計原電池,進一步強化對原電池原理的理解,強化電極方程式的書寫。
五、教學反思
本節課以“橙子電池給手機充電的視頻”引入,比較新穎,吸引了學生,激發了學生的學習興趣。通過觀看視頻,引導學生回顧了原電池的工作原理,然后再以實驗情景再現為題材,讓學生自己動手設計簡單原電池,通過實驗現象,學生發現了單液原電池的缺陷,激發學生探究改進的方法。鹽橋使雙液原電池形成閉合回路,不僅出乎學生的意料,還又一次激發了學生的興趣,引發了學生的思考。鹽橋的引入不僅是一種技術進步,更是思維模式的改變,也提供了一個思想教育的機會“只有解放思想才能推動社會的進步”。本節課采用實驗探究式教學,既符合化學的學科特點,也符合學生的心理和思維的發展特點。在探究活動中引導學生逐步由認識、形成新認識,這樣得出的結論學生才能真正理解和牢固掌握。實驗探究是讓學生在具體實驗事實的基礎上分析問題得出結論,符合學生的思維特點,有利于在形象思維的基礎上發展學生的抽象思維。整個過程的設計主要以學生的自主探究和合作學習為主要教學方法,體現了學生為主的課堂教學模式,在教學中,學生體驗到了合作學習的好處,嘗到了成功的喜悅。通過精心設計問題,不斷激發學生的學習動機,也就是說使學生經常處于“憤悱”狀態,給學生提供學習的目標、思維和空間,學生自主學習才能真正成為可能。

